奥沙利铂(Oxaliplatin, L-OHP)是继第一代顺铂、第二代卡铂后的第三代铂类抗肿瘤药物, 几项Ⅲ期临床试验[1-2]奠定了L-OHP治疗结直肠癌一线地位。随着临床广泛应用, L-OHP过敏反应逐渐引起重视, 发生率为12%~13%, 其中Ⅲ/Ⅳ度发生率1.6%[3-4], 严重过敏反应威胁患者生命, 喉头水肿和低血压是致死的主要原因, 如不紧急处理, 可能导致死亡。本研究总结分析本院8年间使用L-OHP出现Ⅲ/Ⅳ度过敏反应的30例患者的临床特点, 以期为临床安全用药提供参考依据。
1 资料与方法 1.1 资料来源收集2010年1月至2017年12月于北京市朝阳区三环肿瘤医院住院治疗的30例使用L-OHP致Ⅲ度/Ⅳ度过敏反应患者资料。患者均经组织学病理确诊, 年龄27~68岁, 中位年龄56岁; 既往1例患者对磺胺药物过敏, 其余2 9例均无药物过敏史; 22例患者使用的L-OHP注射液由江苏恒瑞医药股份有限公司生产(商品名为艾恒), 7例患者使用的L-OHP由深圳海天制药有限公司生产(商品名为艾克博康), 1例由南京制药有限公司生产(商品名为奥铂); 术后辅助化疗19例, 晚期一线或二线化疗11例, 接受治疗方案包括两药或三药联合。L-OHP用法用量:每2周重复方案给药剂量85 mg·m-2, 每3周重复方案给药剂量130 mg·m-2, 加入5% GS 500 mL静点3~4 h; 给药前30 min常规预处理:地塞米松5 mg静冲入壶, 苯海拉明20 mg肌注。
1.2 方法过敏反应的分度依据美国国立癌症研究所(NCI)制定的NCI (Ⅴ3.0)标准[5], Ⅰ度:皮肤潮红; Ⅱ度:荨麻疹、全身蚁走感; Ⅲ度:心慌、胸闷、支气管痉挛、呼吸困难; Ⅳ度:过敏性休克; Ⅴ度:死亡。本研究定义Ⅲ度至Ⅴ度为严重过敏反应。
1.3 统计学处理采用SPSS19.0统计软件进行频数分析, 计算百分比。
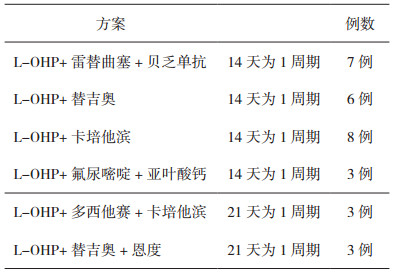
2 结果 2.1 患者化疗方案本组患者均以L-OHP联合化疗或靶向治疗方案, 双周或三周给药间隔时间, 见表 1。
|
|
表 1 30例患者接受的治疗方案 |
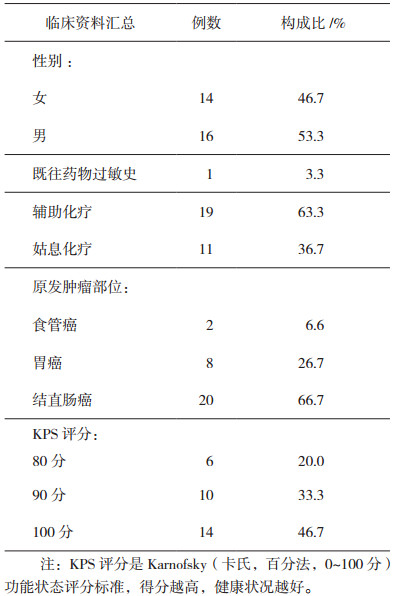
本组患者男性16例, 女性14例; 结直肠癌20例, 胃癌8例, 食管癌2例; 辅助化疗19例, 出现复发转移后化疗11例; 临床资料汇总见表 2。
|
|
表 2 30例患者的临床特征 |
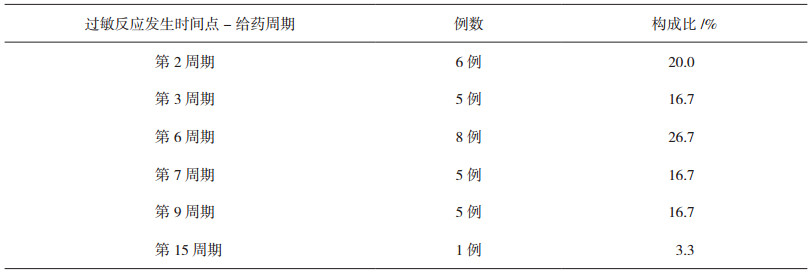
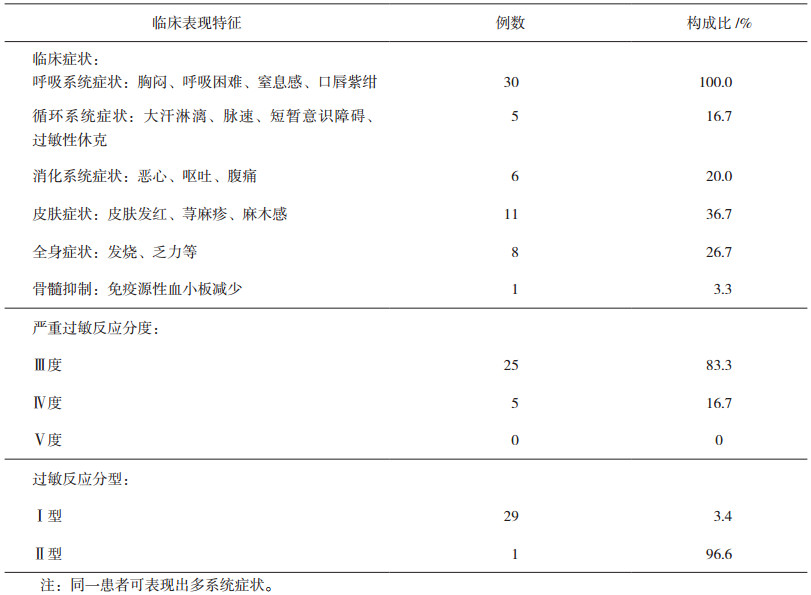
根据患者临床症状、用药先后顺序判断过敏反应为L-OHP所致, 排除其他化疗药及辅助用药引起。30例患者出现严重过敏反应分别发生于用L-OHP第2、3、6、7、9、15周期, 见表 3, 用药即刻出现过敏2例, 用药10 min内出现过敏28例, 病情紧急, 来势凶猛, 呈闪电样发作, 临床表现见表 4。
|
|
表 3 30例患者过敏反应发生的时间点-给药周期 |
|
|
表 4 30例患者过敏反应临床表现、分度、分型 |
根据临床症状、生命体征判断过敏反应分度、分型, 迅速采取治疗措施。①首先立即停用L-OHP, 更换输液器。②一般处理:保持呼吸道通畅、持续低流量吸氧、密切监测生命体征(血压、呼吸、心率、血氧饱和度)。③抗组胺药物苯海拉明20 mg或异丙嗪25 mg肌注, 糖皮质激素地塞米松5~10 mg静冲。④合并过敏性休克患者:肾上腺素0.5 mg肌注, 若需要, 每间隔15~20 min重复一次。联合糖皮质激素、抗组胺药、扩充血容量、多巴胺维持血压。⑤Ⅱ型过敏反应免疫源性血小板减少患者:激素抗过敏、止血、输血对症处理。⑥对发生严重过敏反应患者交代:以后禁用L-OHP。
对患者给予抗过敏治疗约15 min, 其胸闷、呼吸困难等呼吸道症状缓解。5例合并过敏性休克患者约30 min血压恢复正常。1例Ⅱ型过敏反应出现免疫源性血小板减少, 在使用L-OHP化疗累计第15周期出现胸闷、咳血痰, 皮下散在出血点, 血小板下降至最低8×109·L-1, 因伴活动性出血, 生命体征不稳定, 转至重症监护病房治疗, 经急诊输血、止血、抗过敏等抢救治疗, 6天后患者病情稳定, 血象恢复正常。以上30例严重过敏患者均抢救成功, 后续调整化疗方案继续治疗。
4 讨论L-OHP过敏反应分为Ⅰ型过敏反应和Ⅱ型过敏反应。Ⅰ型过敏反应为机体接触变应原, 与嗜碱性粒细胞表面IgE抗体结合或致敏肥大细胞结合, 使细胞活化, 释放组胺等物质引起。临床表现包括以呼吸系统症状为主, 同时可以伴随循环及消化系统症状和皮肤改变, 严重者甚至导致死亡。Ⅱ型过敏反应为细胞毒性反应, 由于特异性lgG或lgM抗体和靶细胞表面抗原结合后激活补体、吞噬细胞和NK细胞引起, 主要表现为严重的血小板减少或者免疫源性贫血。本研究中29例为Ⅰ型过敏反应, 1例为Ⅱ型过敏反应。25例为Ⅲ度过敏反应, 5例为Ⅳ度过敏反应, 无因过敏导致死亡病例。患者发生过敏反应时间点主要见于多周期使用L-OHP后即刻或者用药10 min内, 分别于第2、3、6、7、9、15周期出现, 中位周期数为第6周期(2~15周期), 中位累积剂量1000 mg (200~2100 mg)。在Ohta等[6]研究中比较了240例患者使用FOLFOX6或XELOX方案发生过敏反应情况, 结果提示发生Ⅱ度以上过敏反应时L-OHP中位累积剂量为≥600 mg·m -2。Brandi等[3]在2003年分析124例晚期大肠癌接受含L-OHP方案治疗的患者, 19例发生不同程度过敏, 发生率占7.9%, 出现在再次或多次用药后, 除2例发生在输液结束, 其余均在输注5~15 min左右发生, 其中以Ⅰ型过敏反应为主, 停用L-OHP及抗过敏处理后症状均能缓解, 以上结论与本研究相似。
本研究中有1例Ⅱ型过敏反应病例, 在临床上较为罕见, 患者为老年女性, 过敏发生于接受L-OHP累计第15周期, 较Ⅰ型过敏反应发生晚, 化疗开始10 min皮下散在出血点, 胸闷, 咳血症状, 血小板急剧下降, 用L-OHP后6 h内血小板由205×109·L-1下降至8×109·L-1, 血红蛋白与白细胞无明显下降, 给予抗过敏、输血等抢救措施, 血象恢复正常。Cobo等[7]研究团队回顾分析13例L-OHP介导的自身免疫反应, 绝大多数为女性结直肠癌, 表现为免疫性血小板减少及血红蛋白下降, 且在输液过程中即出现血象进行性下降, 中位周期在第12~17周期, 一般发生在较高累积剂量之后才会诱导发生, 实验室检测出特异性L-OHP依赖性lgG抗体, 包括抗血小板及红细胞抗体。Maindrault-Goebie等[8]报道42例L-OHP过敏反应患者, 有3例(7.1%)严重免疫源性血小板减少(PLT < 2×109·L-1), 发生中位周期晚、临床表现与Cobo[7]、Kim[9]及本研究结论一致。
本研究中的30例患者对L-OHP过敏均未在首次使用出现, 这与紫杉类抗肿瘤药物紫杉醇及多西紫杉醇所致过敏有所不同。紫杉醇或多西紫杉醇发生过敏反应多数发生在首次用药[10], 少数发生在再次或多周期用药后, 且目前国内外文献报道均为Ⅰ型过敏反应, 无Ⅱ型过敏反应。两者相同之处为临床用药即刻或10 min内迅速出现过敏, 以呼吸道症状为主、可伴随循环、消化系统、皮肤等症状, 针对L-OHP及紫杉类药物过敏反应的抢救治疗措施相同。
目前国际上并没有统一的针对L-OHP预防过敏的方案, 但Castells等[11]对L-OHP过敏反应脱敏方案探索分析后指出, 建议首先治疗前20 min给予地塞米松及苯海拉明预处理, 其次稀释L-OHP浓度、延长滴注时间, 可取得一定的效果。两项回顾性研究[11-12]分析了与L-OHP过敏相关的可能危险因素, 包括年轻、女性、挽救性治疗(二线或以上)、单次大剂量用药、"Stop and Go"疗法(即先用L-OHP几周期后停止、在疾病进展后再次使用L-OHP, 此用法能够明显降低L-OHP引起的神经毒性), 以上研究结果可能为临床提供一些参考, 但仍需要进一步扩大样本量进行前瞻性研究, 明确预防效果。
5 结论综上所述, L-OHP严重过敏反应通常发生在多周期后, 与机体产生lgE抗体或者通过抗体依赖细胞介导的细胞毒作用、补体依赖的细胞毒作用等免疫反应有关。过敏反应中位周期数为第6周期, 中位累积剂量1000 mg, 化疗前预处理、稀释浓度、延长滴注时间可能有一定预防效果。Ⅲ~Ⅳ度过敏反应威胁患者生命, 切忌再次使用L-OHP。
| [1] |
Porschen R, Arkenau HT, Kubicka S, et al. Phase Ⅲ Study of Capecitabine Plus Oxaliplatin Compared with Fluorouracil and Leucovorin Plus Oxaliplatin in Metastatic Colorectal Cancer:a Final Report of the AIO Colorectal Study Group[J]. J Clin Oncol, 2007, 25(27): 4217-4223. DOI:10.1200/JCO.2006.09.2684 |
| [2] |
Cassidy J, Clarke S, Diaz-Rubio E, et al. Randomized Phase Ⅲ Study of Capecitabine Plus Oxaliplatin Compared with Fluorouracil/FolinicAcid Plus Oxaliplatin as First- line Therapy for Metastatic Colorectal Cancer[J]. J Clin Oncol, 2008, 26(12): 2006-2012. DOI:10.1200/JCO.2007.14.9898 |
| [3] |
Brandi G, Pantaleo MA, Galli C, et al. Hypersensitivity Reactions Related to Oxaliplatin (OHP)[J]. Br J Cancer, 2003, 89(3): 477-481. DOI:10.1038/sj.bjc.6601155 |
| [4] |
Makrilia N, Syrigou E, Kaklamanos I, et al. Hypersensitivity Reactions Associated with Platinum Antineoplastic Agents:A Systematic Review[J]. MetabBased Drugs, 2010(9): 11. |
| [5] |
Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: Development of a Comprehensive Grading System for the Adverse Effects of Cancer Treatment[J]. Semin Radiat Oncol, 2003, 13(3): 176-181. DOI:10.1016/S1053-4296(03)00031-6 |
| [6] |
Ohta H, Hayashi T, Murai S, et al. Comparison between Hypersensitivity Reactions to Cycles of Modified FOLFOX6 and XELOX Therapies in Patients with Colorectal Cancer[J]. Cancer Chemoth Pharm, 2017, 79(5): 1021-1029. DOI:10.1007/s00280-017-3294-9 |
| [7] |
Cobo F, DeCG, Pereira A, et al. Oxaliplatin-induced Immune Hemolytic Anemia:aCase Report and Review of the Literature[J]. Anticancer Drugs, 2007, 18(8): 973-976. |
| [8] |
Maindrault-Goebel F, Andre T, Tournigand C, et al. Allergic-type Reactions to Oxaliplatin:Retrospective Analysisof 42 Patients[J]. Eur J Cancer, 2005, 41(15): 2262-2267. DOI:10.1016/j.ejca.2005.06.021 |
| [9] |
Kim MY, Kang SY, Lee SY, et al. Hypersensitivity Reactions to Oxaliplatin:Clinical Features and Risk Factors in Koreans[J]. Asian Pac J Cancer Prev, 2012, 13(4): 1209-1215. DOI:10.7314/APJCP.2012.13.4.1209 |
| [10] |
Raisch DW, Campbell W, Garg V, et al. Description of Anaphylactic Reactions to Paclitaxel and Docetaxel Reported to the FDA, with a Focus on the Role of Premedication[J]. Expert Opin Drug Saf, 2011, 10(4): 521-528. DOI:10.1517/14740338.2011.582865 |
| [11] |
Castells M C, Tennant N M, Sloane D E, et al. Hypersensitivity Reactions to Chemotherapy:Outcomes and Safety of Rapid Desensitization in 413 Cases[J]. J Allergy Clin Immunol, 2008, 122(3): 574-580. DOI:10.1016/j.jaci.2008.02.044 |
| [12] |
Parel M, Ranchon F, Nosbaum A, et al. Hypersensitivity to Oxaliplatin:Clinical Features and Risk Factors[J]. BMC Pharmacol Toxicol, 2014, 15(1): 1-6. DOI:10.1186/2050-6511-15-1 |
 2019, Vol. 33
2019, Vol. 33