2013年3月,中国确诊了第1例人感染H7N9禽流感病例[1]。截止2017年12月,临床确诊人感染H 7N9病例1500例,死亡672例,接近45%的致死率和较高的住院率[2]。新出现的H7N9禽流感病毒因其高致病性,潜在的大流行性及耐药性而引起广泛的关注[3-5],世界各国尤其是中国,都在致力于H7N9流感疫苗的研制,以防止H7N9流感病毒的大面积传播,用以保护人民健康[6]。目前,国内四家企业均从世界卫生组织认可的实验室取得了H7N9流感疫苗研发用毒株,研制的H7N9流感疫苗均已完成临床前研究。鉴于H7N9是一种新型重配流感病毒,国内企业与国外企业研发的针对该病毒的预防性疫苗形式以及生产工艺又不尽相同,疫苗临床血清学检测结果在确定合适的免疫剂量以及疫苗临床是否有效方面显得尤为重要。在现有的几种流感血清抗体检测方法中,基于酶联免疫法的微量中和试验法(ELISA-MNT)较之于血凝抑制试验等其它方法具有能够直接检测针对血凝素的中和抗体,并且具有快速、敏感度高、客观性强、特异性好的优点。本研究对抗H7N9流感病毒中和抗体快速检测方法进行了方法学验证及初步应用,为该方法应用于人用H7N9疫苗临床血清学评价奠定基础。
1 材料与方法 1.1 病毒和细胞流感病毒H7N9(A/Anhui/01/2013-NIBRG-268)鸡胚尿囊病毒液由华兰生物工程股份有限公司提供;MDCK细胞由本室传代保存(用含10%小牛血清的DMEM培养基培养,按1 : 4比例传代扩增);霍乱滤液购自美国Sigma公司。
1.2 血清样本接种H7N9流感疫苗的小鼠血清样本由华兰生物工程股份有限公司提供。
1.3 主要试剂和仪器DMEM、胰酶和胎牛血清均购自美国GIBCO公司;牛血清白蛋白购自美国Sigma公司;辣根过氧化酶标记的抗甲型流感病毒核蛋白单克隆抗体由北京万泰生物制品有限公司提供。采用的羊抗H1N1型流感病毒A/California/07/2009血凝素血清参考品,羊抗H3N2型流感病毒A/Perth/16/2009血凝素血清参考品,羊抗B型流感病毒B/Brisbane/60/2008血凝素血清参考品,羊抗H 5 N 1型流感病毒A / Vietnam/1194/04血凝素血清均购自于英国国家生物制品检定所(NIBSC)。
1.4 ELISA-MNT方法的建立参照文献[7]方法进行。预先采用含1%牛血清白蛋白的DMEM将待检血清或者参考品稀释至合适倍数后,再倍比稀释,每个稀释度取50μL,与同样体积的病毒(100 TCID50)混合,在96孔细胞培养板上37 ℃孵育1 h;将1. 5×104个MDCK细胞接种在病毒和血清的混合物中,同时设阴性对照(细胞与病毒稀释液混合培养)和阳性对照(细胞与100 TCID50的病毒混合培养),于37 ℃,置于5% CO2孵箱中培养18~20 h;细胞用PBS洗涤1次,加入4 ℃预冷的丙酮,室温固定10 min;弃去丙酮,加入100 μL HPR标记的抗甲型流感病毒核蛋白单克隆抗体(1 : 4 000稀释),室温孵育1 h;PBS洗涤5次,加入100 μL底物显色液,显色10 min;用1moL·L-1硫酸终止反应,置于酶标仪读数,检测波长450 nm,参比波长620 nm。
按下式计算细胞半数感染域值(X),判定中和反应结果。X =(阳性对照平均A值-阴性对照平均A值)/ 2 +阴性对照平均A值。每孔A值低于X值时,判为中和试验反应阳性,中和反应阳性血清的最高稀释度为血清的中和抗体滴度。
1.5 血凝抑制试验(HI试验)[8]根据文献首先将0.1 mL待检血清预先加入0.4 mL霍乱滤液,37 ℃处理16 h,以鸡血球吸附过夜,取上清进行试验,血清滴度以稀释倍数倒数表示。血清起始稀释倍数为1:10,起始倍数为阴性时,按惯例判定HI滴度为5。
1.6 细胞代次验证分别采用不同代次的MDCK细胞对高、中、低不同滴度的血清样品进行检测,每个样品平行检测三次,比较检测结果中最大值与最小值的比值,以考察不同细胞代次对检测结果的影响。
1.7 准确性检测将阳性血清样本一份,分别进行2倍、4倍,8倍、16倍以及32倍稀释,分别作为独立的样本检测中和抗体滴度,其结果与理论中和滴度值进行比较。
1.8 特异性分析使用NIBSC提供的羊抗季节性流感病毒血清参考品[Anti-A/California /07/2009 HA serum (H1N1),anti-B/Brisbane/60/2008 (B),anti-A/Perth /16/2009 (H3N2)],抗H5N1血清参考品[anti-A/Vietnam/ /1194/04 (H5N1)]以及抗H7N9血清参考品(anti-A/ Anhui/01/2013),分别对NIBRG-268病毒液进行中和检测,考察该方法的特异性。
1.9 精密性分析多次平行检测三个不同滴度的阳性血清样本,考察该方法的重复性。
1.10 改进的微孔板病毒中和方法应用进一步检测接种人甲型H7N9流感疫苗的小鼠血清样本20份,并对其中和结果和血凝抑制结果进行相关性统计学分析。
1.11 统计学分析采用SPSS13.0统计软件对数据进行统计分析。ELISA-MNT和HI法测定的抗体值采用Pearman相关性分析,P<0.05为差异有统计学意义。
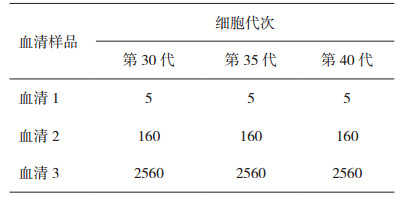
2 结果 2.1 不同细胞代次对检验结果的影响高、中、低三份血清分别采用第30、35、40代次细胞所测得的结果具有很好的一致性,其最大值与最小值的比值均为1。结果见表 1。
|
|
表 1 使用不同细胞代次的检测结果 |
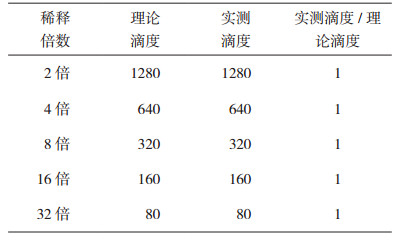
同一份血清分别进行2倍、4倍,8倍、16倍以及32倍系列稀释后, 分别作为独立的样本检测其中和抗体滴度,其实际检测的中和抗体滴度与理论滴度之间的比值均为1。
|
|
表 2 中和抗体滴度检测准确性验证结果 |
采用NIBSC提供的羊抗H1N1,H3N2,B以及H5N1,H7N9不同流感病毒的抗血清参考品分别对病毒液进行中和检测。羊抗H7N9的血清具有较高保护力,其中和抗体滴度高达40960;其他4种血清与抗H7N9抗体的交叉阻断滴度均小于原型别滴度的1.6%,可以确认无交叉反应。
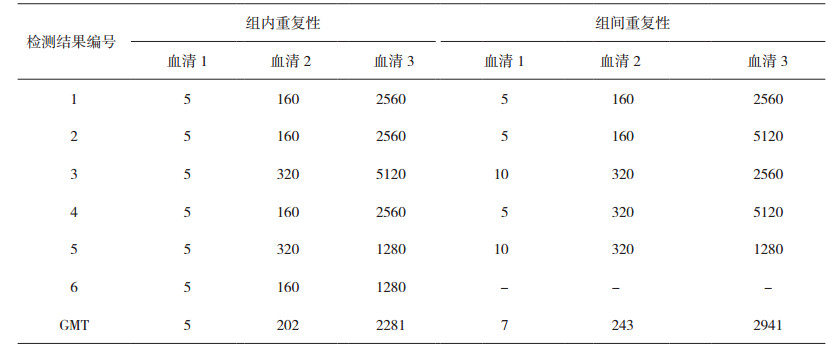
2.4 精密性采用ELISA-MNT法对高、中、低不同滴度的血清进行重复检测,结果见表 3。将GMT转换成以10为底的对数计算CV值,结果显示组内重复性试验的6次平行试验结果的CV值在0~6%之间,其平均值为4%。对同一血清样本不同工作日的5次结果,CV为7%~20%,平均值为11.4%。
|
|
表 3 组间和组内重复性验证结果 |
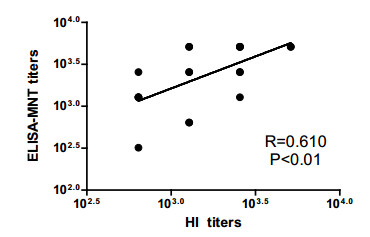
采用ELISA—MNT方法与HI法检测20份小鼠接种人用H7N9裂解疫苗后的血清样本,其中4份血清样本MNT检测的中和抗体滴度值高于HI方法的检测结果4倍,其他16份血清结果MNT和HI的检测结果相差不超过2倍。两种方法检测结果的几何平均滴度分别是2307和1575,MNT法/HI法检测抗体滴度比值约为1.5。两种方法检测结果的散点图见图 1,两种方法的检测结果之间具有较好的相关性(R=0.610)。
|
图 1 ELISA-MNT法和HI法检测血清样本抗体滴度的相关性分析 |
ELISA-MNT方法检测流感病毒中和抗体的原理是将攻击病毒与待测血清中和后,混合接种MDCK细胞,培养18~20 h后,抗流感病毒核蛋白的单抗识别感染细胞中表达的NP蛋白,进一步被辣根过氧化酶标记的二抗特异性识别,作用底物呈显色反应。最终根据试验中阴性以及阳性对照的平均OD值对样品中是否含有具有中和活性的抗体进行判定,中和反应阳性的血清最高稀释度即为血清的中和抗体滴度。H7N9是一种新型禽流感病毒,以前从未记载在人群中传播[9]。相对于其他H7病毒,它的血凝素或者聚合酶基因Q226L、E627K发生突变从而导致该病毒适应人气道上皮,在雪貂模型中证明能够通过呼吸道飞沫传播[10]。鉴于H7N9病毒导致的高致死率,急需研制H7N9流感疫苗,以防止该流感病毒的大面积传播,从而保护人民健康。
本研究对ELISA-MNT方法应用于H7N9大流行流感疫苗中和抗体检测进行方法学性能验证。首先采用不同代次细胞(第30、35、40代次)对高、中、低不同抗体滴度的血清样本检测中和H7N9流感病毒的抗体,测得的结果具有很好的一致性,提示在本系统中40代次的MDCK细胞仍然可以获得较好的结果。其次,对同一份血清稀释不同倍数后,分别作为独立的样本,其实际检测的中和抗体滴度与理论滴度之间的比值均为1,该方法的准确性良好。通过使用不同的抗血清参考品对NIBRG-14病毒液进行中和检测,结果显示只有羊抗H7N9流感病毒的抗血清具有较高保护力,方法特异性显著。最后,通过对3个不同抗体滴度水平的阳性血清多次重复检测,其组内和组间重复性均在15%以内。本研究继续对接种H7N9大流行流感疫苗小鼠的20份血清样本分别采用2种方法检测,结果显示具有很好的相关性。其中所有样本ELISA- MNT检测的中和抗体滴度值与HI方法的检测结果之间的差异不超过4倍,即判别血清滴度的所在稀释度之间相差不超过2个梯度。两种方法检测结果的几何平均滴度分别是2307和1575,MNT法/HI法检测抗体滴度比值约为1.5,表明ELISA-MVN法的敏感性好于HI法,与文献报道[7]一致。
综上所述,ELISA-MNT中和抗体检测方法试验试验周期短只需要2 d,判定结果客观,可用于大量样本的检测,能够满足流感疫苗临床试验的需要。该方法具有良好的特异性、重复性,能够真实地反应待测样本中的中和抗体水平,可以应用于H7N大流行流感疫苗临床试验评价疫苗免疫原性。
| [1] |
Dai J, Zhou X, Dong D, et al. Human Infection with a Novel Avian-origin Influenza A (H7N9) Virus:Serial Chest Radiographic and CT Findings[J]. Chin Med J (Engl), 2014, 127(12): 2206-2211. |
| [2] |
World Health Organization. Latest Risk Assessment Summary of Influenza at the Human-Animal Interface[EB/OL].(2017-10-30)[2017-11-12]. http://www.wh.int/influenza/human_animal_interface/InfluenzaSummaryIRA_HA_interface.
|
| [3] |
Kageyama T, Fujisaki S, Takashita E, et al. Genetic Analysis of Novel Avian A(H7N9) Influenza Viruses Isolated from Patients in China, February to April 2013[J]. Euro Surveill, 2013, 18(15): 20453. |
| [4] |
Gao R, Cao B, Hu Y, et al. Human Infection with a Novel Avian-origin Influenza A (H7N9) Virus[J]. N Engl J Med, 2013, 368(20): 1888-1897. DOI:10.1056/NEJMoa1304459 |
| [5] |
De Groot AS, Ardito M, Terry F, et al. Low Immunogenicity Predicted for Emerging Avian-origin H7N9:Implication for Influenza Vaccine Design[J]. Hum Vaccin Immunother, 2013, 9(5): 950-956. DOI:10.4161/hv.24939 |
| [6] |
Mulligan MJ, Bernstein DI, Winokur P, et al. Serological Responses to an Avian Influenza A/H7N9 Vaccine Mixed at the Point-of-use with MF59 Adjuvant:A Randomized Clinical Trial[J]. JAMA, 2014, 312(14): 1409-1419. DOI:10.1001/jama.2014.12854 |
| [7] |
Rowe T, Abernathy RA, Hu-Primmer J, et al. Detection of Antibody to Avian Influenza A (H5N1) Virus in Human Serum by Using a Combination of Serologic Assays[J]. J Clin Microbiol, 1999, 37(4): 937. |
| [8] |
Kendal AP, Pereira MS, Skehel J. Concepts and Procedures for Laboratory Based Influenza Surveillance[S]. 1982.
|
| [9] |
US Centers for Disease Control and Prevention. Avian Influenza a Virus Infections of Humans[EB/OL]. (2014-4-22)[2018-01-18]. http://www.cdc.gov/flu/avian/geninfo/avian-flu-humans.htm.
|
| [10] |
Zhu H, Wang D, Kelvin DJ, et al. Infectivity, Transmission, and Pathology of Human-isolated H7N9 Influenza Virus in Ferrets and Pigs[J]. Science, 2013, 341(6142): 183-186. |
 2019, Vol. 33
2019, Vol. 33