2. 国家药品监督管理局, 北京 100053;
3. 上海市食品药品监督管理局, 上海 200003
2. National Medical Products Administration, Beijing 100053, China;
3. Shanghai Municipal Food and Drug Administration, Shanghai 200003, China
提到"个性化", 很容易让人联想到"个体化、定制式、精准化"等一系列相近词语。虽然表面看不同词语有些许差异, 但最重要的是探究文字背后的内涵, 特别是人为赋予的内容。他们的共通之处是根据需求"量体裁衣"和"对症下药"。
个性化医疗"并不是新概念, 早在医疗技术尚不发达的年代, 可供外科医生选择的治疗手段很少, 只能就地取材, 创新治疗方法。以骨折治疗为例, 中国古代除了有用竹板外固定骨折部位的方法, 民间更有柳枝接骨内固定的记载。最早的个性化医疗器械逐渐被批量化产品所替代, 治疗的理念从以"患者"为中心, 向以"产品"为中心转移。换句话说, 从给予患者最佳治疗方法, 到为患者选择现有合适的治疗方案, 两者在资源、时间、费用等方面有着本质的差异。
而如今, 个性化医疗重新回到人们的视野中, 甚至有愈演愈烈的趋势, 这背后是科学技术快速发展和公众对于医疗服务需求的增长在推助。比如, 人类基因组序列测定技术的进步, 为精准医疗的实现提供了可能[1]。互联网的普及, 为远程医疗服务的兴起提供了虚拟场所和媒介[2]。3D打印技术的迅猛发展, 为定制式医疗器械的研发提供了机遇。但是, 创新带来临床受益的同时, 也可能引发未知风险, 各国监管部门对于个性化医疗器械这类产品抱有不同的态度, 陆续制定了尺度不一的监管要求, 同时在实施运行中不断发现问题和进行反思。正是基于这一点, 医疗器械监管国际组织开始系统性地开展个性化医疗器械的研究, 制定全球统一的要求, 在保证产品安全性和有效性的前提下, 激发行业的创新热情, 促进新产品的研发应用。
2 个性化医疗器械术语指南介绍IMDRF全称为国际医疗器械监管机构论坛[3], 是由中国、美国、欧盟、加拿大、澳大利亚等多个国家和地区的医疗器械监管部门共同形成的非营利性组织, 共同讨论和协调医疗器械相关法规和政策, 进一步促进全球监管的协调统一。IMDRF下设多个工作组, 负责具体工作项目研究和相应技术文件的起草。WHO、行业协会等机构作为观察员或相关机构参与到工作组的沟通讨论中。
2017年9月, 个性化医疗器械工作组正式成立, 主要研究个性化医疗器械的术语和监管要求。经过一年的文件起草、征求意见和反复讨论, 2018年9月《个性化医疗器械术语》指南将正式由IMDRF管理委员会批准发布, 标志着国际上对于个性化医疗器械"这一大类产品形成了初步统一的认识。
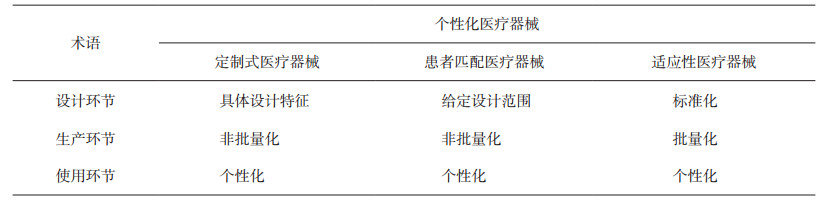
指南内容包括简介、范围、参考资料、定义和示例附录。本文将对定义部分进行解读。在回答什么是个性化医疗器械"这个问题之前, IMDRF将其进一步分解为"哪些医疗器械属于个性化医疗器械"。根据个性化程度从高到低, 将其分为定制式医疗器械(Custom-made Device)、患者匹配医疗器械(Patient-matched Medical Device)和适应性医疗器械(Adaptable Medical Device)。为了进一步区分三者概念上的差异, 将其"个性化"分别拆分到医疗器械设计、生产和使用三个环节展开讨论, 细分其个性化程度(如表 1)。
|
|
表 1 个性化医疗器械的特点分析 |
预期用途或适用范围可以体现医疗器械的本质特征, 也是其风险分类的基础。无论是定制式、患者匹配或者适应性医疗器械, 在临床使用环节均是个性化应用, 这是三者的共同点, 也是个性化医疗器械与其他医疗器械产品的最大区别。换句话说, 设计和生产环节体现了定制式、患者匹配和适应性医疗器械的差异。需要补充的是, 目前大部分的个性化医疗器械多是为了满足人体解剖匹配或特殊的病理情况, 以骨科和口腔医疗器械产品为主。
2.1 适应性医疗器械在适应性医疗器械的生产环节, 引入了"批量生产"的概念, 包括有以下特征:以连续生产运行或同批次生产的医疗器械; 基于标准尺寸或设计; 并非专为特定个人设计。工业化流水线生产实现了单一工种工作效率的最大化, 极大提高了产品的效率。但是, 批量生产的最大特点和目标是产品的同质性, 从某种程度上说, 这与个性化所追求的"精准性"和"差异性"相悖。适应性医疗器械中是一类具有标准化设计、批量生产的医疗器械, 但同时"允许医生根据制造商的验证说明, 在手术中对产品进行一定调整、校正、组装或成型, 来更好地满足个体患者的特定解剖生理特征。"例如, 用于植入脊柱胸腰椎后路, 起到稳定和矫形作用的脊柱后路钉棒系统, 医生需要根据临床需求从螺钉、棒、钩、连接器、多米诺接头等部件中进行选择, 同时, 医生还可能对脊柱棒进行一定程度的弯折, 来更好匹配患者脊柱生理曲线。
2.2 患者匹配器械从本质上看, 适应性医疗器械是在标准化设计的医疗器械基础上, 使用中进行微调, 以适应个性化需求。从设计和生产流程上看, 还是标准产品。但是, 定制式医疗器械和患者匹配医疗器械, 从设计和生产源头, 打破了标准化医疗器械的禁锢, 但两者有何差异呢?如果回溯医疗器械从个性化到批量标准化的过程可以发现, 为了使可供医生选择的型号规格能充分满足大部分人的解剖匹配和生理匹配, 同时, 避免造成不必要的库存和浪费, 研发者对特定区域人口学特征进行统计和分类, 最终将其最具代表性的规格尺寸定型, 这就是标准化设计的医疗器械的来由。
但是在临床使用中发现, 确定一个产品的规格、尺寸、参数有很多, 不同参数的组合才指向一个具体产品, 如一块钢板需要至少确定长度、宽度、厚度及螺钉孔的结构、分布和数量等参数。那么, 实际生产中会考虑到种种因素, 而舍去大部分的参数组合, 保留小部分参数组合。但是, 每个患者的实际情况不相同, 由于型号规格的限制, 可能要"削足适履"而不是"量体裁衣", 从而产生产品与患者结构不匹配和加速疲劳磨损的问题。人体解剖尺寸有一定边界值, 不可能无限大或无限小, 为了给临床使用提供一定的灵活度, 将对规格、尺寸的严格限定延伸为对规格、尺寸范围的限定, 就产生了患者匹配器械。所以, 患者匹配器械具有特定设计范围, 产品的安全和有效性也应经过充分的验证, 不能超过该特定设计范围。在临床应用中, 往往需要采用患者医学数字成像, 并通过DICOM文件保存, 制造商通过3D打印技术快速成型, 获得最终产品, 比如骨科外科手术导板。
2.3 定制式医疗器械医疗对象有时具有更加复杂和难以预测的情形, 比如罕见疾病或罕见的生理结构, 无论是从产品实现性角度, 还是从人道主义角度出发, 定制式医疗器械都是最佳选择。与患者匹配器械不同, 医生在定制式产品的设计中发挥重要的作用, 需要提出具体设计特征, 包括产品的必要特征、配合使用的产品以及与手术相关的具体要求。可以说, 需要制定一套完整的手术方案, 实现真正的个性化治疗。就此可见, 定制式医疗器械其个性化可能完全超出可验证的范围, 同时, 市场上没有可供选择的替代产品。这既是定制式医疗器械的产生条件, 也是它的特点, 即仅用于少数特殊情形。
3 讨论告别手工作业的加工模式, 当今的个性化医疗器械正在越来越多地借助先进技术和科学发展的便利。企业研发时依托行业大数据形成基本的雏形, 并通过预测模型, 对产品的安全性和有效性进行评估, 大幅度缩短产品研发周期。患者影像学数据通过一系列软件的处理和转换, 生成3D设计图, 医生和研发者可以通过互联网平台将其下载到客户端, 在线讨论并快速修改产品设计方案。3D打印技术的快速发展, 不仅实现产品的快速成型, 通过后处理, 其性能也在不断提升, 甚至逼近传统加工工艺。传统医疗模式也在发生转变, 为了给患者快速和最佳的个性化服务, 医院也在深度参与产品的研发、生产和后续处理, 从提供诊治方案到参与产品设计和生产, 其角色在不断地丰富。面对个性化医疗引发的巨大变革, 监管机构也面临着极大的挑战。首先, 监管对象从点扩大到面, 监管环节从企业工厂到医院加工中心, 技术发展日新月异, 全球各国都在寻求合理的解决办法[4]。IMDRF工作组的研究无疑是一次各国监管经验和看法的碰撞和交流。虽然本指导原则涉及范围较窄, 只对个性化医疗器械的分类和定义进行了解读, 但是为今后国际通用的个性化产品监管路径的确立奠定了基础。
个性化医疗器械术语的制定最终是为了政府部门监管所用, 所以在体现产品的自然属性的同时, 一定会考虑监管属性。定义和术语充分考虑现在各国的监管基础和研究进展。目前, 美国、欧盟等国家和地区都有个性化医疗器械相关的法规要求[5]; 韩国等国家有相关的技术审评指导原则。我国从2002年起将定制式义齿纳入医疗器械监管范围[6], 2003年明确了定制式义齿的管理类别和相关注册申请要求[7]。2018年2月, 我国正式发布了《定制式增材制造医疗器械技术审查指导原则》(征求意见稿)[8], 同年9月发布了《定制式医疗器械监督管理规定(试行)》(征求意见稿)[9], 标志着我国个性化医疗器械监管的新纪元。虽然各国对于个性化医疗器械监管有基本的共识, 但是考虑到各国的实际情况, 也会在具体条款和执行层面进行细化要求。例如, 医生参与产品设计是个性化医疗器械的一大特点, 特别是定制式医疗器械, 可能无法参照现有产品设计, 也无法经过传统验证方法对其安全、有效性进行确认。此外, 我国医疗产品与医疗服务分属两个部门监管, 对于这类介于产品与服务之间的情形, 涉及到研发生产、临床使用、使用后追溯和不良事件上报等环节, 考虑到目前医生和制造商的教育背景、工作经验, 以及对医疗器械监管要求的理解和执行能力, 很难将其职责单纯地划分为医生或制造商。
4 结束语我国个性化医疗器械行业发展有着一定的优势。人口基数大, 在健康人群和患病人群队列研究的规模上和样本的多样性上有显著优势; 开展大规模、多中心临床研究的速度和成本也有一定的优势。虽然行业对个性化医疗器械的研发热情高涨, 进展迅猛, 但在产品全生命周期管理的建立和持续改进上仍比较薄弱。无论是成熟企业, 亦或是初创企业, 如果不能在质量管理体系环境下研发新产品, 那么能保证安全和有效性的只是这一个产品, 而不是每一个产品。这对于个性化医疗器械尤为重要。综上, 个性化医疗器械的监管, 与其说是对每批次产品的监管, 不如说是对研发生产责任方能力和执行力的监管。
| [1] |
刘欣然, 袁月鸣, 徐芷涵, 等. 浅谈精准医疗[J]. 当代医学, 2017, 23(21): 195-197. DOI:10.3969/j.issn.1009-4393.2017.21.098 |
| [2] |
吕游. 医疗器械行业在个性化医疗中扮演的角色[J]. 医疗保健器具, 2017(2): 16-18. |
| [3] |
International Medical Device Regulators Forum[EB/OL].[2018-08-26]. http://www.imdrf.org/workitems/wi-pmd.asp.
|
| [4] |
闵玥, 刘斌. 美国定制类医疗器械监管模式介绍与思考[J]. 中国医疗器械杂志, 2017, 41(1): 43-47. DOI:10.3969/j.issn.1671-7104.2017.01.012 |
| [5] |
U.S. Food and Drug Administration. Custom Device Exemption Guidance for Industry and Food and Drug Administration Staff[EB/OL].[2018-08-26]. http://www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm415799.pdf.
|
| [6] |
国家食品药品监督管理局.关于规范口腔义齿生产监督管理的通知[EB/OL].(2002-09-17)[2018-08-26]. http://samr.cfda.gov.cn/WS01/CL0845/9942.html.
|
| [7] |
国家食品药品监督管理局.关于印发定制式义齿注册暂行规定的通知[EB/OL].(2003-12-23)[2018-08-26]. http://samr.cfda.gov.cn/WS01/CL0059/9363.html.
|
| [8] |
国家食品药品监督管理总局医疗器械技术审评中心.关于对《定制式增材制造医疗器械注册技术审查指导原则》(征求意见稿)公开征求意见的通知[EB/OL].[2018-08-26]. https://www.cmde.org.cn/CL0101/6954.html.
|
| [9] |
国家药品监督管理局.关于征求《定制式医疗器械监督管理规定(试行)》(征求意见稿)意见的函[EB/OL].[2018-09-29]. http://cnda.cfda.gov.cn/WS04/CL2051/331175.html.
|
 2019, Vol. 33
2019, Vol. 33