2. 中国药科大学, 南京 210009
2. China Pharmaceutical University, Nanjing 210009, China
药品审评审批制度改革, 影响着医药产业创新发展轨迹、医药产业知识体系、核心竞争力提升等。基于国务院的"放管服""双随机一公开"制度背景, 2015年8月, 《国务院关于改革药品医疗器械审评审批制度的意见》提出了"提高审评审批质量""鼓励研究和创制新药"的政策目标; 2017年6月, 我国药监部门加入国际人用药品注册技术协调会(ICH), 成为全球第8个监管机构成员。现阶段, 政府机构改革、两票制政策与审评审批制度改革共同作用于企业组织结构、创新进度和绩效; 上市许可持有人制度(MAH)、仿制药一致性评价、境外多中心临床数据认可等审评审批制度改革措施, 必将加快我国政府职能转变和产业组织结构调整优化进程。
1 药品审评审批制度改革与供给侧结构性改革 1.1 审评审批制度变迁概述在药品审评审批制度体系中, 药品上市注册的法律法规是整个体系的核心。我国现代药品监管的法规体系始于1978年国家颁布《药政管理条例(试行)》, 并在经历了机构多次行政改革, 审评审批制度逐步从地方分散监管走向集权化审评审批的制度变迁。新药定义从最初的"所有在国内生产上市的药品都按照新药管理"到"境内外均未上市的创新药", 以推进"鼓励新药创制, 严格审评审批, 提高药品质量, 促进产业升级"。化学新药外延的缩小, 将倒逼企业在新药创制活动中更加注重原创性, 促进医药产业组织分类分化, 加快医药行业转型升级。
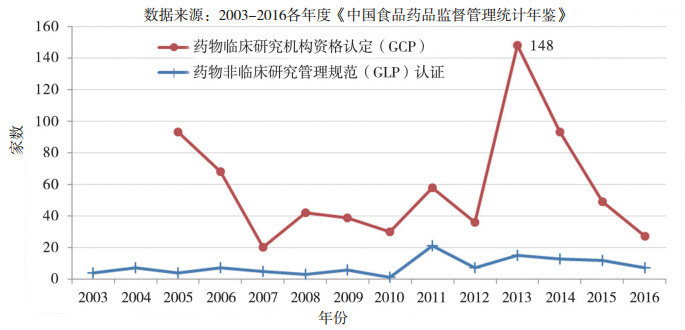
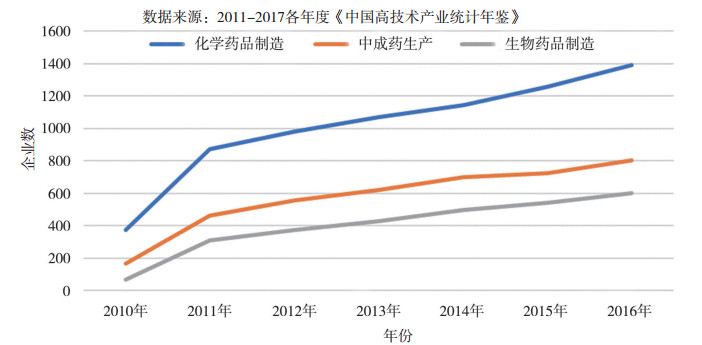
我国药品审评审批制度建设最早来自于2003年8月的《药物临床试验质量管理规范》(GCP)、《药物非临床研究质量管理规范》(GLP)和2004年2月《药物临床试验机构资格认定办法(试行)》。据《中国食品药品监督管理局统计年鉴》数据显示:2013年临床试验研究基地认定通过GCP的有148家; 2016年通过27家, 截至2016年底通过的共有449家; 而GLP认证速度较慢, 2016年仅通过2家, 截至2016年底共有一百一十多家机构通过GLP认证, 结果如图 1所示。虽然进行了药品审评审批制度变革, 但是, 具有R & D活动的医药制造企业数量平衡增长; 2016年化学制造业、中成药生产和生物药品制造分别为1389、803和601家企业, 结果如图 2所示。
|
图 1 2003-2016年GCP认定与GLP认证情况 |
|
图 2 2010-2016年有R & D的医药制造业企业数 |
在全球经济一体化趋势下, 药物"全球同步开发"已经成为一个战略选择。全球各国药品监管部门都在积极探索与之相适应的药品审评审批改革措施。美国政府2012年和2016年相继发布《FDA安全与创新法案》和《21世纪治愈方案》, 我国药品监管部门积极推动药品审评审批制度改革, 于2017年6月成为ICH正式成员。美国FDA、欧盟EMA和日本PMDA等ICH成员都对临床申请采取渐进式审评模式, 进行"备案审评"或"快速审批"的制度安排; 我国药监部门作为ICH成员, 调整药品审评审批制度以适应ICH规则。
1.2 审评审批制度改革核心问题药品审评审批制度改革变迁的政策文件, 源于中国共产党第十八届二中、三中全会, 中国共产党第十九届(以下简称十九大)三中全会提出的"深化行政审批制度改革"等的改革部署; 中国共产党第十九届三中全会提出了"机构编制法定化" "理顺中央和地方职责关系", 从政府组织结构调整的维度提出新时代机构改革方向。因而, 药品审评审批制度改革核心问题, 包括审批集权化、MAH试点、创新药定义缩减、创新活动全球化等几方面。2016年6月, 原国家食品药品监督管理总局明确了"产品上市审批以国家为主、生产企业监管以省为主、销售企业监管以市县为主"的药品监管顶层设计模式, 影响着医药产业组织结构调整的路径和方式。MAH制度试点是药品审评审批制度改革的一项重要内容, 有利于药品研发机构和科研人员积极创制新药, 有利于产业组织结构调整和资源优化配置, 转变医药组织分类规则, 促进专业化分工, 提高产业集中度。
药品审评审批制度变迁与创新活动的全球化程度不断加深。美国《FDA安全与创新法案》提出突破性疗法"的新药上市绿色通道, 以及《21世纪治愈方案》的"真实世界的数据和真实世界的证据"等制度安排, 带动了全球药品审评审批制度变迁。我国政府在医药创新与发展的政策层面也积极推动审评审批制度改革; 2015年8月, 国务院印发《关于改革药品医疗器械审评审批制度的意见》, 明确了"提高药品审批标准、推进仿制药质量一致性评价、加快创新药审评审批"的改革任务。2017年6月, 我国药品监管部门成为ICH正式成员, 协调临床试验数据标准。2017年10月, 中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出"改革临床试验管理、加强全生命周期管理"等改革深化目标任务。
1.3 审评审批制度与政府组织结构基于食品药品安全与人民群众生命健康相关的特殊性, 从九届人大一次会议开始, 药品监管与食品安全经过5次国务院机构调整。伴随着药品行政管理体制改革和政府职能的转变, 尤其是药品审评审批制度改革, 政府与企业、社会的组织之间关系将重新调整。十八大和十九大以来的"放管服""党政军群"机构改革, 将实现政府机构的职能优化协同高效, 同时, 企业组织结构调整和演化进程也将加快。
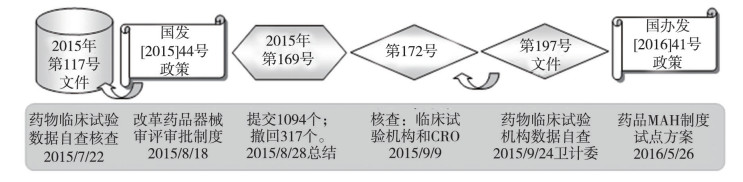
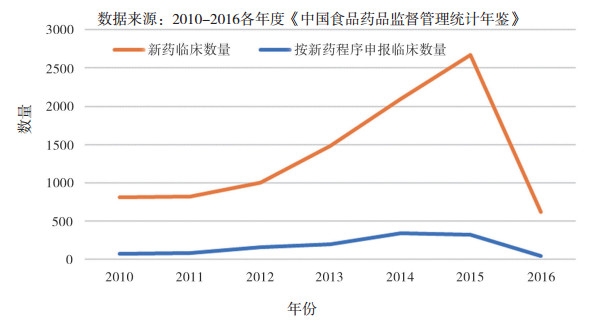
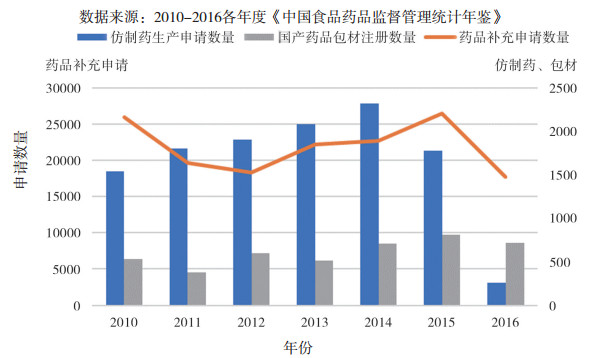
2015年7月, 我国政府在药品上市许可管理环节开展了近两年的药品临床试验数据核查的专项整治行动, 如图 3所示, 肃清了审评审批环节中企业研发环节诚信问题; 我国境内的新药临床试验申请数量从2015年的2674个减少到2016年的626个; 药品补充申请在药品行政受理事项中占了较大的比例; 在仿制药质量和疗效一致性评价工程中, 仿制药生产申请量急剧下降, 而药品包装材料注册变动幅度不是很大, 如图 4及图 5所示。
|
图 3 2015-2016年药品审评审批制度改革与数据核查专项行动 |
|
图 4 2010-2016年新药临床试验申报数量 |
|
图 5 2010-2016年仿制药申请、包材注册和补充申请数量 |
2015年以来的我国政府药品审评审批制度改革进程, 直接影响着医药创新环节的研发组织形式、研发资源配置等的结构性转变; 尤其是临床试验相关的合同研究机构(CRO)、生产阶段的合同生产机构(CMO)、研发阶段的数据服务等组织形式异常活跃, 政府监管组织适时作出调整。上市许可持有人制度对上市许可和生产许可的松绑, 尤其是转变了国有研发机构和社会组织的市场行为主体地位, 激发和加快了医药产业组织结构调整和演化进程, 政府即将目前按环节分类规则转变为MAH和非MAH企业管理分类。
2 审评审批制度变革与企业组织结构调整 2.1 医药行业组织结构调整概述组织是指群体内人们交流的复杂模式和其他关系[1]。组织结构在社会复杂巨系统中起着基础性作用, 组织结构调整与优化是改革核心问题, 特别是在十九大以来的政府行政改革和机构编制法定化建设进程中尤为关键。1978年9月中国科学院钱学森院士在《文汇报》发表了"组织管理的技术-系统工程"; 2018年2月, 十九大三中全会提出了统筹党政军群机构改革""机构编制法定化等组织结构优化系列问题。2012年启动的2011计划协同创新", 即高校创新能力提升计划, 以及地方政府间的政府联席会议, 即是组织结构调整和优化在政企绩效提升中的重要体现。我国政府对医药产业所有制组织结构调整设计, 是一种基于政府的他组织形式, 重心在于国有企业混合所有制改革, 通过国企混改的组织结构调整与制度安排, 使企业行为合理化和市场化, 发挥国有医药企业在药品审评审批制度变革中的市场积极引领作用。
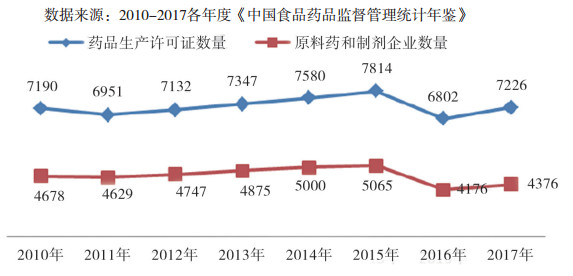
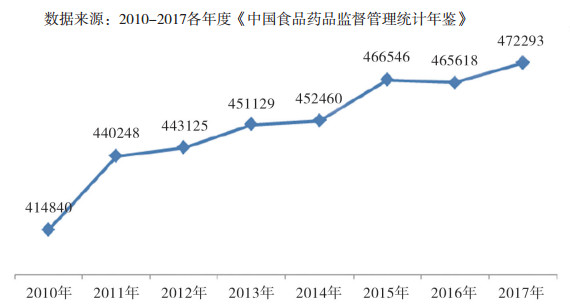
2010-2017年, 从药品生产企业的许可证和原料药、制剂企业数量来看, 2016-2017年受到审评审批制度改革和仿制药一致性评价的影响, 企业数量有所降低, 总体上药品生产企业组织结构调整压力仍然很大, 结果如图 6所示; 2010-2017年药品经营企业数量增长幅度平稳, 两票制政策文件落实和信息化技术应用, 也将推进药品销售环节的组织结构调整(见图 7), 反作用于研发环节组织结构演化进程。
|
图 6 2010-2017年药品生产企业数量 |
|
图 7 2010-2017年药品经营企业数量 |
新药创制是制药企业提升核心竞争力的关键, 是世界各国政府医药竞争的战略制高点, 也是十三五"期间深化科技体制改革, 实施生物医药创新驱动发展战略的基础。药品审评审批制度改革, 一方面来自于政府部门自上而下的制度移植结果, 另一方面也是医药产业专业化分工与审评审批制度滞后之间矛盾问题所致。
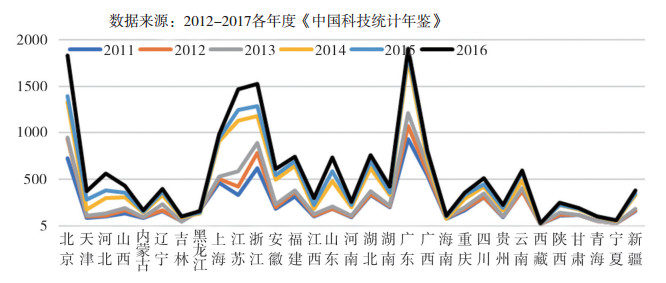
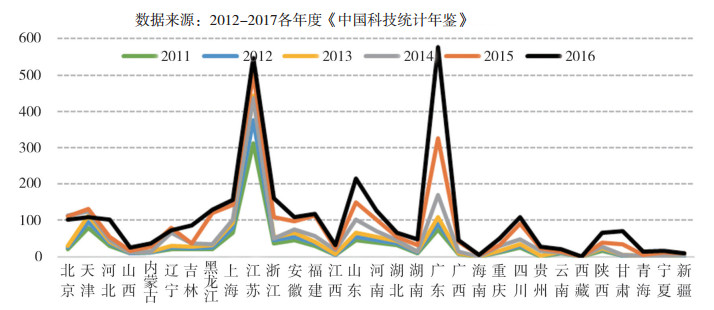
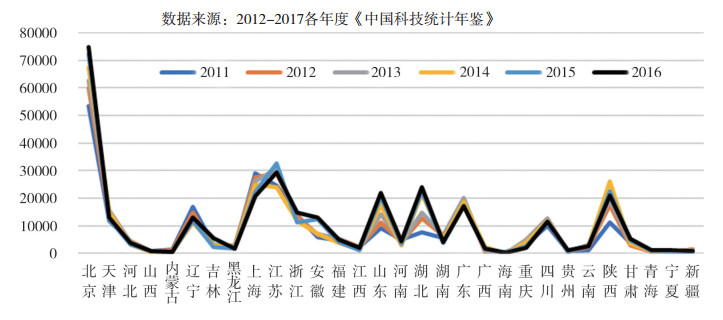
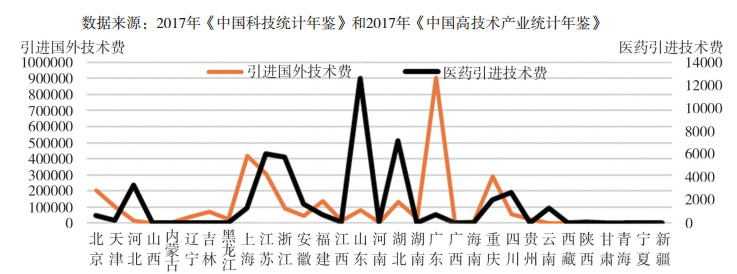
据《中国科技统计年鉴》数据显示:北京、上海、江苏、浙江、广东等省市的科学研究和技术服务业法人单位数居全国前列, 2011-2016年持续增长(图 8); 科技企业孵化器数量方面, 江苏、广东、山东、江苏、上海等省市居全国前列, 2011-2016年持续增长(图 9); 从各省市科技输出结果来看, 北京、江苏、上海、山东、广东、四川等省市的技术市场合同数明显高于其它省市(图 10);外向型科技方面, 北京、上海、江苏、广东等省市的引进国外技术费用高于其它省市, 在医药产业引进国外技术费用方面表现较好的省市包括上海、江苏、浙江、山东、河北等(图 11)。因而, 医药产业发展绩效与科技服务业、科技孵化器社会专业化分工结果具有一定的因果关系。
|
图 8 2011-2016科学研究和技术服务业按地区的法人单位数 |
|
图 9 2011-2016全国科技企业孵化器数量 |
|
图 10 2011-2016技术输出地域的合同数 |
|
图 11 2016年引进国外技术费用与医药产业引进技术费用情况 |
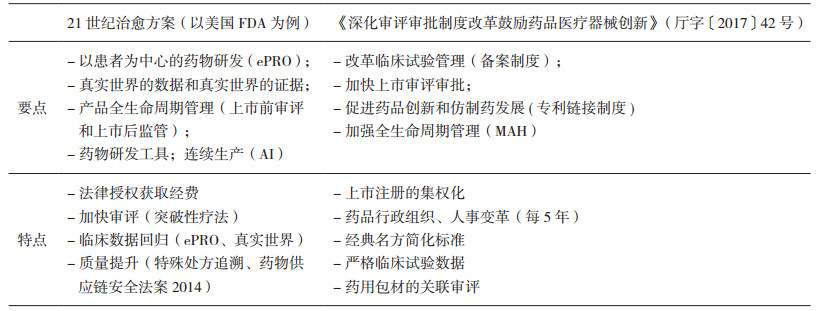
医药产业结构调整宏观上是以区域结构调整为主, 中观层面是组织结构调整和技术结构调整; 微观层面上, 是医药企业间的兼并重组, 即企业所有制结构调整。我国政府药品审评审批制度变革和制度安排的方向, 来自于欧美政府监管部门和ICH相关指导原则。我国和美国政府药品监管部门在加快审批、鼓励创新、提高药品质量等方面具有一致性。从美国《21世纪治愈方案》来看, FDA更注重于临床试验数据回归自然(真实世界数据)和易操作的研发和生产原则; 而我国政府侧重于审评审批组织设计、资源配置和传统医药学等方面, 突出表现在MAH制度、仿制药一致性评价、化学创新药定义方面(表 1)。2017年6月, 我国药监部门成为ICH正式成员, ICH的质量、安全性、有效性和多学科综合的一系列指导原则, 将是我国医药行业创新活动的组织行为准则; 另外, 2016年3月, 国务院办公厅印发《关于促进医药产业健康发展的指导意见》, 提出要"加强技术创新, 提高核心竞争能力; 加快质量升级, 促进绿色安全发展"。因而, 以上诸多政策文件和机构改革凸显了药品审评审批制度变迁趋势, 必将对医药产业供给侧结构性改革产生重大影响。
|
|
表 1 美国FDA和我国政府的药品审评审批制度安排 |
在新古典企业理论中, 企业被视为一个单一代理人, 即企业被作为一个黑匣子来分析; 但是, Coase[2]将市场有效性和现实中企业间的矛盾归结为交易成本的存在, 从而揭示了企业的契约属性; 企业的产生和发展是市场交易的内化结果。Williamson[3]和Klein[4]提出发展市场、企业或科层、混合形式和官僚组织等多种组织结构。Malerba[8]系统描述和总结了影响产业演化及技术变迁的内在因素。张维迎[6]研究了市场经济中企业所有权的制度安排; 杨瑞龙和周业安认为企业最优的治理结构应当是允许的利益相关者共同治理企业。林毅夫[7]、张军和席酉民等围绕国有企业改制, 对企业公司治理与制度安排等进行定性分析和实证研究。
杨小凯[8]提出了当交易服务效率较高时分工与分层组织的演化理论, 即专业化发展将促进交易结构层次数增加。Sanford Grossman和Oliver Hart主要论述了契约的完备性与组织形式的选择问题。余萌[9]认为产业结构调整和优化, 需要产业层次和技术层次的提升; 王广平[10]对中国医药产业组织结构调整路径进行分析, 提出了分化分层和兼并重组的两种调整方案。罗丞[11]认为产业结构的状态及其变化决定着经济增长的速度和质量, 在很大程度上是通过技术创新与产业结构变化的互动机制实现的。基于审评审批制度改革引起的技术创新规则的变动, 医药产业组织结构与技术创新、市场规则、政府机构等调整和转变具有协同性, 即技术变革必然带动企业组织结构调整路径的制度安排。
3.2 模型的设计药品审评审批制度改革影响着医药产业结构调整的路径和方向。基于新制度经济学中的交易费用研究范式, 以及审评审批制度改革、技术变迁和现实创新环境等事实, 医药产业组织结构调整的路径选择与政府在维护企业行为惯例、规则和程序等制度稳定性方面密切相关。
科学技术服务机构、孵化器数量、医药引进技术费、购买境内技术费和组织结构等是影响医药技术结构调整的主要因素。技术创新是技术结构和组织结构调整的引擎, 与政府创新支持和上市许可相关的组织结构指标包括科学技术服务业、孵化器数量有关, 反映企业创新发展的环境依赖程度; 企业组织间交易费用相关指标包括境外医药技术引进经费、购买境内技术经费, 反映医药技术创新外部性对医药企业研发行为的作用程度; 技术交易市场环境指标包括国外技术引进技术合同中技术费用和技术输出地域合同数量, 反映区域技术交易发展对医药研发的影响程度。
以临床试验申报数(Clinic)为因变量构建面板数据(Panel Data)模型, 以科学与技术服务机构数(Service)、科技企业孵化器数(Incubate)、医药技术引进经费(Outdrug)、购买境内技术经费(Indrug)、技术市场合同数(Contract)、国外技术引进技术合同中技术费(Outfee)为自变量, 截面研究对象确定在北京(BJ)、天津(TJ)和河北(HB)等30个省市, 用2010-2016年7年的面板数据, 建立基本回归方程, 进行定量分析, 计算公式如下。其中:C为常数项, 为系数, t为时间序列, i为30省市。
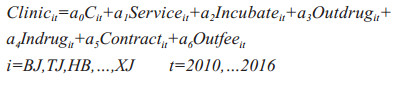
|
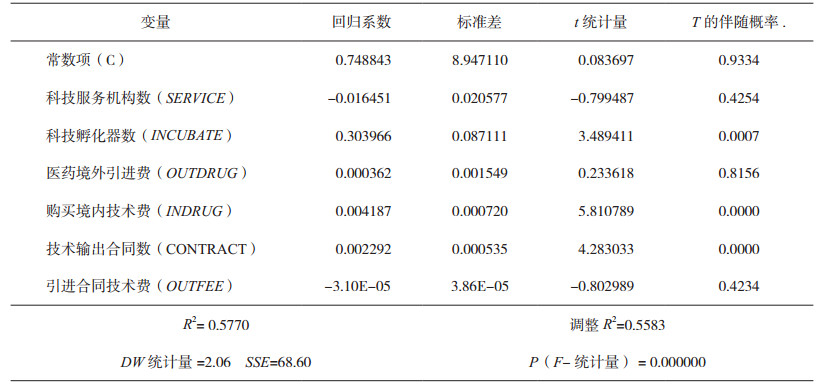
选取样本是在时间维度为7年, 在截面维度为30省市, 采用软件EViews7.0进行分析。为进一步分析创新环境、技术变迁等相关因素对临床试验数据的相关性和影响程度, 采用无个体影响的不变模型; 回归结果显示:回归方程得拟合优度良好, 调整后R2为0.5583, DW值为2.06(表 2)。
|
|
表 2 医药产业交易费用对医药工业产值的回归结果 |
实证研究结果显示:基于审评审批制度改革的医药科技创新结果, 即临床试验申请数量来看, 各省市科技企业孵化器对医药创新行为呈显著性正相关; 科技研究与技术服务机构对医药创新行为无相关性; 境外引进技术中的技术费、医药境外技术引进费用对医药创新行为无相关性; 购买国内技术经费对医药创新行为呈显著性正相关; 技术市场输出地域合同数量对医药创新行为呈显著性正相关。
3.4 结果与结论通过医药产业技术创新组织结构调整的相关因素对新药临床试验申请数的回归分析, 结果显示了审评审批制度改革条件下中国医药产业组织结构调整的现状、重点和路径。
1) 新药临床试验申报行为, 与区域性的科技企业孵化器数量呈显著性正相关, "大众创新, 万众创业"地方扶持政策对新药创制行为有促进作用。政府采用他组织行为, 对生物医药中小微企业进行实质性扶持和服务, 将提升医药产业创新绩效。科学研究和技术服务机构应适应生物医药创新专业化发展趋势, 并转型为专业化的服务机构。
2) 医药企业的境外技术引进行为不具有技术创新的外部性, 而购买境内技术转移对企业申报临床试验行为有显著性正相关, 即国内新药技术转让和技术许可更具有提升生物医药技术创新绩效的积极作用。因而, 药品审评审批制度改革中的境外数据认可和研发全球化的制度安排, 将对国内企业新药创制行为形成一定压力, 需要专业化服务机构加大对中小微企业扶持, 并注重国内医药领域的技术转让和技术许可。
3) 技术转让和技术许可的良好宏观环境条件, 将带动医药技术市场技术转移行为, 对医药企业新药临床试验申报行为有正向作用, 但是境外引进技术服务未能提升新药创制绩效。境外多中心临床试验数据的认可, 有可能降低境外企业技术转移的预期, 因而各省市更应当加大国内医药技术转让和技术许可的政策扶持力度, 以及企业或社会技术服务机构演化为医药技术转移服务平台。
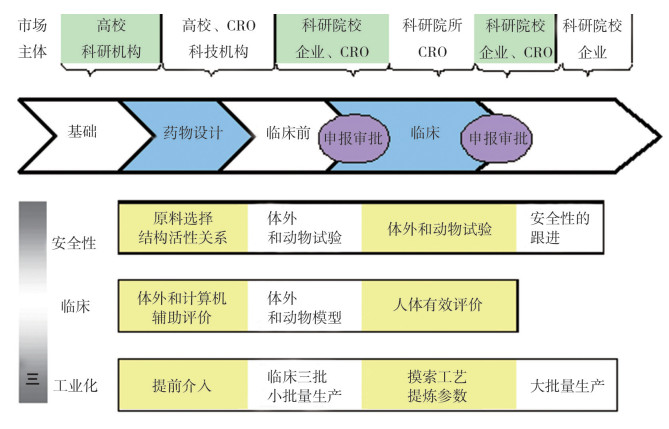
4 基于审评审批制度改革的医药产业组织结构优化路径 4.1 医药专业化分工模式基于我国境内临床资源丰富、制造业GMP改造基础好、人力成本低等优势, 中国正在成为全球合同研发和合同生产的重要基地[12]。以美国FDA创新药"关键路径计划"为模板, 以CRO为组织形式, 对中国研究领域组织结构进行设计(图 12)。基于新药临床试验申报行为与境内技术转移的正相关作用, CRO专业化细分为医药境内技术转让服务平台, 并与地方科技企业孵化器相协同, 共同提升生物医药产业创新绩效。我国医药创新领域的突出表现:当前我国是以高校和国有研究机构为主, 少数企业与CRO合作在创新领域成果显著; 因而, 医药企业和社会团体采用自组织行为, 以"互联网+"科技成果转移转化为核心, 构建和完善医药技术转移区域中心, 促进医药产业组织结构调整和转型升级。
|
图 12 基于专业化分工的药物研发领域的组织结构模式 |
当前, 药品安全管理系统内的监管数据积累增长速度快, 但是, 与之有关的临床核查、监督稽查、行政许可、飞行检查等数据的分析挖掘工作尚未深入开展, 数据附加值不高, 能提供给药品质量的风险监测、评价性抽验以及一致性评价的数据少之又少。尤其是在综合执法改革"职责不同构的背景下, 部分省市监管部门信息共享与信息沟通不畅, 更加依赖于药品安全监管大数据策略, 提高监管的效率和效果。临床试验数据管理系统必须具备可以为临床试验数据提供真实性、可溯源性的性能; 2007年5月, 美国FDA颁布的《临床试验中使用的计算机化系统的指导原则》; 2005年10月, 国际临床试验数据管理学会编制了《良好的临床数据管理规范》。实现药品临床试验、生产、经营数据质量管理过程风险监测, 为药品审评审批制度改革提出数据决策支持。
4.3 国家合作交流平台境外多中心临床试验数据的认可, 以及我国药品监管部门成为ICH正式成员的双重压力, 使得国内新药创制的审评审批标准和研发资源配置均置于全球范围内, 建立国家或区域性国际合作交流平台已是大势所趋。2016年8月, 《"十三五"国家科技创新规划》(国发[2016]43号)提出"在全球范围内优化配置创新资源, 把科技创新与国家外交战略相结合, 推动建立广泛的创新共同体"。在国内仿制药一致性评价工程挤压临床资源、"两票制+营改增"政策等导致研发成本陡然增加, 国内企业采取"走出去"战略实施国际兼并收购现象迭起。例如我国医药企业联合收购欧洲最大的肿瘤研发机构Nerviano Medical Sciences Group (NMS集团), 业务涵盖药物筛选、临床试验和新药定制研发生产服务等。医药创新领域的国家合作交流平台, 逐渐演化为医药企业的自组织行为。医药企业跨国兼并收购并形成新的企业组织结构, 将境外医药技术转移内化为中方企业内部行为, 是境外引进技术提升新药创制绩效的可选路径。
4.4 MAH制度固化模式MAH制度的出台使得上市许可与生产许可分离, 有利于研发和生产资源有效整合, CMO/合同研发生产机构(CDMO)企业作为研发领域发展模式将更加普及。MAH制度作为政府监管行政许可一项重要制度安排, 是政府以资产为中心的药品监管模式的重大变革, 将研发成果产权分割为所有权、生产权、销售权等, 是对参与科研活动的研发组织、研发节点、研发权益等确权; 目前, 按环节分类规则必将转变为以MAH和非MAH企业分类方式, MAH制度呈现出对研发领域的显制度和隐规则的固化作用, MAH成为政企组织结构协调共振现象的关键性因素。当前, MAH制度主要用于解决仿制药一致性评价的产能过剩现象、药品全生命周期管理等方面。MAH制度一方面固化了市场组织的权益, 另一方面对医药产权分割下的知识管理提出了更高的要求; MAH制度必然加速医药产业第三方检验、认证、评估、培训等机构的孕育产生, 以及引发政府监管MAH分类方式的转变。
4.5 科技与金融结合模式科技企业孵化器是培育和扶植高新技术中小企业的服务机构。《国家科技企业孵化器"十三五发展规划》提出"孵化资源基础化、创新技术资本化、孵化资本密集化", 以"满足不同阶段的创业企业对资金的需求"。科技与金融相结合, 实现审评审批制度变迁的医药产业组织调整与转型升级。科技企业孵化器与专业机构相联合, 升级转变为专业化科技服务模型, 提升医药产业新药创制绩效。当前国内临床试验资源不足、人力成本增加、审评审批高标准等问题, 导致研发成本居高不下。激发国内医药企业研发活力、搞活境内医药技术转移市场和提升新药研发绩效, 需要相应的研发基础、技术平台、资金支持等相关资源配置, 科技与金融相结合促进医药领域创新创业更加高效便捷。
5 结束语药品审评审批制度改革, 影响着医药产业创新绩效显现、技术成果转化、医药知识管理、核心竞争力提升等诸多问题。医药产业组织结构调整优化与制度安排的成效, 将促使企业创新行为的合理化和市场化。基于药品审评审批制度重大变迁、研发行为全球化的契机, 一方面分化分层医药产业组织结构和固化企业组织之间的协调规则, 另一方面发挥国有企业的政府他组织形式在药品审评审批制度改革中的市场引领和稳定作用, 促使政府监管MAH分类方式的转变。
| [1] |
Simon H A. Administrative Behavior[M]. New York: Free Press, 1957.
|
| [2] |
Coase R. The Nature of the Firm[J]. Economical, 1937(4): 386-405. |
| [3] |
Williamson O E. The Economic Institutions of Capitalism[M]. New York: Free Press, 1985.
|
| [4] |
Klein B, Crawford R, Alchian A. Vertical Integration, Appropriable Rents and the Competitive Contacting Process[J]. 1978, (21): 297-326. http://www.oalib.com/references/7036408
|
| [5] |
Malerba F. Innovation and Dynamics and Evolution of Industries:Progress and Challenges[J]. International Journal of Industrial Organization, 2006(24): 1-25. |
| [6] |
张维迎. 企业的企业家——契约理论[M]. 上海: 上海人民出版社, 1995.
|
| [7] |
林毅夫, 蔡昉, 李周. 充分信息与国有企业改革[M]. 上海: 上海人民出版社, 1997.
|
| [8] |
杨小凯, 张永生. 新兴古典经济学和超边际分析[M]. 北京: 中国人民大学出版社, 2000.
|
| [9] |
余萌, 刘景卿. 技术创新、金融发展与产业结构调整优化[J]. 经营与管理, 2013(1): 74-77. |
| [10] |
王广平, 丁冬, 张小平. "十二五"期间中国医药产业组织结构调整研究[J]. 中国药事, 2012, 26(10): 1060-1065. DOI:10.3969/j.issn.1002-7777.2012.10.006 |
| [11] |
罗丞, 杨雪燕. 技术创新与我国产业结构调整[J]. 兰州学刊, 2002(3): 19-21. |
| [12] |
任正华, 冯国忠. 创新药物研发产业链与专业化分工[J]. 中国医药技术经济与管理, 2008, 2(8): 39-43. |
 2019, Vol. 33
2019, Vol. 33