本文对2016年至2017年原料药GMP认证检查工作中发现的主要缺陷项目进行针对性的分析,提出相应的对策,为原料药GMP规范的实施提供参考。
1 2016-2017年湖北省原料药实施GMP认证情况概述2016年1月-2017年12月,湖北省原料药生产企业接受了49次GMP认证检查。其中,通过GMP认证检查41次,未通过GMP认证检查8次,不合格率为16.3%。
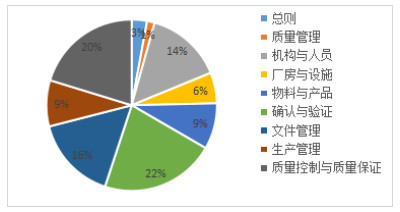
新版GMP认证条款分为12个部分[1],检查中发现主要缺陷项目69个,主要集中在机构与人员、确认与验证、文件管理和质量控制与质量保证方面,占总数量的72%;其次为厂房与设施、物料与产品和生产管理;总则和质量管理主要缺陷项目较少;设备、委托生产与委托检验和自检无主要缺陷项目。现场检查主要缺陷项目分布见图 1。
|
图 1 现场核查主要缺陷项目分布 |
检查中发现主要缺陷项目共2项:1)企业未建立有效的质量管理系统。如企业没有对所购物料定期进行全检;茴香脑检测标准更新不及时;原辅料的检测方法没有确认。2)部分检测仪器未对操作权限分级管理。如IS5红外光谱仪、GC-2010plus型气相色谱仪、岛津LC-20AT液相色谱仪等所使用的电脑没有对操作权限进行分级管理。
2.2 质量管理检查中发现的主要缺陷项仅1项。表现为企业未配备足够、符合要求的厂房和设备设施。如原料药合成区共有10台设备,生产11个品种,其中4台设备不能正常运转,不能满足该线的生产要求;原料药雌激素和雄激素由一般区过滤进入洁净区的物料管道存在共用情况等。
2.3 机构与人员检查中发现主要缺陷项目共10项,可以归纳为两个方面:1)培训内容不全(4项),例如没有结合产品的实际对各工序岗位进行有针对性的培训,没有设计培训总计划的具体实施方案、规定各分项培训的通过率标准、评价方式、考核的量化指标和有效总结要求等;2)培训效果不佳(6项),例如车间班组长对消毒剂酒精的配制不熟悉、空调净化系统操作工对空气净化系统清洁规程培训不到位、检验人员对分析化学检验相关知识不了解等。
2.4 厂房与设施检查中发现主要缺陷项目共4项,主要体现在厂房与设施设计的区域划分不合理或者空间不足。如综合合成车间洁净生产区一更衣与二更衣在同一房间,未设置洗手设施,成盐间存放有离心保护用氮气、废液桶(存放有丙酮、乙醇)、废弃的设备、暂存的物料等,洁净区洗衣间洗衣机的出水口未密封,器具的清洗和洁具的存放在同一房间;洁净区离心洗涤精制间(面积14.48 ㎡)存放有平板式离心机、粉碎机、搅拌机、电子天平等,用于洗涤离心、粉碎、内包三个生产工序,析晶干燥间(11.85 m2)存放设备500 L搪瓷反应釜、VFD-60过滤干燥机,用于析晶、干燥两个生产工序,房间过小不便于清洁、操作和维护;库房设置不合理,企业未设立专用危险品库,危险品与普通固体物料共同储存于一个库房内,如片碱、活性炭和乙醇、甲苯等共库存放。
2.5 物料与产品检查中发现主要缺陷项目共4项,可以归纳成两个方面:1)物料和产品领用、发放、退回不符合国家有关规定。如毒性试剂没有按操作规程由保管员取出领用量后交领用人,而是由领用人自行称量后,将剩余毒性试剂退还保管员,保管员对称量过程未进行现场监督;2)回收溶剂的使用不符合要求。如企业回收丙酮质量标准中杂质分析内容不全,且未规定回收溶剂不得用于产品的精制生产,回收溶剂的管理规程规定进入精制后不得使用回收溶剂,但成品的初精品精制脱色工序中使用了回收溶剂。
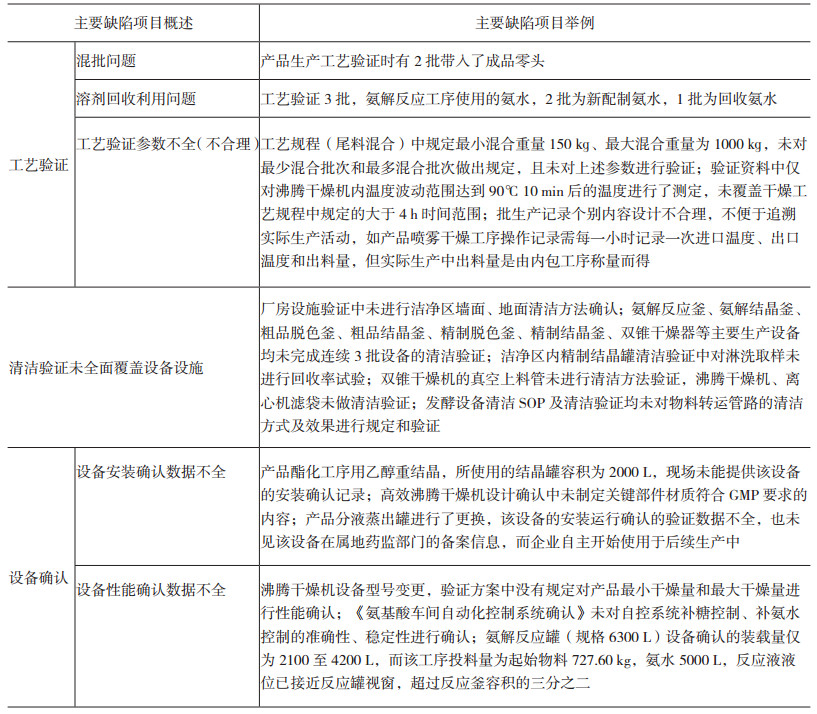
2.6 确认与验证检查中发现主要缺陷项目共15项,主要表现在三个方面,其中包括工艺验证部分(5项)、清洁验证部分(5项)、设备确认部分(5项),主要缺陷项目概述与举例见表 1。
|
|
表 1 确认与验证方面主要缺陷项目概述与举例 |
检查中发现主要缺陷项目共11项,主要表现在三个方面:管理制度文件方面(2个)、操作规程文件方面(4个)、批生产记录方面(5个)。文件管理方面主要缺陷项目概述与举例见表 2。
|
|
表 2 文件管理方面主要缺陷项目概述与举例 |
检查中发现主要缺陷项目共6项,归纳为两个方面:1)交叉污染问题,如一般区中间站存放的不合格粗品与合格品在同一区域,未进行有效隔离;企业干燥间分盘摊粉干燥工序易产尘、交叉污染,操作人员未穿戴专用的防护服;2种原料药共线生产,企业进行了清洁验证,但未对共线的风险进行评估;2)生产操作不规范问题,如原料药合成区动态生产的产品规定的反应温度为(8±2)℃,而实际温度为11℃,未按操作规程进行;产品肟化反应结束后,使用的离心机清场不及时,且离心机内与周转箱有较多黑色颗粒状异物。
2.9 质量控制与质量保证检查中发现主要缺陷项目共14项,主要集中在对照品使用不符合要求(3项)、没有按照要求实施检验方法的确认与验证(3项)、变更偏差处理与纠正措施不符合要求(8项)。质量控制与质量保证方面的主要缺陷项目概述与举例见表 3。
|
|
表 3 质量控制与质量保证方面主要缺陷项目概述与举例 |
做好原料药GMP工作,是一项长期而具有挑战性的工作。对以上主要缺陷项目的总结分析,可以发现原料药GMP工作中存在的一些共性问题,下面通过共性问题,结合原料药产品的自身特点,提出一些针对性较强的建议。
3.1 加强各岗位操作人员培训,落实培训效果原料药的生产与其他药物制剂生产有本质区别,它其实是一个化学反应过程,化学反应中环境、起始物料、设备的差异都会直接对产品收率和质量产生影响。如萃取、滴加、浓缩等单元操作更多依靠的是人员对反应速率、温度、现象、终点的判断[2]。而这种判断是建立在化学知识背景下经过长期有针对性的培训而形成的一种经验。因此,针对原料药生产企业培训工作有以下几点建议:1)培训工作专人负责,需熟悉每种原料药产品特性,制定不同岗位、不同层次有针对性的培训计划;2)培训内容应包括化工物料、合成工艺等方面的知识;3)量化考核指标,总结培训效果。将培训纳入每位员工每月工作内容之一,占据一定绩效考核比例,以月度为周期进行培训考核归档[3]。
3.2 合理设计厂房,加强硬件系统的改造原料药生产具有其特殊性,部分原料药产量小,所需设备简单,通用流水线少,换品种需要改造生产线,当企业把多个品种放在同一生产线上生产时,就会面临企业生产区面积不够,多个生产设备放置在一个功能间的问题。针对以上问题,企业在确定项目计划之后,要对目标产品的生产工艺进行细化,建立生产工艺线路,对生产工艺进行布局,如精制、干燥、粉碎、包装等生产操作应设置不同的功能间,避免生产设备使用期间的交叉污染,同时厂房设计需考虑产能扩大、生产操作人员数量、设备设施规模、不同产品共用生产线等方面问题,设计足够空间的生产区和贮存区[4]。对于已经不能适应新版GMP要求的厂房与设施,要投入改造成本,立足现状确定整改方案,把能够共线生产的产品进行合理规划,扩大生产区面积,更新设备,着眼长远发展,提高整改收益[5]。
3.3 严格把关物料,做好溶剂回收工作在物料与产品方面,原料药具有如下特点:一方面,原料药生产所使用原辅料种类繁多,大多数为化学品,有固体、液体、毒性大的、毒性小的、易燃易爆品等,这导致原料药的管理工作繁重而复杂[6];另一方面,生产原料药要使用大量溶剂,部分企业会使用回收溶剂来减低成本。对于做好物料管理工作有如下几点建议:1)定置管理,无论是哪种原辅料,都需在车间具有实现存放容量需求的存放区域,完成定置存放,设置规范的使用台账,追踪物料动向[7];2)特殊管理,部分危险物料,如有毒有害与易燃易爆等物料在封闭环境下输送、使用及包装;3)回收溶剂管理,回收溶剂要制定相应的操作规程,与成品溶剂有相同的质量标准,有相关验证证明回收溶剂对产品质量无不良影响。
3.4 注重细节,有针对性做好确认与验证工作 3.4.1 工艺验证1)不应混批验证。原料药生产中常常会有上批零头混到下一批中生产问题,导致批次的有效期很难界定,容易将不合格产品与合格产品混批,杂质不能降低,因此,不应进行混批验证。
2)回收溶剂使用需验证。在工艺验证中使用回收溶剂,首先需要3批验证证明回收溶剂对产品质量无不良影响,才能使用回收溶剂进行工艺验证。
3)工艺验证参数全覆盖。工艺验证中需对每个关键工艺参数进行验证,关键工艺参数确认应包括关键工艺参数的鉴别,目标范围的最小和最大值、可接受范围的最小和最大值、工艺步骤等。总结原料药生产中常见工艺验证参数见表 4[8]。
|
|
表 4 原料药生产中常见工艺验证参数 |
原料药设备设施的清洁多采用清洁检查和清洁验证两种管理方式。清洁验证适合于专用设备设施、生产品种单一或生产工艺相似或为同一系列、批次与数量固定的情况,原料药清洁验证需要注意验证细节,如管道、滤袋、残留物限度、取样方法(取样方式、取样点、取样量)、检测方法及要求等。清洁检查适合于多功能设备设施,生产批次与数量、切换品种不固定的情况,该方法则要求每次清洁时都必须取样检测[9]。
3.4.3 设备确认[10]确认是证明辅助系统或设备能够正确安装使用,符合预期目标要求的一系列活动。根据表 1设备确认中发现的问题,总结出原料药生产中常见设备安装确认和性能确认参数,见表 5。
|
|
表 5 原料药生产中常见设备安装确认和性能确认参数 |
一个有效的文件管理体系分为四级文件:一级文件是质量目标和质量方针,二级文件是质量管理文件,三级文件是操作规程,四级文件是质量记录。要形成规范的文件管理体系,必须明确各部门职责和岗位职责,配备有经验的生产和质量管理人员,统一协调文件的编制、批准、修订,形成长效机制,才能逐步建立有效的文件管理体系。
原料药的生产记录与制剂不同,大多数经过化学反应、提取过程,其加料数量、顺序、反应条件(温度、时间、速度等)及控制范围都对生产产生极大影响[11],这给生产记录的填写带来难度,不同产品有不同的生产方式,其记录不能使用固定模板,因此,建议根据产品制定不同的批生产记录模板,保证批生产记录内容完整,达到“做你所写,记你所做”的效果。
3.6 引入风险管理,贯彻执行生产全过程管理原料药生产使用的有机原料多数具有毒性,生产环节涉及多个化学工艺,因此引入风险管理,定期开展安全检查工作,对风险系数高的危险操作实行全面监控,有助于提升操作人员防范意识,严格按照工艺规程进行原料药生产[12-13]。
3.7 重视变更和偏差管理,提高质量意识原料药生产工艺十分复杂,少则几步,多则几十步,不同的工艺会产生不同的杂质种类,同时,原料药质量与设备的选型有着密切的关系,因此,出现企业为了达到质量标准未进行变更和偏差处理擅自更改生产工艺的现象。针对以上问题,应加强对新版GMP中偏差管理、变更控制、超标调查等方面的培训。质量管理部门加强对检验记录和检验数据的复核,出现偏差及时进行偏差处理,并且对检验记录进行全过程审核,包括对照品的来源、批号、纯度及计算方法审核[14]。
3.8 建立职业化检查员队伍原料药合成是一系列复杂的化学反应,对检查员的专业性有较高的要求。需要充实人员,建立职业化检查员队伍[15],有针对性地加强培训,提高原料药GMP检查工作的水平。
| [1] |
卫生部. 卫生部令第79号药品生产质量管理规范: 2010年修订[S]. 2011.
|
| [2] |
胡刚. 从事原料药生产管理需要重视的五个因素[J]. 医药管理, 2012(5): 227-229. |
| [3] |
王小卫. 浅谈新版GMP认证药品生产企业的培训管理[J]. 广州化工, 2013, 41(17): 263-264. DOI:10.3969/j.issn.1001-9677.2013.17.104 |
| [4] |
李昊, 吴桐, 高峰. 原料药生产厂房设计思路及GMP质量体系的实现[J]. 中国新技术新产品, 2015(11): 99-99. DOI:10.3969/j.issn.1673-9957.2015.11.088 |
| [5] |
张春蕾, 刘智勇, 田丽娟. 辽宁省原料药生产企业新版GMP认证检查缺陷分析与对策[J]. 中国药房, 2014, 25(37): 3460-3463. DOI:10.6039/j.issn.1001-0408.2014.37.02 |
| [6] |
夏振华, 邹立昌, 顾毅骏. 原料药生产的GMP问题[J]. 药业纵横, 2008, 17(6): 12-13. |
| [7] |
赫钦钦. 浅析原料药生产车间的现场GMP管理细节[J]. 化工管理, 2017(1): 164-164. DOI:10.3969/j.issn.1008-4800.2017.01.109 |
| [8] |
张全军. 原料药生产验证[J]. 医药工程设计, 2003, 24(1): 23-26. DOI:10.3969/j.issn.1008-455X.2003.01.009 |
| [9] |
国家食品药品监督管理局药品认证管理中心. 药品GMP指南:原料药[M]. 北京: 中国医药科技出版社, 2011: 221-222.
|
| [10] |
赵志远, 林延彬. 原料药生产设施(设备)的选用注意事项[J]. 中国制药装备, 2017(6): 57-59. |
| [11] |
王惠萍, 唐瑞侠. 关于原料药生产车间现场管理质量保证的初探[J]. 中国制药装备, 2014(5): 4-7. |
| [12] |
徐占武. 原料药生产过程风险管理研究[J]. 盐科学与化工, 2018(3): 21-23. DOI:10.3969/j.issn.2096-3408.2018.03.005 |
| [13] |
陈慧萍. 质量风险管理在药品GMP认证检查中的应用[J]. 中国药品标准, 2010, 11(6): 411-413. DOI:10.3969/j.issn.1009-3656.2010.06.004 |
| [14] |
洪钢. 原料药生产企业GMP质量体系缺陷分析与对策研究[J]. 中国药事, 2011, 25(3): 295-300. |
| [15] |
曹秀荣, 邱博, 魏曼, 等. 我省实施新修订GMP认证中存在的主要问题及建议[J]. 医药导报, 2014, 33(4): 61-63. |
 2018, Vol. 32
2018, Vol. 32