2. 中央民族大学, 北京 100081;
3. 太原市食品药品检验所, 太原 030000;
4. 松原市食品药品检验所, 松原 138000
2. Minzu University of China, Beijing 100081, China;
3. Taiyuan Institute for Food and Drug Control, Taiyuan 030000, China;
4. Songyuan Institute for Food and Drug Control, Songyuan 138000, China
菲牛蛭(Poecilobdella manillensis)俗称金边蚂蟥,别名马尼拟医蛭,其化学成分主要含有多种脂肪酸、氨基酸及微量元素等[1-2],药理学有效成分主要是水蛭素、菲牛蛭素A、菲牛蛭素B[3];除此之外,菲牛蛭还含有一些其他的生物活性成分,如抗凝多肽[4]、纤维蛋白溶解酶[5]、透明质酸酶、血管扩张剂[6]、抗血小板聚集活性成分[7]、抑菌活性成分[8]等。菲牛蛭的药理作用主要有抗血小板聚集与抗凝血作用[7, 9-11],抑制血栓形成作用[12-14],降脂作用[15],抗肿瘤作用[16-17],促进血管新生作用[18]。综合菲牛蛭的有效成分、药理作用、作用机制以及分子生物学相关资料,为进一步开发利用菲牛蛭奠定了基础,菲牛蛭作为一种新型药物出现,为防治心血管疾病,尤其为高脂血症患者带来曙光[19]。
云南省于2013年将菲牛蛭收录到《云南省中药材标准》[20]中,广西壮族自治区的壮药二卷[21]中也收录了菲牛蛭,推动了菲牛蛭药材的标准化进程[22]。菲牛蛭的养殖研究已见报道[23-25],在广西等地也存在菲牛蛭的规模性养殖,文献考证菲牛蛭属于传统中医使用的水蛭品种[26],如何将菲牛蛭与其它品种区分开来,对于合理使用菲牛蛭至关重要。目前,对于菲牛蛭品种的鉴别方法主要有垂直平板十二烷基硫酸钠-聚丙烯酰胺凝胶电泳[27]、基因序列及分子进化分析法[28-30]等。
DNA条形码是选用标准短的DNA片段对物种进行快速、准确自动化的鉴定和识别[31]。Paul Hebert首先提倡将条形码技术引进生物的鉴定中[32]。水蛭品种COI序列的DNA条形码研究已见报道[28, 30],本研究针对菲牛蛭素的编码序列设计一对菲牛蛭的特异性引物,通过特异性扩增达到区分菲牛蛭与其他品种的目的。
1 材料 1.1 仪器AB135-S分析天平(Mettler公司),Milli-Q Biocel纯水仪(Millipore公司),MM400球磨仪(Retsch公司),HH-4数显恒温水浴锅(友联仪器公司),ABI Veriti PCR仪(ThernoFisher公司),EPS-301电泳仪(Amersham公司),GelDoc XR+全自动凝胶成像系统(BIORAD公司)。
1.2 试剂DNeasy Blood & Tissue Kit (批号69504, QIAGEN公司); 2×Taq Master Mix缓冲液(批号GK8006, GENEray公司); Gel Red (批号41003, Biotium公司); 琼脂糖(Biowest公司); Tris-base (Sigma公司); 冰醋酸(分析纯, 国药集团化学试剂有限公司); EDTANa2·2H2O (国药集团化学试剂有限公司)。COI引物5'-TAAGAGGTTTACCACCGTTAT-3'和5'-GTAGATGAAG TAGTTGACCCAA-3'(上海捷瑞生物工程有限公司)。
1.3 药材水蛭新鲜样品分别收集自广东省、云南省、广西壮族自治区,药材干品收集自安国、亳州、广州清平药材市场。其中样品SZ-4、SZ-7、SZ-8、SZ-10、SZ-14、SZ-17、SZ-20均由中国食品药品检定研究院郑健研究员鉴定为菲牛蛭,样品信息见表 1。
|
|
表 1 水蛭样品信息表 |
取样品20~30 mg干品,用MM400球磨仪粉碎;新鲜样品用手术剪剪碎,利用QIAGEN公司的DNeasy Blood & Tissue Kit基因组提取试剂盒进行DNA提取。
2.2 聚合酶链式反应及测序PCR反应体系20 μL:2×Taq Master Mix缓冲液10 μL,上下游引物各0.4 μL,DNA模板1 μL,灭菌的双蒸水8.2 μL。PCR反应条件:95 ℃预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸7 min。琼脂糖凝胶电泳检测,凝胶成像。将电泳结果显示为单一明亮条带的扩增产物送英潍捷基进行测序。
2.3 数据处理测序峰图使用CodonCode Aligner 3.7.1软件(CodonCode Co., USA)校对拼接,去除引物区段。将所有序列利用MEGA 5.0软件(molecular evolutionary genetics analysis)分析比对。采用NJ树(Neighbor-Joining Tree)法建立系统发育树,通过bootstrap(1000次重复)对各分支进行支持率检验。
2.4 引物设计在GenBank数据库上可以搜索得到菲牛蛭素的蛋白序列CAA51293.1:MFSLKLFV VFLAVCICVSQAVSYTDCTESGQNYCLCVGSNVCGEGKNCQLSSSGN QCVHGEGTPKPKSQTEGDFEEIPDEDILN;GenBan数据库中,由该段蛋白序列推导出的编码基因的序列为X72786.1:ATGTTCTCTCTCAAGTTGTTCGTT GTCTTCCTGGCTGTTTGCATCTGCGTGTC TCAAGC AGTGAGCTACACTGATTGTACGGAATCAGGTCAG AATTATTGTCTATGCGTGGGAAGTAATGTCTGCGG TGAAGGAAAAAATTGTCAACTGAGCAGTTCTGGA AATCAGTGCGTCCATGGGGAAGGTACTCCGAAGC CTAAGAGCCAGACTGAAGGCGATTTCGAAGAAAT CCCAGATGAAGATATATTGAATTAA;根据基因序列X72786.1利用Primer Premier 5软件设计引物。
2.5 特异性扩增试验根据“2.2”节下的PCR反应体系和PCR反应条件,对软件Primer Premier 5软件设计的引物进行聚合酶链式反应,并对反应产物进行琼脂糖凝胶电泳检测和凝胶成像,以达到对特异性引物验证和筛选的目的。
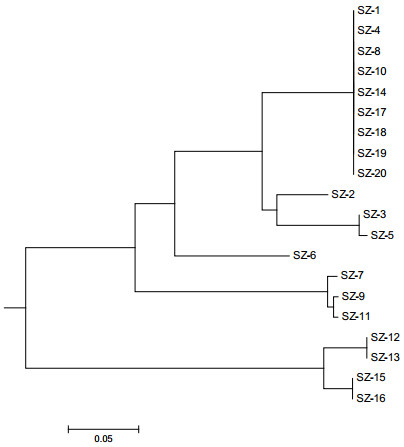
3 结果 3.1 COI序列的NJ树聚类分析水蛭COI序列的测序结果使用CodonCode Aligner 3.7.1软件校对拼接,去除引物区段,得到20批样品的COI序列长度为656bp。将所有序列利用MEGA 5.0软件分析比对。采用NJ树法建立系统发育树,通过bootstrap(1 000次重复)对各分支进行支持率检验,得到基于COI序列建立的NJ树如图 1所示。SZ-4、SZ-8、SZ-10、SZ-14、SZ-17、SZ-20共6个样品经鉴定为菲牛蛭,图 1中SZ-1、SZ-4、SZ-8、SZ-10、SZ-14、SZ-17、SZ-18、SZ-19、SZ-20共9个样品聚为一支,且COI序列完全一致,因此,可以确定这9个样品为菲牛蛭,其他11个样品的COI序列均与菲牛蛭样品存在碱基差异,其中SZ-2与菲牛蛭间的碱基差异最小,为63个碱基,因此,可以确定其他11个样品为非菲牛蛭品种。
|
图 1 基于COI序列建立的NJ树 |
将菲牛蛭素蛋白序列CAA51293.1的编码基因的序列X72786.1输入到Primer Premier 5软件中,综对引物,由捷瑞公司合成引物。引物详细信息如表 2。
|
|
表 2 引物信息表 |
对以上8对引物分别进行PCR扩增和凝胶电泳检测的预试验,根据预试验凝胶电泳检测结果,筛选出能对菲牛蛭样品进行特异性扩增且条带单一的引物,最终确定的引物序列如下:引物7:1)5'-TCTGGCTCTTAGGCTTCG-3';2)5'-GTTGTCTTCCTGGCTGTT-3'
3.4 特异性扩增电泳检测结果利用最终确定的引物7,对本实验中的20批样品进行PCR扩增和凝胶电泳实验,凝胶电泳检测结果如图 2所示,SZ-1、SZ-4、SZ-8、SZ-10、SZ- 14、SZ-17、SZ-18、SZ-19、SZ-20共9个样品得到特异性扩增,将9个样品的COI序列在Genbank上进行比对,可以比对到已上传的菲牛蛭COI序列,且存在0 Gaps,非菲牛蛭样品不能进行扩增。对引物7进行了退火温度的考察,共考察了45℃、47℃、49℃、51℃、53℃、55℃共6个温度梯度,根据考察结果,确定49℃为引物7特异性扩增菲牛蛭序列的最佳退火温度。

|
图 2 特异性扩增电泳检测结果图 |
菲牛蛭具有一定的药用历史,属于传统中医使用的水蛭品种。菲牛蛭中含有的主要化学成分和生物活性成分为其药理作用奠定了基础,使其有可能作为防治心血管疾病和治疗高脂血症的新兴药物出现。不同水蛭品种的活性成分及药效活性往往存在差异,以宽体金线蛭和菲牛蛭为例,两者的活性成分有很大区别,且菲牛蛭比目前广泛应用的宽体金线蛭具有更优的药效活性[14]。菲牛蛭又称金边蚂蟥,其身体两侧的金边为其鉴定特征,但是菲牛蛭死后及其干品金边消失,不易分辨、鉴定,市场上水蛭品种杂多,其中不乏一些进口水蛭药材品种,如何将菲牛蛭与其它品种区分开来,对于合理使用菲牛蛭至关重要。
本研究采用菲牛蛭蛋白序列的编码基因设计特异性引物,PCR扩增结合电泳检测,有效将菲牛蛭与其他水蛭样品进行区分,为菲牛蛭的分子生物学鉴定方法提供了参考。
| [1] |
苗艳丽, 宋文东. 菲牛蛭中脂肪酸和氨基酸的分析[J]. 福建分析测试, 2007, 16(2): 49-51. DOI:10.3969/j.issn.1009-8143.2007.02.014 |
| [2] |
苗艳丽, 方富永, 宋文东. 中药菲牛蛭化学成分的分析[J]. 中成药, 2007, 29(8): 1248-1250. DOI:10.3969/j.issn.1001-1528.2007.08.053 |
| [3] |
黄爱民, 黎肇炎, 廖共山, 等. 广西菲牛蛭消化液中抗凝物质的分离纯化[J]. 中国生化药物杂志, 2006, 27(5): 273-276. DOI:10.3969/j.issn.1005-1678.2006.05.005 |
| [4] |
卢舒凡, 李庆国, 许淑芹. 广东菲牛蛭中有效抗凝物质的分离纯化[J]. 医学研究杂志, 2014, 43(5): 104-107. |
| [5] |
钟小斌, 黎渊弘, 周维海, 等. 广西菲牛蛭中一种纤溶酶的分离纯化[J]. 中国生化药物杂志, 2010, 31(4): 225-227. |
| [6] |
张彬, 龚元, 于翔, 等. 体重、年龄和应激刺激对菲牛蛭繁殖性能的影响[J]. 四川动物, 2012, 31(3): 397-401. |
| [7] |
李文廖, 福龙, 殷晓杰, 等. 七种水蛭抗血小板聚集与抗凝血研究[J]. 中药药理与临床, 1997, 13(5): 33-35. |
| [8] |
黎渊弘, 黎肇炎. 我国菲牛蛭的研究概况[J]. 时珍国医国药, 2008, 19(11): 2716-2718. DOI:10.3969/j.issn.1008-0805.2008.11.067 |
| [9] |
黄爱民, 黎肇炎, 廖共山, 等. 菲牛蛭素体内外抗凝实验研究[J]. 广西医科大学学报, 2006, 3(1): 30-32. DOI:10.3969/j.issn.1005-930X.2006.01.010 |
| [10] |
张彬, 汪波, 龚元, 于翔, 等. 几种水蛭抗凝血物质提取及活性分析[J]. 中山大学学报(自然科学版), 2012, 51(4): 92-96. |
| [11] |
李军, 于翔, 张健, 等. 4种水蛭粗提物抗凝活性及冻存时间对菲牛蛭抗凝活性影响[J]. 水产科学, 2014, 33(9): 591-593. DOI:10.3969/j.issn.1003-1111.2014.09.012 |
| [12] |
黎渊弘, 杨洋, 黎肇炎. 广西菲牛蛭提取物抗动物血栓形成的作用[J]. 广西医科大学学报, 2006(6): 901-903. DOI:10.3969/j.issn.1005-930X.2006.06.008 |
| [13] |
吴志军, 于立华. 菲牛蛭及其制品的抗血栓、溶血栓作用[J]. 中成药, 2007, 29(4): 591-593. DOI:10.3969/j.issn.1001-1528.2007.04.043 |
| [14] |
关世侠, 袁中文, 周郁斌, 等. 不同品种水蛭抗凝抗血栓作用的比较[J]. 中国医院药学杂志, 2012, 32(14): 1093-1096. |
| [15] |
曹斌, 周维海, 韦锦斌, 等. 菲牛蛭对实验性高脂血症血脂及血液流变学的影响[J]. 广西医科大学学报, 2010, 27(2): 198-200. DOI:10.3969/j.issn.1005-930X.2010.02.010 |
| [16] |
黄红坤, 王诺, 王弋, 等. 菲牛蛭提取物对顺铂治疗S180荷瘤鼠减毒作用的研究[J]. 中国民族民间医药杂志, 2014, 23(13): 12-14. |
| [17] |
黄红坤, 郑佳琳, 王诺, 等. 菲牛蛭提取物体外抗肿瘤活性的研究[J]. 时珍国医国药, 2014, 25(12): 2870-2872. |
| [18] |
刘言香, 黎渊弘, 钟小斌. 菲牛蛭素对血管新生作用的研究[J]. 广西医科大学学报, 2014, 31(1): 55-57. |
| [19] |
潘雪, 严亚萍, 林亚明. 菲牛蛭近20年的研究进展[J]. 中西医结合研究, 2015, 7(4): 216-218. |
| [20] |
云南省中药材标准2010年版[S]. 2010.
|
| [21] |
广西壮族自治区壮药质量标准2011年版第二卷[S]. 2011.
|
| [22] |
魏恒, 李敏, 段红宇, 等. 不同试剂处理对菲牛蛭冻干粉抗凝活性的影响研究[J]. 成都中医药大学学报, 2015, 38(1): 37-40. |
| [23] |
冯旭, 孔维军, 杨美华, 等. 菲牛蛭的药理作用及其机制研究进展[J]. 中南药学, 2013, 11(10): 750-753. DOI:10.7539/j.issn.1672-2981.2013.10.009 |
| [24] |
汪波, 龚元, 于翔, 等. 菲牛蛭繁殖性能的初步研究[J]. 北京师范大学学报(自然科学版), 2012, 48(2): 157-160. |
| [25] |
李军, 于翔, 张健, 等. 密度、饲料配比和投饲频率对菲牛蛭成活和生长的影响[J]. 水产科学, 2014, 33(10): 658-661. DOI:10.3969/j.issn.1003-1111.2014.10.013 |
| [26] |
张卫, 张瑞贤, 李健, 等. 中药水蛭品种考证及资源可持续利用发展探讨[J]. 中国中药杂志, 2013, 38(6): 914-918. |
| [27] |
汪波, 张彬, 龚元, 等. 七种水蛭组织细胞可溶性蛋白SDS-PAGE电泳分析[J]. 湖北农业科学, 2011, 50(16): 3423-3425. DOI:10.3969/j.issn.0439-8114.2011.16.057 |
| [28] |
徐云玲, 聂晶, 肖凌. 6种水蛭的COI、12SrRNA和16SrRNA基因及分子进化分析[J]. 生物学杂志, 2013, 30(6): 10-13. |
| [29] |
徐云玲, 聂晶. 水蛭及其近缘物种的rDNA-ITS序列分析[J]. 中药材, 2013, 36(6): 874-879. |
| [30] |
刘晓帆, 刘春生, 杨瑶珺, 等. 基于COI基因的水蛭及其混伪品的DNA条形码研究[J]. 北京中医药大学学报, 2013, 36(1): 63-66. DOI:10.3969/j.issn.1006-2157.2013.01.015 |
| [31] |
郭慧, 王谦博, 贾力维, 等. 中药材DNA条形码技术研究进展[J]. 中国药师, 2016, 19(3): 566. DOI:10.3969/j.issn.1008-049X.2016.03.046 |
| [32] |
HEBERT PD, CYWINSKA A, BALL SL. Biological Identifications through DNA Barcodes[J]. Proc Biol Sci, 2003, 270(1512): 313. DOI:10.1098/rspb.2002.2218 |
 2018, Vol. 32
2018, Vol. 32