在药品无菌制剂生产过程中,过滤作为降低或者去除微生物负荷的一种技术手段,对保证产品质量具有重要作用。目前,除菌过滤工艺已被广泛运用于无菌制剂生产中,除菌级过滤器的无菌过滤效果即截留细菌的能力取决于过滤器的特性及完整性测试的结果[1-2]。因此,选择合适的除菌过滤器以及适当的完整性测试方法至关重要,笔者结合工作实践对除菌级疏水性过滤器两种常用的完整性测试方法进行了比较与探讨,供同行参考。
1 除菌级过滤器的法规要求除菌级过滤器是指在工艺条件下每平方厘米有效过滤面积能够截留107cfu的缺陷性假单胞菌的过滤器,且下游滤液(或滤气)无菌[3]。我国《药品生产质量管理规范(2010年修订)》(简称新版GMP)无菌药品附录第七十五条规定:除菌过滤器使用后,必须采用适当的方法立即对其完整性进行检查并记录。常用的方法有起泡点试验、扩散流试验或压力保持试验[4]。《欧盟药品GMP指南》指出:应该在使用前检查除菌过滤器的完整性,并且在使用后应当立即用适当的方法,如起泡点、扩散流或压力保持试验等方法进行测试确认[5]。美国注射剂协会(PDA)技术报告26版要求过滤器及过滤系统在使用前及使用后均需要进行完整性测试[6]。
除菌级过滤器完整性测试包括确认过滤器的正确安装、灭菌消毒前后过滤器完整性、过滤孔径、滤芯损坏程度、滤芯制造规格及其过滤效果[7],检测O形环、垫圈、密封垫是否存在泄漏,以确定过滤器是否完好。因此,除菌级过滤器完整性测试既是制药企业及医院制剂部门内控标准的需要,也是产品质量风险管理的关键点。
2 除菌级疏水性过滤器两种完整性测试方法比较 2.1 基本原理比较起泡点测试法基于分子表面张力和毛细管原理,与微生物挑战性试验具有直接相关性。滤膜被润湿液润湿后,液体占据过滤孔,润湿液会被固定在毛细孔内,在已润湿滤膜一侧施加一定压力,气体挤出滤膜最大孔中液体所对应的压力即是起泡点压力。起泡点值是在80%滤膜泡点压力下,计算过滤器上游体积,通过测量在加压补气情况下的气体流量而得到的,可依据气体流曲线判断起泡点拐点[8]。原理示意图见图 1。
|
图 1 起泡点测试法原理示意图 |
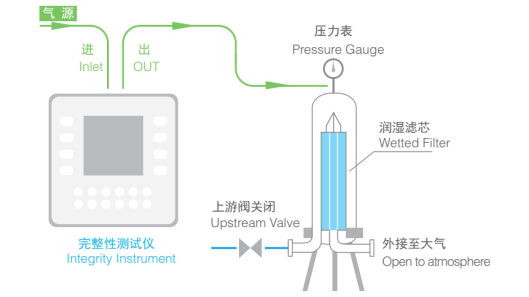
水侵入测试法,又称挤水法,同样基于分子表面张力和毛细管原理,符合美国食品药品监督管理局(FDA)除菌级疏水性过滤器完整性测试要求,水流指标与微生物挑战性试验关联。水侵入测试法操作步骤类似扩散流测试法,但检测时需在过滤器上游注满水,简单定义为把水挤入疏水性膜最大孔的最小压力差[9-10],制药企业一般以一定压力测定水流量的方式测试水侵入值。原理示意图见图 2。

|
图 2 水侵入测试法原理示意图 |
起泡点测试法与水侵入测试法的影响因素及优劣性各异,见表 1。
|
|
表 1 起泡点测试法与水侵入测试法影响因素及优劣性比较 |
不同测试方法的选择需依据法规要求、技术支持、过滤器特性、测试环境、工艺条件等方面进行综合评估,以达到检测操作上的便捷性和高效性,有效保证除菌过滤系统的完整性,降低制药质量风险。起泡点测试法适用于疏水性偏弱的过滤器,其滤膜包括聚偏二氟乙烯膜(PVDF)、聚丙烯(PP)、聚乙烯(PE)等,为确保测试结果的准确性,滤膜过滤面积应小于2000 cm2[9]。润湿液、润湿步骤、清洁验证、在线测试等因素对其在除菌级疏水性过滤器完整性测试的运用上有所限制。水侵入测试法不需要引入有机溶剂等低表面张力溶液进行润湿,在完整性测试结束后稍微烘干即可投入使用,操作简便,更适宜于医院无菌制剂生产过程除菌级疏水性过滤器的完整性测试。但水侵入测试法仅适用于以强疏水性的聚四氟乙烯膜(PTFE)为滤膜的过滤器,对疏水性偏弱的滤膜,因滤膜可部分被润湿,其测试结果存在偏差。
3.2 注意把握四个要点笔者结合医院制剂工作实践,认为完整性测试在无菌制剂生产过程的运用中,应注意把握以下四点:(1)尽可能采取在线测试,以降低设备对接带来的潜在风险;(2)尽可能采用自动测试,以降低滤器下游污染风险[16];(3)尽可能在相对低级别洁净区测试,适当降低完整性检测仪的消毒清洁标准,以利于仪器的保养;(4)尽可能固定检测区,固定气源水源供给条件,减少操作人员的发尘量,保证洁净室的无菌环境。
| [1] |
许真玉. 注射剂过滤除菌工艺的讨论[J]. 首都医药, 2014(14): 83-85. |
| [2] |
赵静, 王忠宝. 浅谈除菌滤芯在注射剂生产中的应用[J]. 机电信息, 2017(8): 45-48. DOI:10.3969/j.issn.1671-0797.2017.08.011 |
| [3] |
徐扬. 过滤器的选择及其在制药领域的运用分析[J]. 健康之路, 2017, 16(9): 233-234. |
| [4] |
卫生部. 卫生部令第79号药品生产质量管理规范(2010年修订)[S]. 2010.
|
| [5] |
国家食品药品监督管理局药品认证管理中心. 欧盟药品GMP指南[M]. 北京: 中国医药科技出版社, 2008.
|
| [6] |
郑军, 郑金旺. 除菌过滤器完整性检测及风险评估[J]. 医药工程设计, 2011, 32(4): 30-33. DOI:10.3969/j.issn.1008-455X.2011.04.007 |
| [7] |
王建军. 过滤除菌工艺与应用探讨[J]. 化工与医药工程, 2016, 37(3): 18-23. |
| [8] |
陆春宁, 郭宇明. 完整性测试气体泡点(拐点)BP值问题的综合分析[J]. 轻工科技, 2016(3): 44-46. |
| [9] |
朱玉洁, 梁毅. 无菌过滤系统完整性测试方法探讨[J]. 机电信息, 2010(20): 15-19, 26. |
| [10] |
熊熊, 张捷. 膜过滤器在位完整性测试仪的开发[J]. 医药工程设计, 2008, 29(2): 20-27. DOI:10.3969/j.issn.1008-455X.2008.02.007 |
| [11] |
郭宇明, 陆春宁. 无菌药品生产除菌过滤完整性测试常见问题的解决方法[J]. 轻工科技, 2016(2): 30-32. |
| [12] |
孙莉莉. 除菌级过滤器完整性测试失败解决方案[J]. 化工管理, 2016(6): 93. DOI:10.3969/j.issn.1008-4800.2016.06.082 |
| [13] |
田宏伟. 以丁醇为润湿介质的除菌过滤器完整性测试研究[J]. 医药工程设计, 2010, 31(3): 16-19. DOI:10.3969/j.issn.1008-455X.2010.03.006 |
| [14] |
黄晓丽, 宋雅丽. 以乙醇为润湿介质的除菌过滤器完整性测试研究[J]. 河北化工, 2012, 35(10): 33-35, 41. |
| [15] |
刘悦. 使用过滤溶媒作为润湿液进行除菌过滤泡点验证[J]. 黑龙江科技信息, 2013(17): 5. DOI:10.3969/j.issn.1673-1328.2013.17.005 |
| [16] |
唐敬军. 除菌过滤器完整性检测方案及风险评估[J]. 机电信息, 2017(20): 15-19, 34. DOI:10.3969/j.issn.1671-0797.2017.20.003 |
 2018, Vol. 32
2018, Vol. 32