2. 山东大学基础医学院, 济南 250012;
3. 山东泰邦生物制品有限公司, 泰安 271000
2. School of Basic Medical Sciences, Shandong University, Jinan 250012, China;
3. Shandong Taibang Biological Products Limited Company, Taian 271000, China
2013年,德国政府提出了“工业4.0”项目,它描绘了制造业的未来愿景。血液制品行业作为制造业的一部分,契合了“工业4.0”概念的绝大部分。“工业4.0”战略旨在通过充分利用信息技术将传统制造业向智能化转型,主要涉及“智能工厂”和“智能生产”两个部分[1]。在“工业4.0”的环境下,对不同数据进行收集和分析将成为未来企业进行实时决策的标准配备。为此,中国政府提出“中国制造2025”项目,以应对新一轮科学革命和产业变革,立足我国转变经济发展方式的实际需求,围绕创新驱动、智能转型、强化基础等关键环节,提出加快制造业转型升级、降本增效的重大战略任务和重大政策举措。
最新版《中国药典》将血液制品定义为源自人类血液或血浆的治疗产品,如人血白蛋白、人凝血因子、人免疫球蛋白等[2]。血液制品具有人源性、稀缺性和潜在传染性,是一种国家战略性资源,其所属的生物产业具有特殊性和高风险性,需要高技术和高投入,由此该行业受到国家重点监管,具有较高的准入门槛。血液制品的质量是指没有“污染物”,治疗效果与产品的标示一样,而且具有重复性,所以血液制品质量的提升、控制是目前生物药物企业的研究重点。质量源于设计(Quality by design, QbD)是制药行业目前广泛采用的智能升级手段。根据QbD概念,血液制品从研发开始就要考虑最终产品的质量,在配方设计、工艺路线确定、工艺参数选择、物料控制等各个方面都要进行深入的研究,积累广泛数据,在对产品质量透彻理解的基础上,确定最佳的血液制品产品配方和生产工艺。目前,一些先进制造企业、高端装备企业已率先结合自身优势发生着重大改革。在制造业领域,基于海量数据的分析已经能帮助企业优化生产质量、节省能源并改进设备服务[3]。
1 血液制品的智能制造新时代与制造行业“工业4.0”相符合的血液制品行业4.0,其变革也需经历自动化、信息化和智能化的3个阶段。自动化可以避免人工成本带来的生产偏差和因偏差引起的一系列成本,使生产出来的产品无差别化,提供稳定产品。信息化是智慧工厂的重要元素,基于大数据的分析将对制造过程进行有效诊断。智能化是“工业4.0”的终极方向,血液制品企业将广泛使用智能制造装备并应用计算机网络技术,实现智能生产,从而构建高效节能、绿色环保的智慧工厂[4-6]。而实际上,在自动化方面,我国仅极少血液制品企业达到一定程度的过程自动化,绝大多数企业还停留在设备控制的单体自动化阶段[7]。生产过程中原辅料的质量控制相当一部分以人工为主,一部分设备还未具备完整的重要质量参数和工艺条件参数的数据输出功能,更未具有对生产制造过程中的实际情况进行统一协调和优化控制的输入条件。在信息化方面,很多血液制品的生产过程不可视,不能实时了解生产现场中的物料、人员、设备等加工状态的动态变化。血液制品生产的特殊性和复杂性也使得关键数据难以准确采集。由此可见,血液制品行业距离“工业4.0”的战略要求还有较大差距[8]。
先进科学技术在血液制品行业的应用正在反逼药品监管政策(如GMP)的改变和调整。利用过程分析技术可以提供实时且连续的质量信息这一特点,从而将血液制品“批量生产”转变为“连续化生产”过程[9],即在生产过程中不间断地进行质量检测,而不必进行最终质量检查即可在产品生产出来后马上放行到市场。在可以预知的将来,采用“连续化生产”方式的药企可以采用足够多的原材料并集中生产出大量血液制品满足市场需求,其优势在于提高设备使用效率,实现更高的生产率并确保血液制品的高质量[10]。国外不少知名制药企业已经走在了实现“工业4.0”的前沿,例如辉瑞公司一直在致力于先进和创新平台技术与解决方案(包括实验设计、产品研发、故障排除和实际操作的网络和虚拟技术)的研发[11],即基于智能的生产理念,利用最新自动化和各学科知识,将连续化生产与实时放行变成现实。自动化、信息化、智能化必将是我国生物医药血液制品行业的必由之路。
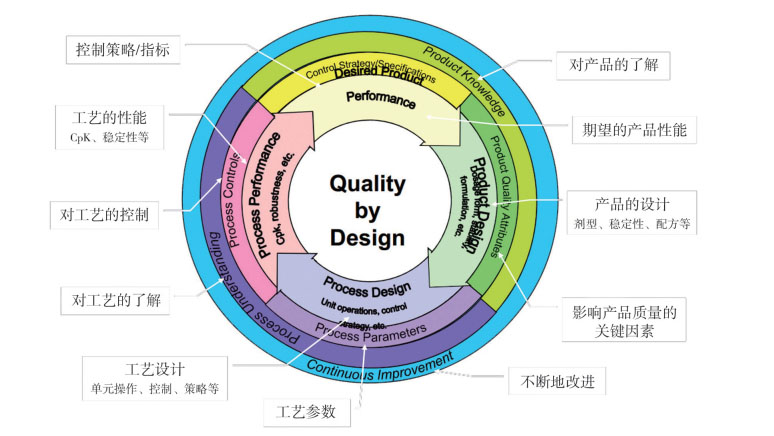
2 QbD与血液制品生产的相关性 2.1 QbD理念QbD由国际著名质量管理大师Juran博士最早提出。1990年Barker出版的《Engineering Qualityby Design》书中,介绍了日本田口玄一(G. Taguchi)博士的质量工程设计方法,特别是实验设计方法在质量工程中的重要性[12]。21世纪初,人用药品注册技术规定国际协调会议(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)发布的Q8中,其定义为“在可靠的科学和质量风险管理基础之上的,预先定义好目标并强调对产品与工艺的理解及工艺控制的一个系统的研发方法”。ICH Q8指出,质量不是通过检验注入到产品中,而是通过设计赋予的。要获得良好的设计,必须增加对产品的认知和对生产的全过程控制,如图 1所示。实施QbD的理想状态是,不需要监管部门过多的监管,实行药品高效灵活的生产,持续可靠地生产出高质量的药品[13-14]。由此推出了QbD这一理念,如图 1所示。

|
图 1 ICH-Q8指导思想下的QbD理念 |
对于血液制品产业来说,QbD理念的应用存在两个方面的困难。首先,血液制品本身具有的复杂性。生物产品往往具有相对分子质量较大、结构复杂的特点,因此针对其的检测手段要求比较高。第二,生物产品生产工艺具有复杂性。生物产品的生产工艺比较复杂,为了避免产品质量的波动,生产企业也很少将小试规模放大到生产规模,这都限制了QbD在生物制药领域的发展。同时也给生物制药领域带来了机遇与挑战,QbD在生物制药领域的应用,将提高对于产品的质量属性以及对于生产过程的理解,以便于产品生产规模的放大,优化产品的生产工艺与控制步骤,提高产品质量的稳定性,占领产品质控的制高点,推动生物制药企业采用更加先进的技术来保证药物的生产[15-16]。
2.3 QbD理念在血液制品的应用思路QbD作为一种系统开发方法,它从预定的目标开始,基于科学和质量风险管理技术,强调了解血液制品生产过程及控制其生产过程[17]。根据QbD,在血液制品的研发阶段就要考虑最终产品的质量,对处方、工艺路线、工艺参数等各个方面都要进行全面研究,以增强对血液制品及其生产过程的了解,如图 2列出了各方面的研究思路。
|
图 2 基于QbD理念下针对血液制品生产的研究思路 |
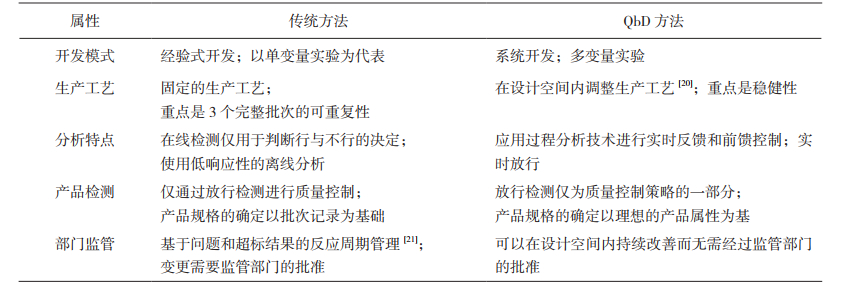
与传统方法相比(见表 1),通过QbD对血液制品生产的讨论研究,可以加深对产品质量的理解,解决产品生产过程的波动性,降低生产时间及返工率[18]。具体表现:可确定基于临床疗效的血液制品规格;通过加强血液制品和工艺设计、理解和控制,提升过程能力,减少产品质量波动和缺陷;提高血液制品开发和生产的效率;加强根源原因分析和血液制品批准后变更管理;建立血液制品临床疗效与血液制品质量属性之间的关系,所设计的稳健处方和生产工艺可保证生产出更加符合规格、质量一致的血液制品,提高产品质量的稳定性[19]。同时,血液制品企业将QbD的理念植入产品的整个生产过程,可提高员工对于产品质量的认识、企业的管理能力、智能化管理水平,从而使药物更有效,最终保证病人的用药安全[9]。
|
|
表 1 传统方法与QbD方法比较 |
QbD对我国血液制品企业的挑战,一是理念上的挑战,二是现有体系的整合。QbD与现有GMP并不矛盾,而是加深。企业对生产过程要做出很深入的研究,就需要适当地采用过程分析技术。基于QbD的理念,为鼓励制药工业中的创新, 减轻生产者对采用新技术可能导致管理僵化的顾虑, 2002年美国FDA正式推出PAT计划, 目的是鼓励将PAT引入药品生产和质量控制。2004年,美国食品药品管理局(U.S. food and drug admistraton, FDA)发布了过程分析技术(Process Analytical Technology,PAT),是指使用一系列工具以保证产品的质量和生产过程的可靠性,提高工作效率的技术[22]。通过在线工艺分析仪器,对原材料、在线物料以及工艺过程的关键质量属性特征进行及时测量[23],并对这些数据进行分析和统计,形成有效的数据模型,最终来设计、分析和控制生产加工过程,以确保最终产品质量,如图 3。PAT由经典分析化学、化学工程、电子工程、工艺过程、自动化控制及计算机等学科领域相互渗透交叉组成[24]。目前,在国际上使用的PAT工具包括:过程分析仪器、多变量分析工具、过程控制工具、持续改善(CI)/知识管理(KM)/信息管理系统(ITS)等[25]。近年来,基于过程分析技术的QbD理念在国外知名制药生产商如Pfizer、GSK、Sanofi aventis、Johnson & Johnson、Merch、Roche、Novartis中取得进展。

|
图 3 过程分析技术(PAT)在血液制品QbD中的应用 |
对于血液制品生产过程,PAT的核心理念就是血液制品质量是建立在其生产过程里,而不是检测出来[26]。PAT强调实时从生产过程中获得信息,而不是从最终产品获取信息;PAT强调了解生产过程,也就是要明确原料、过程参数与最终产品质量之间的关系[27-28]。同时,PAT并不是简单地利用一些在线分析仪器采集生产过程中的数据,而是透彻了解血液制品生产过程才是首要目的,知道应该采集什么数据,如何处理数据,以及从数据可以得到什么。有许多技术工具可以提供快速、有效的方法来获取信息,加快实现对生产过程的了解[29-30]。
3.3 针对血液制品的PAT应用困难我国血液制品生产企业长期以来采用比较传统的生产方式,过程分析的需求和观念相对比较淡薄,生产控制水平仍为常规仪表加人为控制的水平,控制方案简单,控制效果不尽人意;而且大多数血液制品企业由于实现过程分析采用的技术成本相对较高,在我国整体人力资源条件下,推动该产业生产自动化的工作有不少阻力,且生产过程分析还有许多关键难点有待突破。例如血液制品生产过程中从原料、辅料、中间品到最后成品的物流转移大多还是人工的,且许多操作过程仅凭经验来完成,缺乏合适的在线质量监测手段。虽然血液制品行业在此方面已经有所行动,但是比较缓慢,且大多企业在采用过程分析新技术时十分谨慎。
3.4 PAT应用对血液制品企业的影响PAT,作为QbD理念的推动者,可对血液制品企业产生以下的影响:降低操作运行成本(如缩短生产周期、增加产量等),缩短生产单元操作时间[23];改善产品质量,减少或防止次品、废品的发生,降低药品不合格率,减少生产中再处理的发生率等;提高安全性和减少环境污染,提高药品生产能力,降低生产能耗等;提高药品生产的自动化程度,增强工人劳动保护,减少人工操作失误,实现放行产品;促进实现药品连续化生产[31-33]。随着FDA过程分析技术创新行动计划的公布和QbD理念的相继推进,预计在血液制品生产行业中PAT市场的份额将快速增长,同时也意味着过程分析技术正在或已经步入工业化阶段。
4 QbD理念在血液制品关键质量环节的实施除血液制品的用药结构与水平和国际市场有着显著的差异外,在集中程度上与国外相比,国内血液制品市场也较为分散,但是集中化的趋势已经非常明显。目前,全国前五的血液制品公司已经控制了大部分的浆站资源,旗下的浆站数量占全国总浆站数量的60%以上。由于政府在血液制品企业准入等政策上设置了高门槛,所以大型公司在设置浆站方面更有优势,这一占比在未来还将不断扩大。政府鼓励行业整合,目的在于淘汰小型企业,发展大型企业,达到充分利用血浆资源,促进行业的发展,更重要的是有利于监管,保障血液制品的安全性。中国血液制品市场是否会像美国一样走向寡头垄断或许只是时间问题。面对不断的行业兼并,如何保持行业优势成为每个血液制品企业思考的问题。制药行业“工业4.0”时代的到来势必对自动化水平仍然低下的血液制品行业以冲击。一旦全面市场化从垄断到竞争,孰能生存仍未可知。
目前,血液制品企业生存的关键在于采用新技术降低成本。除了通过技术创新,从血浆中分离更多的药物蛋白以增加利润外,在工艺方面,加大技术投入,提高现有优势产品的收率和质量,通过对大数据的累积加深对工艺过程的理解,从而避免人为损失使工厂智能化运转,也是未来发展的首要任务之一[34-35]。
目前,对于血液制品企业来说,产品质量控制方法为传统的质量控制方法,产品的产率、控制水平有待进一步的提高。在血液制品企业实施QbD,基本工作包括:定义血液制品的目标质量概貌(qualitytarget product profile,QTPP),并依此确定关键质量属性(critical quality attribute,CQA);设计并了解血液制品,确定关键物料属性(critical material attribute,CMA);设计并了解生产工艺,包括确定关键工艺参数(critical process parameter,CPP),工艺放大原则,建立CMA、CPP和CQA之间的关系;建立控制策略,包括原辅料及产品规格,以及各生产单元的控制;过程能力及持续改进[36-37]。基于现代化的质量控制理念,对影响血液制品产品质量的关键环节进行基于QbD的质量升级研究[38-40],具体生产工艺流程见图 4,可针对血液制品生产过程中的溶解、醇沉、酸沉及成品的质量一致性等关键质量环节进行研究。
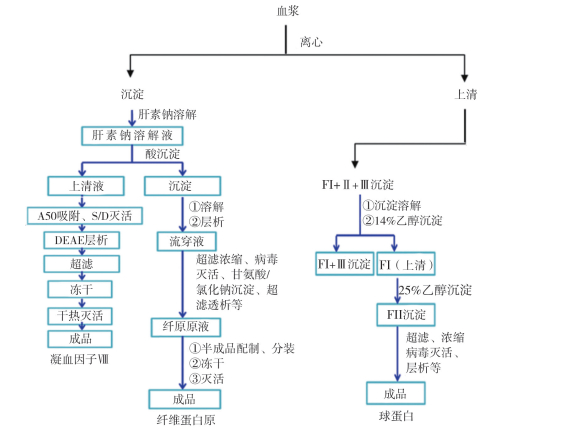
|
图 4 血液制品(凝血因子Ⅷ、纤维蛋白原、球蛋白)生产工艺流程图 |
溶解环节(肝素钠溶解和沉淀溶解)是影响血液制品质量属性的关键单元操作。溶解过程中若蛋白质浓度过低,会引起蛋白质胶体系统不稳定,容易发生变性;而蛋白质浓度过高,凝血因子激活概率加大,会影响最终产品的活性收率。目前,只能通过特定工艺操作和人为主观控制完成冷沉淀的溶解,对于溶解过程的质量变化了解不透彻。且冷沉淀溶解过程受多种因素影响,如受溶解温度、溶解时间、罐内搅拌速度、离子强度、醋酸加液速度、缓冲液配方及pH值等。可利用QbD的方法首先确定血液制品(如Ⅷ因子)的CQA,从而确定产品的质量设计空间[41-42],根据质量设计空间,确定产品的CPP;利用实验设计(design of experiment,DOE)方法确定产品的关键质量参数以及各个参数的操作范围;利用PAT实现对于CQA的在线监测,从而利用6σ软件控制策略实现对CPP的在线控制;最后对生产的产品质量进行质量分析,确保产品质量的一致性。建立溶解环节的质量控制体系,实现质量与生产过程的全数据追踪。
4.2 醇沉关键质量环节醇沉(14%乙醇沉淀和25%乙醇沉淀)是目前血液制品中分离纯化各蛋白的关键操作步骤之一,其工艺水平的高低也直接影响产品的质量。对于生产过程中的蛋白质来说,若乙醇醇沉控制不到位,会产生变性效应,其原因可能为热诱导或溶剂诱导[43-44]。基于QbD理念,可利用对文献标准的调研以及企业内部讨论的方式确定CQA;利用风险分析实现对CPP的参数取舍(原料属性、乙醇用量、搅拌速度、离子浓度、蛋白浓度等[45]);利用DOE实现各参数的效应以及相互作用的分析,得到各个参数的控制范围;最后利用PAT实现过程分析与反馈控制,建立醇沉环节的质量控制体系,实现质量与生产过程的全数据追踪。
4.3 酸沉关键质量环节对于酸沉环节来说,加酸方式、加酸速度或搅拌操作设置的不当,可能会导致醋酸和制品接触点局部过高或局部产生反应热导致蛋白变性。可利用对文献标准的调研以及企业内部讨论的方式确定CQA;利用风险分析实现对CPP的参数取舍;利用DOE实现各参数的效应以及相互作用的分析,得到各个参数的控制范围;最后利用PAT实现过程分析与反馈控制,从而建立酸沉的质量控制体系,实现产品质量的信息化追踪[46]。
4.4 血液制品成品质量一致性分析血液制品成品质量一致性评价,即需要达到“管理一致性、中间过程一致性、质量标准一致性等全过程一致”的高标准要求。利用QbD,对血液制品的全过程进行在线分析与控制,以此来保证生产产品的质量一致性。对于最后产品的放行仍需要采用终产品检验放行的方法。例如可采用快速、无损高通量检测方法近红外光谱分析技术实现终产品的“瓶瓶检”,与终点抽检相结合,实现所有产品的大数据数字化可追溯。
然而从整体策略思考,要落实QbD理念在血液制品生产的工作,还要建立血液制品生产的新体系,如图 5。以QbD理念作为质量体系的科学基础,紧密联系整个生产体系中的工艺研究部分和监管体系中的质量可靠性和GMP达标性,从而让新型的科技、管理和监管人才为QbD理念服务[47]。
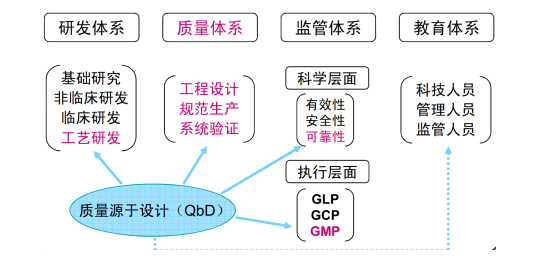
|
图 5 基于QbD理念下的血液制品生产体系图 |
近年来,在FDA倡导下,QbD理念在国际制药领域产品和工艺开发中得到大力推行,逐渐形成了以美国FDA为代表提出的国际生产质量管理的新方向,它强调通过设计提高产品质量,实现血液制品生产企业的大跨越。如今,QbD理念在血液制品行业内部被广泛接受,以可靠的科学设计和质量风险管理为依托[48],定义好目标导向,对产品与工艺有充分的理解,从而更加系统地对工艺进行控制,加强血液制品的全过程监管[49-51]。QbD理念被引入到血液制品行业,可以与国际领先企业站在同一个起点,从而实现血液制品生产企业的工业化和规模化,推动我国血液制品行业升级,不断实现血液制品智能生产的新目标,逐渐完善我国药品的智能制造体系建设。
| [1] |
Dallasega P, Rauch E, Linder C. Industry 4.0 as An Enabler of Proximity for Construction Supply Chains:A Systematic Literature Review[J]. Comput Ind, 2018, 99: 205-225. DOI:10.1016/j.compind.2018.03.039 |
| [2] |
国家药典委员会. 中国药典[M]. 2015年版三部. 北京: 中国医药科技出版社, 2015.
|
| [3] |
Wilkesmann M, Wilkesmann U. Industry 4.0-Organizing Routines or Innovations[J]. Vine J Inf Knowl Man, 2018, 48(2): 238-254. |
| [4] |
Feng W. Industry 4.0:Advances of Germany's Manufacturing Innovation[J]. Ieee Int Con Auto Sc, 2017, 494-495. |
| [5] |
Wilkesmann M, Wilkesmann U. Industry 4.0-Organizing Routines or Innovations[J]. Vine J Inf Knowl Man, 2018, 48(2): 238-254. |
| [6] |
Zheng P, Wang HH, Sang ZQ, et al. Smart Manufacturing Systems for Industry 4.0:Conceptual Framework, Scenarios, and Future Perspectives[J]. Front Mech Eng, 2018, 13(2): 137-150. DOI:10.1007/s11465-018-0499-5 |
| [7] |
Reischauer G. Industry 4.0 as Policy-Driven Discourse to Institutionalize Innovation Systems in Manufacturing[J]. Technol Forecast Soc, 2018, 132: 26-33. DOI:10.1016/j.techfore.2018.02.012 |
| [8] |
Saucedo-Martinez JA, Perez-Lara M, Marmolejo-Saucedo JA, et al. Industry 4.0 Framework for Management and Operations:A Review[J]. J Amb Intel Hum Comp, 2018, 9(3): 789-801. DOI:10.1007/s12652-017-0533-1 |
| [9] |
Tvenge N, Martinsen K. Integration of Digital Learning in Industry 4.0[J]. Procedia Manuf, 2018, 23: 261-266. DOI:10.1016/j.promfg.2018.04.027 |
| [10] |
Wilkesmann M, Wilkesmann U. Industry 4.0-Organizing Routines or Innovations[J]. Vine J Inf Knowl Man, 2018, 48(2): 238-254. |
| [11] |
Fraga-Lamas P, Fernandez-Carames TM, Blanco-Novoa O, et al. A Review on Industrial Augmented Reality Systems for the Industry 4.0 Shipyard[J]. Ieee Access, 2018, 6: 13358-13375. DOI:10.1109/ACCESS.2018.2808326 |
| [12] |
Kumar V, Bhalla A, Rathore AS. Design of Experiments Applications in Bioprocessing:Concepts and Approach[J]. Biotechnol Progr, 2014, 30(1): 86-99. DOI:10.1002/btpr.1821 |
| [13] |
Rathore AS, Winkle H. Quality by Design for Biopharmaceuticals[J]. Nat Biotechnol, 2009, 27(1): 26-34. DOI:10.1038/nbt0109-26 |
| [14] |
Marto J, Gouveia L, Jorge IM, et al. Starch-based Pickering Emulsions for Topical Drug Delivery:A QBD Approach[J]. Colloid Surface B, 2015, 135: 183-192. DOI:10.1016/j.colsurfb.2015.07.024 |
| [15] |
Yu LX, Kopcha M. The Future of Pharmaceutical Quality and the Path to Get There[J]. Int J Pharmaceut, 2017, 528(1-2): 354-359. DOI:10.1016/j.ijpharm.2017.06.039 |
| [16] |
O'Connor TF, Yu LX, Lee SL. Emerging Technology:A Key Enabler for Modernizing Pharmaceutical Manufacturing and Advancing Product Quality[J]. Int J Pharmaceut, 2016, 509(1-2): 492-498. DOI:10.1016/j.ijpharm.2016.05.058 |
| [17] |
Yu LX, Amidon G, Khan MA, et al. Understanding Pharmaceutical Quality by Design[J]. Aaps J, 2014, 16(4): 771-783. DOI:10.1208/s12248-014-9598-3 |
| [18] |
Xu XM, Costa AP, Khan MA, et al. Application of Quality by Design to Formulation and Processing of Protein Liposomes[J]. Int J Pharmaceut, 2012, 434(1-2): 349-359. DOI:10.1016/j.ijpharm.2012.06.002 |
| [19] |
Radosevich M, Burnouf T. Intravenous Immunoglobuling:Trends in Production Methods, Quality Control and Quality Assurance[J]. Vox Sang, 2010, 98(1): 12-28. DOI:10.1111/vox.2009.98.issue-1 |
| [20] |
Fisher AC, Lee SL, Harris DP, et al. Advancing Pharmaceutical Quality:An Overview of Science and Research in the U.S. FDA's Office of Pharmaceutical Quality[J]. International Journal of Pharmaceutics, 216, 515(1-2): 390-402. |
| [21] |
Ohage E, Iverson R, Krummen L, et al. Qbd Implementation and Post Approval Lifecycle Management (Palm)[J]. Biologicals, 2016, 44(5): 332-340. DOI:10.1016/j.biologicals.2016.06.007 |
| [22] |
Rathore AS. QBD/PAT for Bioprocessing:Moving from Theory to Implementation[J]. Curr Opin Chem Eng, 2014, 6: 1-8. DOI:10.1016/j.coche.2014.05.006 |
| [23] |
Alt N, Zhang TY, Motchnik P, et al. Determination of Critical Quality Attributes for Monoclonal Antibodies Using Quality by Design Principles[J]. Biologicals, 2016, 44(5): 291-305. DOI:10.1016/j.biologicals.2016.06.005 |
| [24] |
Read EK, Park JT, Shah RB, et al. Process Analytical Technology(PAT)for Biopharmaceutical Products:Part i. Concepts and Applications[J]. Biotechnol Bioeng, 2010, 105(2): 276-284. DOI:10.1002/bit.v105:2 |
| [25] |
Herwig C, Garcia-Aponte OF, Golabgir A, et al. Knowledge Management in the QBD Paradigm:Manufacturing of Biotech Therapeutics[J]. Trends Biotechnol, 2015, 33(7): 381-387. DOI:10.1016/j.tibtech.2015.04.004 |
| [26] |
Wu HQ, White M, Khan MA. Quality-by-Design (QBD):An Integrated Process Analytical Technology (PAT)Approach for a Dynamic Pharmaceutical Co-Precipitation Process Characterization and Process Design Space Development[J]. Int J Pharmaceut, 2011, 405(1-2): 63-78. DOI:10.1016/j.ijpharm.2010.11.045 |
| [27] |
Aksu B, Aydoǧan M, Kanik B, et al. A Flexible Regulatory Approach for Different Raw Materials Suppliers Using QBD Principles[J]. Research Journal of Pharmaceutical Biological & Chemical Sciences, 2013, 4(4): 358-372. |
| [28] |
Rathore AS, Sharma A, Chilin D. Applying Process Analytical Technology to Biotech Unit Operations[J]. Biopharm Int, 2006, 19(8): 48. |
| [29] |
Nail SL, Searles JA. Elements of Quality by Design in Development and Scale-up of Freeze-dried Parenterals[J]. Biopharm Int, 2008, 21(1): 44. |
| [30] |
Wu HQ, Khan M. The Spectroscopy:An Emerging Technology for Pharmaceutical Development and Pharmaceutical Process Analytical Technology(PAT) Applications[J]. J Mol Struct, 2012, 1020: 112-120. DOI:10.1016/j.molstruc.2012.04.019 |
| [31] |
Rathore AS, Bhambure R, Ghare V. Process Analytical Technology(PAT)for Biopharmaceutical Products[J]. Anal Bioanal Chem, 2010, 398(1): 137-154. DOI:10.1007/s00216-010-3781-x |
| [32] |
Aksu B, Beer TD, Folestad S, et al. Strategic funding priorities in the pharmaceutical sciences allied to Quality by Design(QbD)and Process Analytical Technology (PAT)[J]. European Journal of Pharmaceutical Sciences, 2012, 47(2): 402-405. DOI:10.1016/j.ejps.2012.06.009 |
| [33] |
Puchert T, Holzhauer CV, Menezes JC, et al. A New PAT/QBD Approach for the Determination of Blend Homogeneity:Combination of On-line Nirs Analysis with PC Scores Distance Analysis(PC-SDA)[J]. Eur J Pharm Biopharm, 2011, 78(1): 173-182. DOI:10.1016/j.ejpb.2010.12.015 |
| [34] |
Ayob Y. Domestic and Imported Products-the Malaysian Experience in Assuring Safe and Sufficient Plasma Products[J]. Dev Biologicals, 2007, 127: 169-173. |
| [35] |
Iner H, Gokalp O, Besir Y, et al. Inflammation Triggered by the Use of Blood Products[J]. Anesth Analg, 2018, 126(5): 1793-1793. |
| [36] |
Cillo J, Pulsipher A, Rutherford CJ, et al. Third Molar Extractions in a Patient with Congenital Afibrinogenemia:A Case Report[J]. J Oral Maxil Surg, 2001, 59(8): 935-936. DOI:10.1053/joms.2001.25038 |
| [37] |
Rockx MA, Clark WF. Plasma Exchange for Treating Cryoglobulinemia:A Descriptive Analysis[J]. Transfus Apher Sci, 2010, 42(3): 247-251. DOI:10.1016/j.transci.2010.03.001 |
| [38] |
Vakalopoulou S, Rizopoulou D, Zafiriadou E, et al. Management of Acute Bleeding in a Patient with Congenital Afibrinogenaemia[J]. Haemophilia, 2006, 12(6): 676-678. DOI:10.1111/hae.2006.12.issue-6 |
| [39] |
Rathore AS. Roadmap for Implementation of Quality by Design(QBD)for Biotechnology Products[J]. Trends Biotechnol, 2009, 27(9): 546-553. DOI:10.1016/j.tibtech.2009.06.006 |
| [40] |
Wu HQ, Khan MA. Quality-by-Design(qbd):An Integrated Approach for Evaluation of Powder Blending Process Kinetics and Determination of Powder Blending End-Point[J]. J Pharm Sci-Us, 2009, 98(8): 2784-2798. DOI:10.1002/jps.21646 |
| [41] |
Harms J, Wang XY, Kim T, et al. Defining Process Design Space for Biotech Products:Case Study of Pichia Pastoris Fermentation[J]. Biotechnol Progr, 2008, 24(3): 655-662. DOI:10.1021/bp070338y |
| [42] |
Hakemeyer C, McKnight N, St John R, et al. Process Characterization and Design Space Definition[J]. Biologicals, 2016, 44(5): 306-318. DOI:10.1016/j.biologicals.2016.06.004 |
| [43] |
Farrugia A, Scaramuccia D. The Dynamics of Contract Plasma Fractionation[J]. Biologicals, 2017, 46: 159-167. DOI:10.1016/j.biologicals.2017.02.007 |
| [44] |
Gorecky D, Schmitt M, Loskyll M, et al. Humanmachine-interaction in the industry 4.0 era[J]. IEEE International Conference on Industrial Informa, 2014, 23(6): 595-605. |
| [45] |
Kistler P, Nitschmann H. Large Scale Production of Human Plasma Fractions[J]. Vox Sang, 1962, 7(4): 414. DOI:10.1111/vox.1962.7.issue-4 |
| [46] |
Rathore AS, Bhambure R, Ghare V. Process Analytical Technology(PAT)for Biopharmaceutical Products[J]. Anal Bioanal Chem, 2010, 398(1): 137-154. DOI:10.1007/s00216-010-3781-x |
| [47] |
Luciani F, Galluzzo S, Gaggioli A, et al. Implementing Quality by Design for Biotech Products:Are Regulators on Track[J]. Mabs-Austin, 2015, 7(3): 451-455. DOI:10.1080/19420862.2015.1023058 |
| [48] |
Guebitz B, Schnedl H, Khinast JG. A Risk Management Ontology for Quality-by-Design Based on A New Development Approach According Gamp 5.0[J]. Expert Syst Appl, 2012, 39(8): 7291-7301. DOI:10.1016/j.eswa.2012.01.089 |
| [49] |
Kepert JF, Cromwell M, Engler N, et al. Establishing A Control System Using QBD Principles[J]. Biologicals, 2016, 44(5): 319-331. DOI:10.1016/j.biologicals.2016.06.003 |
| [50] |
Wu HQ, White M, Khan MA. Quality-by-Design (QBD):An Integrated Process Analytical Technology (PAT) Approach for A dynamic Pharmaceutical Co-Precipitation Process Characterization and Process Design Space Development[J]. Int J Pharmaceut, 2011, 405(1-2): 63-78. DOI:10.1016/j.ijpharm.2010.11.045 |
| [51] |
Lee SL, Brorson K. Emerging Technology As A Key Enabler for Modernizing Pharmaceutical Manufacturing[J]. Pda J Pharm Sci Technol, 2017, 66-67. |
 2018, Vol. 32
2018, Vol. 32