药物与其包装容器的相容性试验是指为考察药物与其包装容器之间是否发生迁移或吸附等相互作用的现象,进而影响药物质量而进行的试验。
注射剂是一种用途广、起效快、高风险的剂型,其与包装容器发生相互作用的可能性在各类剂型中为最高类别之一[1],因此对于注射剂,不仅应严格控制其原辅料及生产工艺,还应重视其与作为注射剂重要组成部分的包装容器之间的相容性。近年来,由于注射剂与其包装容器之间发生相互作用而引发的药品召回事件被广泛关注[2-3],因此国内外相继出台了一系列相关法律法规及指导原则[4-10],要求注射剂生产企业考察其与包装容器的相容性是否满足安全性的控制要求。
不同种类的药物与其包装容器的相容性研究原理及方法各不相同,中国食品药品检定研究院包装材料与药用辅料检定所针对不同材质、类型的包装容器开展了大量的相容性研究工作。在注射剂所用各种材质的包装容器中,药用玻璃包装容器使用广泛、成分相对固定而明确,因此,基于目前的研究基础,汇总了相应试验方法于本指南中进行概述,旨在为注射剂选择适宜的药用玻璃容器进行相容性试验研究提供科学、可行、有效的研究试验方法。
2 适用范围本指南适用于开展注射剂与药用玻璃包装容器间的相容性研究。其中注射剂包含注射液、注射用浓溶液、无菌粉末、冻干粉末等;药用玻璃包装容器包含各类玻璃材质制成的安瓿、输液瓶、注射剂瓶、预灌封注射器、卡式瓶等。根据玻璃组成或其耐水性、线热膨胀性能等的不同,各国对药用玻璃进行了不同的分类,虽分类不完全一致,但本质上对于玻璃的性能和技术要求是一致的。《中国药典》2015年版四部将药用玻璃分为了高硼硅玻璃、中硼硅玻璃、低硼硅玻璃及钠钙玻璃四种,欧美药典将药用玻璃分为Ⅰ类、Ⅱ类及Ⅲ类玻璃, 具体划分情况见表 1[11-12]。本指南仅对目前常见的药用玻璃容器及注射剂型进行了描述,对于新剂型及新型药用玻璃包装形式,以及口服液体玻璃包装容器也可参考本指南开展研究。
|
|
表 1 我国与欧美国家的玻璃分类对比表 |
本指南是基于目前相关法规及指导原则等要求和认知水平,结合实际试验研究经验,参考了国内外相关研究文献进行的撰写[13-21],随着相关法规、标准及检测技术的不断发展,其内容也将进行适时的完善及修订。同时,本指南并不作为法规强制执行,如其他方法经证明科学、合理、可操作,也可采用。
3 研究方案研究方案主要包括阳性对照试验、模拟试验及相互作用试验三部分。在开展试验时,应根据实际的玻璃包装容器材质、形式以及注射剂性质等设计试验方案。
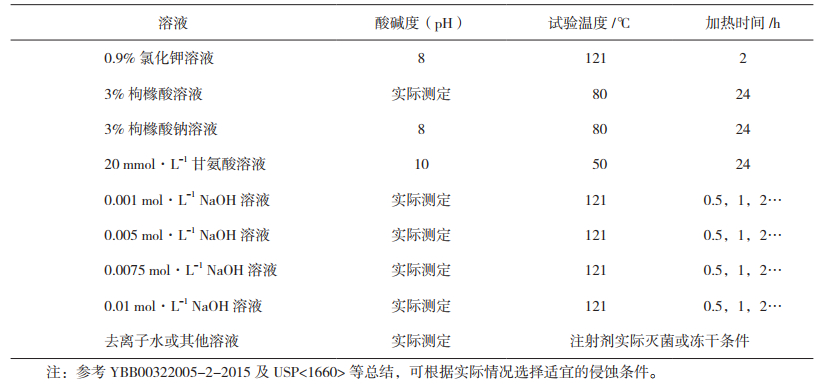
3.1 阳性对照试验阳性对照试验,是指采用适宜的溶液作为侵蚀液,在极端条件下开展玻璃表面侵蚀试验,包含从未发生侵蚀到发生侵蚀、直至脱片的全过程。本部分试验参考《国家药包材标准》(中硼硅玻璃安瓿YBB00322005-2-2015)中安瓿耐碱性试验方法[22]、《美国药典》<1660>玻璃容器内表面耐受性评估方法[12]以及国际玻璃委员会科学技术协会提出的药用玻璃侵蚀评估方法建立,旨在预测玻璃容器受到侵蚀或发生脱片的可能性,并以观察到因受到侵蚀而脱片的药用玻璃包装容器作为阳性对照样品。
3.1.1 仪器设备高压灭菌器、显微镜、澄明度检查仪、不溶性微粒检查仪、pH计、电感耦合等离子体发射光谱仪、电感耦合等离子体发射质谱仪、扫描电镜等。
3.1.2 阳性对照样品制备采用附表 1中推荐的条件制备阳性对照样品,阳性对照样品应包含未见侵蚀、可见侵蚀及可见脱片过程中的各状态。
|
|
附表 1 侵蚀溶液及条件 |
取不少于具有统计学意义的阳性对照样品适量(或参考《中国药典》2015年版通则0904中取样要求),参考《中国药典》2015年版通则0904第一法,选择适宜的照度对阳性对照样品中的溶液进行可见异物检查;必要时,可将阳性对照样品中的溶液以0.22μm滤膜过滤,将滤膜置显微镜下检验,观察滤膜表面是否存在玻璃脱片。
3.1.3.2 玻璃内表面侵蚀情况1)表面亚甲蓝染色试验 取不少于具有统计学意义的阳性对照样品适量,将容器内表面清洗干净,晾干后,灌装0.5%亚甲蓝溶液,静置20分钟后倒出,用低流速水灌入瓶内再倒出,反复5~10次,至样品内表面的蓝色不变为止,晾干后,观察并记录玻璃包装容器内壁亚甲蓝挂壁现象,本方法用于无色透明玻璃包装容器。
2)表面扫描电镜试验 取不少于具有统计学意义的阳性对照样品适量,选取与侵蚀液接触的部分(各取样点样品切割位置需保持一致,管制瓶应至少包含底部烧结部位及侧面瓶壁两个部位),切割制取大小、形状适宜的样品,使得样品曲度尽量低,采用适宜的方法清洗样品表面,避免清洗过程中产生假阳性样品,晾干后,于扫描电镜下观察其表面(如有条件,可将阳性对照样品中的溶液过滤,对滤膜表面的玻璃脱片进行能谱测定,考察其是否为玻璃成分等)。
3.1.3.3 离子变化取不少于具有统计学意义的阳性对照样品适量,根据玻璃材质及预估的离子浓度范围,参考《中国药典》2015年版通则0411、0412,采用电感耦合等离子体发射光谱仪或电感耦合等离子体发射质谱仪等,测定阳性对照样品中的溶液及空白侵蚀液中各离子的含量,并记录其变化情况(其中硅、硼、铝、钙等离子应重点考察)。
3.1.3.4 方法学验证采用适宜的方法对上述项目开展方法学验证试验,如离子变化试验中应包含线性试验、精密度试验、回收率试验等。
3.2 模拟试验模拟试验,是指采用含目标药物的注射剂、不含药物的空白制剂或与注射剂pH值、极性、离子强度等相同或相似的模拟溶剂等,在注射剂生产、贮存、运输或使用过程中的最极端条件下,考察药用玻璃包装容器是否存在发生侵蚀、甚至出现脱片情况的试验。
本部分试验参考相关要求建立,旨在预测玻璃容器在实际使用的极端条件下,受到侵蚀甚至出现脱片的可能性等。
3.2.1 仪器设备高压灭菌器、显微镜、澄明度检查仪、不溶性微粒检查仪、pH计、电感耦合等离子体发射光谱仪、电感耦合等离子体发射质谱仪、扫描电镜等
3.2.2 模拟样品制备在玻璃包装容器中灌装含目标药物的注射剂、不含药物的空白制剂或与注射剂pH值、极性、离子强度等相同或相似的模拟溶剂等,在注射剂生产、贮存、运输或使用过程中的极端条件下制备模拟样品。
3.2.3 试验项目 3.2.3.1 不溶性微粒及可见异物取不少于具有统计学意义的模拟样品适量(或参考《中国药典》2015年版通则0903、0904中取样要求),参考《中国药典》2015年版通则0903对模拟样品中的溶液进行不溶性微粒检查;参考《中国药典》2015年版通则0904第一法,选择适宜的照度对阳性样品中可见异物进行检查;必要时,可将模拟样品中的溶液以0.22μm滤膜过滤,将滤膜置显微镜下检验,观察滤膜表面是否存在玻璃脱片。
3.2.3.2 玻璃内表面侵蚀情况1)表面亚甲蓝染色试验 取不少于具有统计学意义的模拟样品适量,将容器内表面清洗干净,晾干后,灌装0.5%亚甲蓝溶液,静置20分钟后倒出,用低流速水灌入瓶内再倒出,反复5~10次,至样品内表面的蓝色不变为止,晾干后,观察并记录玻璃包装容器内壁亚甲蓝挂壁现象,本方法用于无色透明玻璃包装容器。
2)表面扫描电镜试验 取不少于具有统计学意义的模拟样品适量,选取与侵蚀液接触的部位(各取样点样品切割位置需保持一致,管制瓶应至少包含底部烧结部位及侧面瓶壁两个部位),切割制取大小、形状适宜的样品,使得样品曲度尽量低,采用适宜的方法清洗样品表面,避免清洗过程中产生假阳性样品,晾干后,采用适宜的方法处理表面后,于扫描电镜下观察其表面(如有条件,可将模拟样品中的溶液过滤,对滤膜表面的玻璃脱片进行能谱测定,考察其是否为玻璃成分等)。
3.2.3.3 离子变化取不少于具有统计学意义的模拟样品适量,根据玻璃材质及离子浓度不同,参考《中国药典》 2015年版通则0411、0412,采用电感耦合等离子体发射光谱仪或电感耦合等离子体发射质谱仪等,测定模拟样品中的溶液及空白侵蚀液中各离子的含量,并记录其变化情况。
3.2.3.4 方法学验证采用适宜的方法对上述项目开展方法学验证试验,如离子变化试验中应包含线性试验、精密度试验、回收率试验等。
3.3 相互作用试验相互作用试验主要包含两部分,一:通过对注射剂基本理化性能变化的测定,考察玻璃包装容器对注射剂的影响,以及玻璃包装容器对注射剂的吸附等,保证产品质量稳定性;二:采用阳性对照试验建立的考察玻璃表面侵蚀的方法,考察注射剂对玻璃包装容器的影响。通过上述两部分结果,同时对比阳性对照试验及模拟试验结果,综合判断注射剂与药用玻璃包装容器之间的相容性是否良好。
3.3.1 仪器设备稳定性试验箱、澄明度检查仪、pH计、微波消解仪或其他可用于消解药物的仪器,电感耦合等离子体发射光谱仪、电感耦合等离子体发射质谱仪、扫描电镜等。
3.3.2 供试样品制备参考附表 2或《中国药典》2015年版通则9001中规定的制剂加速或长期稳定性试验条件进行加速或长期试验,试验时间间隔点可根据实际情况确定,加速试验时间点至少应不少于0、3、6个月,长期试验点至少应至样品有效期,经上述处理后的注射剂作为供试样品。对于相同处方多种包装规格的注射剂,应计算接触比表面积,可优先选择比表面积大的规格进行试验。
|
|
附表 2 加速及长期稳定性试验推荐的放置条件 |
1)稳定性试验 参考中国药典或注射剂适用的标准,考察注射剂在加速或长期稳定性试验条件下全项目检测质量变化情况。
2)吸附试验 将注射剂或将模拟临床使用配制的注射剂灌装至玻璃包装容器中,取灌装放置0小时后的注射剂作为零点;根据注射剂实际使用时间,设定不少于具有统计学意义的取样点数个,考察各取样点间注射剂含量变化情况,直至注射剂含量变化趋于平衡。通过含量变化趋势,考察玻璃包装容器对注射剂的吸附情况。
3)避光性能试验 如注射剂需避光保存,则应考察玻璃产品透光率及其对所包装注射剂的避光保护作用。将注射剂或将模拟临床使用配制的注射剂灌装至玻璃包装容器中,取灌装放置0小时后的注射剂作为零点;根据注射剂实际使用时间等,设定不少于具有统计学意义的取样点数个,考察各取样点间注射剂质量变化情况,直至注射剂质量变化趋于平衡。通过质量变化趋势,考察玻璃包装容器对避光注射剂的保护情况。以透明玻璃包装容器包装的注射剂作为阳性避光对照样品;如玻璃包装容器外部另有避光材料保护,则以此包装形式的注射剂作为阴性避光对照样品。
3.3.3.2 注射剂对玻璃包装容器的影响1)内表面亚甲蓝染色试验 取不少于具有统计学意义的供试样品适量,将容器内表面清洗干净,晾干后,灌装0.5%亚甲蓝溶液,静置20分钟后倒出,用低流速水灌入瓶内再倒出,反复5~10次,至样品内表面的蓝色不变为止。晾干后,观察玻璃包装容器内壁亚甲蓝挂壁现象,并与阳性对照容器及空白药用玻璃包装容器对比,本方法用于无色透明玻璃包装容器。
2)内表面扫描电镜试验 取不少于具有统计学意义的供试样品适量,选择与注射剂接触的部位(各取样点样品切割位置需与阳性样品保持一致,管制瓶应包含底部烧结部位及侧面瓶壁部位),切割制取大小、形状适宜的样品,采用适宜的方法清洗样品表面,避免清洗过程中产生假阳性样品,晾干后,采用适宜的方法处理表面后,进行扫描电镜观察玻璃表面(如有条件,可同时进行能谱测定,考察表面可疑的侵蚀部位是否为玻璃成分等)。
3)离子迁移变化 根据注射剂性质,取不少于具有统计学意义的供试样品适量,采用适宜的方法进行前处理(如微波消解、湿法消解、干法消解、直接稀释等)。参考《中国药典》2015年版通则0411、0412,采用电感耦合等离子体发射光谱仪或电感耦合等离子体发射质谱仪等,测定其中各离子的含量变化情况,绘制变化曲线。
3.3.3.3 方法学验证采用适宜的方法对上述项目开展方法学验证试验,如离子变化试验中应包含线性试验、精密度试验、回收率试验等。
4 研究结果的表述与分析 4.1 研究结果的表述 4.1.1 阳性对照试验及模拟试验 4.1.1.1 不溶性微粒及可见异物以不溶性微粒检查仪及肉眼观察检测阳性对照样品、模拟样品及供试样品是否存出现玻璃侵蚀甚至脱片的情况,参考表 2中描述的可能检测到的现象,记录各样品结果。如用显微镜观察,需同时提供显微镜观察图。
|
|
表 2 现象及结果表述 |
1)内表面亚甲蓝染色试验 将染色后的阳性对照样品及模拟样品分别按侵蚀时间顺序排列,对比空白玻璃包装容器,于白色背景前拍照。
2)内表面扫描电镜试验 对未经试验的空白玻璃包装容器表面进行扫描,观察其表面是否光滑,是否存在坑洼,保存图片;分别对阳性对照样品及模拟样品表面进行扫描,找到表面出现侵蚀的特征图,保存图片。
4.1.1.3 离子变化记录阳性对照样品、模拟样品中各离子的浓度,绘制不同离子浓度随时间变化的曲线,并在阳性对照样品变化曲线上标注肉眼可见侵蚀或脱片的时间。
4.1.2 相互作用试验 4.1.2.1 玻璃容器对注射剂的影响记录注射剂稳定性检验结果;记录吸附试验下各取样时间点注射剂主成分含量,绘制变化趋势图,计算变化范围。记录避光性能试验各取样时间点下注射剂主成分含量,绘制变化趋势图,计算变化范围。
4.1.2.2 注射剂对玻璃包装容器的影响1)内表面亚甲蓝染色试验 将染色后的供试样品按时间顺序排列,对比阳性对照样品(至少一个明显染色样品,并标明侵蚀条件及时间)及空白玻璃包装容器,于白色背景前拍照。
2)内表面扫描电镜试验 对供试样品表面进行扫描,根据观察到的侵蚀情况,保存图片;同时对比阳性对照样品(至少一个表面可见明显侵蚀的图片)及空白玻璃包装容器。
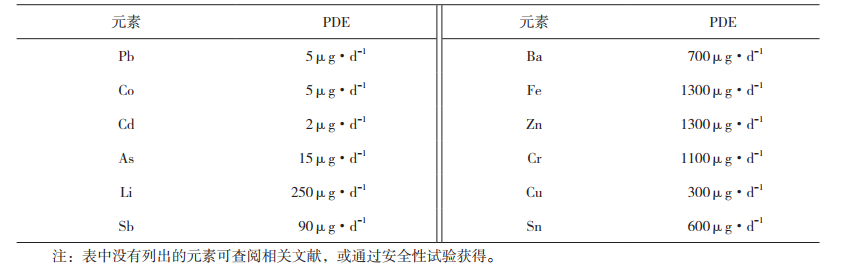
3)离子迁移变化 记录供试样品中的各离子浓度,可采用绘制变化曲线或计算变化率及其他适宜的方式考察各离子是否存在上升趋势,同时对比硅、硼、铝、钠、钙等离子浓度是否与接近或超过阳性对照液中浓度;参考附表 3,折算稀释倍数及每日最大使用量后,计算注射剂中各元素每日最大摄入量是否超过推荐的每日允许摄入量(PDE值)。
4.1.3 方法学验证记录方法学验证试验中所应包含的线性、精密度、回收率、限度等结果。
4.2 研究结果的分析 4.2.1 阳性对照试验及模拟试验综合不溶性微粒及可见异物、玻璃内表面侵蚀情况及离子变化试验结果,可观测到玻璃包装容器受到侵蚀直至脱片的过程,并可以此阳性结果作为对照,用于对比、判断模拟试验条件下注射剂玻璃包装容器是否出现侵蚀甚至脱片,同时也可用于判断注射剂与玻璃包装容器间相互作用程度与趋势。
4.2.2 相互作用试验相互作用试验结果中任意一项可见明显变化趋势时,应考虑注射剂与玻璃包装容器之间发生的相互作用是否影响注射剂质量及安全,是否需要更换包装容器等。
参考附表 3中提供的玻璃容器中常用元素的每日允许摄入量(PDE值),计算的注射剂中各元素摄入量是否超过标准规定。如当注射剂中含有氢氧化铝佐剂等类似添加剂时,则应以其元素变化趋势考察注射剂与玻璃包装容器间的相互作用程度。
综合上述几方面研究结果,判断注射剂与其玻璃包装材料的相容性是否良好。
结束语在药品安全风险越来越被重视、注射剂质量一致性评价要求不断提高的背景下,高风险注射剂产品与其包装容器的相容性也逐渐受到重视,各国监管部门虽然发布了相容性研究指导原则,但均未提供具体的试验方法。因此,中国食品药品检定研究院包装材料与药用辅料检定所基于此背景,参考国内外法规要求,总结近十年来的研究经验,撰写了本试验方法指南,同时,本方法也会随着技术发展进行定期修订,以更好地促进我国相容性研究水平的提升,推动行业的发展。
附录 1 名词解释 1.1 侵蚀:指侵蚀介质(如碱、水、酸、盐等)与玻璃表面发生相互作用,使得玻璃表面某些组分被浸出,玻璃表面结构产生破坏等过程。
1.2 脱片:玻璃内表面的碱金属离子受溶液的成分化学侵蚀,在玻璃表面形成一层高硅氧层,高硅氧层与玻璃内部结构成分膨胀系数不同,在温度变化时两者之间会产生应力,导致高硅氧层从主体玻璃上脱落到溶液中形成玻璃脱片的现象。
1.3 人每日允许暴露量(permitted daily exposure,PDE):指某一物质被允许摄入而不产生毒性的日平均最大剂量,某一具体物质的PDE值是由不产生反应量、体重调整系数、种属之间差异的系数、个体差异、短期接触急性毒性研究的可变系数等推算出的。
2 阳性对照样品制备条件参考可采用附表 1中推荐的条件制备阳性对照样品。
3 稳定性试验放置参考条件可参考附表 2中条件开展加速及长期稳定性试验。
4 玻璃容器中常用元素的每日允许摄入量可参考附表 3中提供的玻璃容器中常用元素的每日允许摄入量计算注射剂中各元素摄入量。
起草单位及起草人:
中国食品药品检定研究院包装材料与药用辅料检定所:孙会敏、李樾、赵霞、贺瑞玲
【致谢:感谢以下专家对本指南提出的宝贵意见。杨会英,粟晓黎,齐艳菲,何莉,王宝亭,冯国平,黄志禄,顾维军,雷英,康笑博,徐敏凤,蔡荣,张毅兰,金宏,李宝林,米亚娴,朱碧君,刘言,黄海萍,姚羽,沈永,王国勤,兰婉玲,裘婧,王刚,孙怡,袁恒新。】
编者按:按照国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和中共中央办公厅、国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)要求,国家药品监督管理局积极推进药品审评审批制度改革,在固体仿制药质量疗效一致性评价和注射剂质量再评价方面开展了扎实有效的工作。
注射剂作为用途广泛、起效快的一种剂型,其安全风险也较高,近年来发生的因包装容器或材料与药物相互作用而导致的药品召回事件使得注射剂与其包装容器的相容性问题逐渐受到关注。2012年,国家食品药品监督管理局办公室下发了“关于加强药用玻璃包装注射剂药品监督管理的通知”([2012]132号),以期解决药用玻璃包装容器与注射剂药品之间不相容的问题。国内外监管部门也相继发布了多个药物相容性研究指导原则,但并未提供试验研究方法,使得相关单位难以顺利开展相容性研究。
为更好地落实国务院“放、管、服”的工作要求,帮助科研机构及企业开展相容性研究,提升药品质量安全水平,中国食品药品检定研究院包装材料与药用辅料检定所结合了近十年来的相容性实际研究经验,参考相关指导原则和文献,针对组成固定明确的药用玻璃包装容器相容性研究现状,撰写了本指南,旨在提供科学、可行、有效的试验研究方法,为相关研究人员提供技术参考,以促进技术创新和行业发展。
Editor's Note:According to the requirements of the "Opinions on reforming the review and approval system for drugs and medical devices" ([2015] No. 44) issued by the State Council of China and the "Opinions on deepening the reform of review and approval system and encouraging the innovation of drugs and medical devices" ([2017] No. 42) issued by both General Office of the Communist Party of China and General Office of the State Council, China Food and Drug Administration (CFDA) actively promoted the reform of the review and approval system for drugs and carried out solid and effective works on the consistency evaluation of the quality and efficacy of solid generic drugs and the reevaluation of the quality of injections.
Injections, as a widely used and fast-acting dosage form, have high safety risk. In recent years, the drug recall events caused by the reaction between packaging containers or materials and drugs have made the compatibility of the injections and their packaging containers attract more and more attention. In 2012, the Office of CFDA issued the "Notice on strengthening the supervision and management of pharmaceutical glass packaging injections" ([2012] No.132) in order to solve the problem of incompatibility between pharmaceutical glass packaging containers and injections. A number of guidelines for drug compatibility study were issued by regulatory authorities at home and abroad, but no experiment method was provided in those guidelines. Therefore, it is still difficult for relevant institutes to conduct the compatibility study.
In order to better implement the work requirements of "delegate power, improve regulation and optimize services" proposed by the State Council, help scientific research institutes and enterprises carry out compatibility study and improve quality and safety level of drugs, Institute for Packaging Materials and Pharmaceutical Excipients of National Institutes for Food and Drug Control drafted this guideline based on practical experiences of compatibility studies in the past decade, related guidelines and literature, as well as current status of the compatibility study of pharmaceutical glass packaging containers with definite composition with a purpose of providing scientific, feasible and effective experimental research methods as well as technical references for relevant researchers to promote the technological innovation and industrial development.
| [1] |
Food and Drug Administration, Center for Drug Evaluation and Research (CDER), Center for Biologics Evaluation and Research (CBER). Guidance for industry: Container closure system for packaging human drug and biologics[EB/OL]. [2018-03-17]. https://www.taodocs.com/p-35131887-7.html.
|
| [2] |
Food and Drug Administration. American Regent Initiates Nationwide Voluntary Recall of Sodium Bicarbonate Injection, USP 7. 5% and 8. 4%, 50mL Single Dose Vials Due to Particulate Matter[EB/OL]. (2010-12-23)[2018-09-05]. https://www.news-medical.net/news/20101224/American-Regent-initiates-voluntary-recall-of-Sodium-Bicarbonate-Injection-USP-7525-and-8425.aspx?keywords=%E6%B5%AA%E7%90%B4%E7%B2%BE%E4%BB%BF%E6%89%8B%E8%A1%A8001%E3%80%90%E9%80%89%E6%AC%BE%E5%BE%AE%E4%BF%A1%EF%BC%9A1%207%201%208%208%208%208%204%203%207%203%E3%80%91.
|
| [3] |
国家食品药品监督管理总局. 关于停止销售和使用葛兰素史克公司生产的阿莫西林克拉维酸钾干混悬剂的通知[EB/OL]. (2011-06-18)[2018-03-17]. http://samr.cfda.gov.cn/WS01/CL0844/63194.html.
|
| [4] |
Food and Drug Administration. Metered dose inhaler (MDI) and dry power inhaler (DPI) drugs product[EB/OL]. (1998-11-13)[2018-08-17]. https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm070573.pdf.
|
| [5] |
Food and Drug Administration. Nasal spray and inhalation solution, suspension, and spray drug products[EB/OL]. (2002-7)[2018-08-17]. www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070575.pdf.
|
| [6] |
The European Agency for the Evaluation of Medicinal Products. Guideline on plastic immediate packaging materials[EB/OL]. (2005-05-19)[2018-08-17]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003448.pdf.
|
| [7] |
YBB00142002-2015药品包装材料与药物相容性试验指导原则[S]. 2015: 381-382.
|
| [8] |
国家食品药品监督管理总局. 化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)[EB/OL]. (2012-09-07)[2018-09-03]. http://samr.cfda.gov.cn/WS01/CL1616/90946.html.
|
| [9] |
国家食品药品监督管理总局. 化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)[EB/OL]. [2018-09-03]. http://samr.cfda.gov.cn/WS01/CL1616/126009.html.
|
| [10] |
国家药品监督管理局. 化学药品与弹性体密封件相容性研究技术指导原则(试行)[EB/OL]. (2018-4-16)[2018-09-04]. http://cnda.cfda.gov.cn/WS04/CL2050/227855.html.
|
| [11] |
中国药典: 四部[S]. 2015.
|
| [12] |
USP41-NF36[S]. 2018.
|
| [13] |
Guadagnino E, Zuccato D. Delamination Propensity of Pharmaceutical Glass Containers by Accelerated Testing with Different Extraction Media[J]. Pda Journal of Pharmaceutical Science & Technology, 2012, 66(2): 116. |
| [14] |
Zhao J, Lavalley V, Mangiagalli P, et al. Glass Delamination:a Comparison of the Inner Surface Performance of Vials and Pre-filled Syringes[J]. AAPS PharmSciTech, 2014, 15(6): 1398-1409. DOI:10.1208/s12249-014-0167-y |
| [15] |
Iacocca R G, Allgeier M. Corrosive Attack of Glass by a Pharmaceutical Compound[J]. Journal of Materials Science, 2007, 42(3): 801-811. DOI:10.1007/s10853-006-0156-y |
| [16] |
Borchert S J, Ryan M M, Davison R L, et al. Accelerated Extractable Studies of Borosilicate Glass Containers[J]. J Parenter Sci Technol, 1989, 43(2): 67-79. |
| [17] |
Ennis R D, Pritchard R, Nakamura C, et al. Glass Vials for Small Volume Parenterals: Influence of Drug and Manufacturing Processes on Glass Delamination[J]. (3): 393. http://europepmc.org/abstract/MED/11485181
|
| [18] |
Sloey C, Gleason C, Phillips J. Determining the Delamination Propensity of Pharmaceutical Glass Vials Using a Direct Stress Method[J]. Pda Journal of Pharmaceutical Science & Technology, 2013, 67(1): 35. |
| [19] |
Jiang G, Goss M, Li G, et al. Novel Mechanism of Glass Delamination in Type 1A Borosilicate Vials Containing Frozen Protein Formulations[J]. Pda Journal of Pharmaceutical Science & Technology, 2013, 67(4): 323-335. |
| [20] |
Hang P T. Methylene Blue Absorption by Clay Minerals. Determination of Surface Areas and Cation Exchange Capacities(Clay-Organic Studies ⅩⅧ)[J]. Clays & Clay Minerals, 1970, 18(4): 203-212. |
| [21] |
Ogawa T, Miyajima M, Wakiyama N, et al. Effects of Phosphate Buffer in Parenteral Drugs on Particle Formation from Glass Vials[J]. Chemical & Pharmaceutical Bulletin, 2013, 61(5): 539. |
| [22] |
YBB00322005-2-2015中硼硅玻璃安瓿[S]. 2015: 28-31.
|
| [23] |
ICH. Q3D Elemental Impurities[S]. 2015.
|
 2018, Vol. 32
2018, Vol. 32