2. 国家食品药品监督管理总局药品审评中心, 北京 100022
2. Center for Drug Evaluation, China Food and Drug Administration, Beijing 100022, China
根据中国海关数据统计显示,我国2016年医药行业进出口额1034亿美元,同比增长0.7%[1]。我国内地医药产品出口的国家和地区主要集中在美国、印度、日本和中国香港地区。就中药材及饮片的出口市场看,亚洲地区是我国内地出口的主要市场,出口量占我国中药材及饮片出口总量的85.4%,其中第一大市场即是中国香港地区,2016年我国进入香港地区中药材及饮片5.2万吨,虽比往年有所下降,但仍占很大比例[2]。据调查,香港市场出售的中成药约80%的品种是来自内地[3],而澳门约97%的华人有使用中医中药治疗疾病和养生保健的习惯[4]。因此,我国内地药品进入到港澳市场潜力巨大[5]。
香港、澳门作为我国特别行政区,医疗体制的不同使其药品注册管理机制有较大的差异[6]。本文主要从药品注册管理体系、药品注册要求以及注册申报程序三方面对港澳地区药品注册管理机制进行系统的比较分析,以期为内地药品进入港澳市场提供参考。
1 港澳药品注册管理体系比较分析 1.1 药品管理法律体系香港特别行政区的药品管理法律体系是根据药品的不同类别分别立法,目前尚未设立一部总的《药品管理法》 [7]。中药由《中医药条例》监管,西药受《药剂业及毒药条例》管制。香港管理中西药的条例还分散于《进出口条例》《危险药物条例》《不良医药广告条例》等8部条例之中[8]。香港的药品管理呈平行管理的特点,各条例之间的法律效力相同,既可以横向补充,又可以纵向细化[9]。一方面有利于保持对药品立法的统一,避免出现立法空白;另一方面在法律责任方面的规定极其严格,构成了一个较为完善的药品管理法律体系。
澳门第59/90/M号法令明确了药品注册登记的相关事宜,并规定了药品注册须实行预先登记制度;第58/90/M号法令对从事药物的制造、进出口、流通和供应等活动进行管制,是纲领性文件;第53/94/M号法令是专门从事中成药进口、出口及批发商号的法律;第7/89/M号法律对药品广告活动进行管制。此外,还有许多技术性指示和指令针对具体问题给予规定或对上述法令中的某个条文进行部分修订。目前,澳门的药品法律体系尚未统一,在执行上可能会造成混乱,因此仍需要不断完善。
1.2 药品注册管理机构香港的政策制定与执行监管两权分离,食物及卫生局负责药品监督管理的政策事宜,而特区政府卫生署具体负责监管在香港销售的所有药物。香港根据《药剂业及毒药条例》《中医药条例》的规定还分别设立了“药剂业及毒药管理局”和“中医药管理委员会”2个独立法定机构,对西药和中药实行独立监管[10]。西药的监管架构主要由药剂业及毒药管理局和卫生署药物办公室组成:药剂业及毒药管理局处理药剂制品的注册和分类事宜;卫生署药物办公室是执行与药物有关法例,并为药剂业及毒药管理局提供专业和行政支援的机构[11]。中药的监管架构主要由中医药管理委员会和卫生署中医药事务部组成,中成药的注册申请设在香港中医药委员会,而卫生署中医药事务部的职能包括协助香港中医药管理委员会制定和执行各项中医药的管理措施,制订中药材标准。此外,香港海关负责查处有关中西药违反《商品说明条例》和《商标条例》规定的违法行为。
澳门卫生局是执行澳门政府的医疗卫生政策和具有法定职责的部门,该机构受澳门特别行政区政府社会文化司的监督。其主要职能是培训卫生专业人员、辅助并监督私人医疗机构、保障市民健康和预防疾病,为患者提供医疗护理、康复服务及法医服务。卫生局药物事务厅(DAF)是药事主管部门,主管药品行政管理,包括药品注册登记工作。
香港对中药和西药实行相对独立的监管,并由不同部门批准注册,各个部门在药品注册及管理的过程中职能清晰、互相配合、互相监督。而澳门的药品注册和管理机构集中在一个部门,并由该部门进行统一管理[12]。
2 港澳药品注册要求的比较分析 2.1 注册基本条件 2.1.1 香港香港的中药和西药实行独立注册。根据《药剂业及毒药条例》规定,香港境内销售的西药必须向药剂业及毒药管理局注册。若申请的西药是在香港制造,注册申请人应属持牌制造商,或与有关持牌制造商订立合约的持牌批发商;若是在香港以外制造,注册申请人应属进口该药品的持牌批发商,或海外制造商的本地分支机构、附属公司、代表、代理商或分发商。根据《中医药条例》规定,所有中成药都必须经中医药管理委员会中药组(以下简称中药组)注册,方可进口、在香港制造和销售。在香港制造的中成药,可直接提出注册申请;在香港以外制造的中成药,由制造商在香港的代表、代理或其进口商提出注册申请,申请者须按中成药的类别和注册组别进行申请,中药组将根据所申报产品的安全性、品质和疗效决定是否批准有关申请。
2.1.2 澳门澳门中西药的注册统一依照第59/90/M号法令规定的预先登记管理机制,由药物事务厅执行登记工作。本地生产的药品,应由领有卫生局药物工业生产准照的制药厂向药物事务厅稽查暨牌照处提交第59/90M号法令所要求的药品注册材料,药物事务厅根据药品检验的结果,向卫生局提议是否给予登记[13]。若注册成功,同时获得注册证书与销售许可,方可投放市场。进口及出口的药品须得卫生局局长的预先许可,所有未经预先登记的药品,一概不能投放市场[14]。另一方面,进口药品申请人须为持有“药物出进口及批发商号”牌照的公司,所有药品被批准进口前,必须预先呈交相关文件及数据。
2.2 注册提交资料 2.2.1 香港香港的西药制造商申请注册时必须提交证明文件,通常包括药物的制造及品质管制程序的资料、临床研究报告及有关产品在国外售后科学研究报告,以证实有关药物的安全程度、功效及质量符合标准[15]。如有关药剂制品载有新的药剂或生物组分(即有关药剂或生物组分从未在香港注册),申请人需提交两个或以上的国家的当局所签发的注册证明、其安全、疗效和质量方面的专家研究报告、欧盟风险管理计划和美国风险评估及缓解策略以及药品的建议说明书。
中成药根据注册组别不同,需要提交不同资料,但均包含安全、攻效及质量三方面内容。安全性资料包括重金属和有毒元素的检测报告、农药残留检测报告、微生物检测报告、毒性试验报告等;攻效性资料包括中药组方原则及方解、攻效性参考资料、主要药效学研究报告和一般药理学研究报告以及临床试验报告等;品质性资料包括制造方法、原料理化性质报告、质量标准、化验方法和化验报告及稳定性报告等[16]。
2.2.2 澳门澳门所有西药获批准进口前,必须预先呈交以下文件及资料:由原产国或出口国有权限的当局发出的注册证书的正本或鉴证本,或经澳门公证部门或中国领事馆鉴证的副本,倘若出示正本,则由药物事务厅鉴证;由原产国有权限的当局发出的生产准照或相等的文件、外包装样本及说明书。
新药进口须遵守卫生局局长第04/SS/2016号批示[17]中的规定。澳门卫生局将新药定义为含有新活性药物成分的药物,这里的新活性药物成分是指未收载于各国或各地区负责制定及更新药典或国家处方集的主管实体所认可的任何药典或国家处方集的活性药物成分。申请进口新药时,除提交上述文件外,还须提交该药物在两个国家或地区注册及自由销售的官方文件或经认证的副本,关于该药物安全性、疗效和质量方面的专家研究报告,以电子档案形式提交该药物在亚洲人群的临床试验报告或在其亚洲国家或地区相关使用经验的报告,以及欧盟风险管理计划或美国食物及药物管理局的风险缓解策略。持有“药物出进口及批发商号”牌照的公司应将上述全部文件送交卫生局,由药物登记技术委员会审评。
无论是澳门本地生产的还是进口的中成药,每一批产品在上市前均要获得特区卫生局的预先许可,提交资料包括微生物限度、重金属及有毒元素含量。对于已被有关国家或地区批准注册上市的产品,在提交由原产国/地区或来源国/地区的注册证明或自由售卖证明后,可以无需提交微生物限度、重金属及有毒元素含量的检测报告[13]。假如产品来自没有中药注册制度的国家或地区,则须递交安全数据文件,包括微生物限度、重金属及有毒元素含量等检测报告。每次进口须递交进口传统药物的预先许可、外包装样本和说明书等资料。
2.3 中药注册分类 2.3.1 香港香港根据中成药的组成、用途及销售历史等方面将中成药的注册分为“固有药”“非固有药”及“新药”3个类别:“固有药”主要包括古方、古方加减及《中国药典》内记载的处方;“非固有药”中包括保健品和单位中成药颗粒;“新药”则主要包括新发现的药材、药材新的药用部位、中药注射剂、新的中药处方制剂及改变给药途径、改变剂型的中成药[18]。根据药品的安全性、质量和功效等因素将中成药注册组别分为第Ⅰ组、第Ⅱ组和第Ⅲ组,不同的组别注册条件不同,提交的文件及资料也不同。属“固有药”及“非固有药”类别的中成药可选择任一组别进行申请注册。属“新药”类别的中成药,在其组成、用法、主治、剂型等方面可能与传统中成药有区别,需要有现代科学数据的支持以确保其安全及有效,因此必须按第Ⅲ组的注册条件申请注册[19]。
2.3.2 澳门澳门卫生局实行中药预先许可制度,尚未明确中成药的注册分类,可参考由原产国或出口国/地区的自由销售证明或注册证明提交资料。澳门对中药材实施分类管理,根据毒性及药食两用的情况将中药材分为3类:毒性中药材、普通中药材和食药兼用中药材。中药材的分类管理是动态的,可根据中药材的安全性认识及市场产品的情况而作适当的调整[20]。
2.4 临床试验 2.4.1 香港国家食品药品监督管理总局(CFDA)于2017年正式加入人用药品注册技术要求国际协调会议(ICH),而香港药品监管政策与国际接轨,早已全盘引进ICH原则。香港认可国际多中心试验的评价结果,然而目前内地企业的新药进行国际多中心临床试验的很少,因此还需要在香港重新进行临床试验。进行临床试验前,必须先申请临床试验证明书,并将相关申请表及所需资料交至香港卫生署药物办公室药物注册及进出口管制部。香港药剂业及毒药管理局规定,进行的临床试验必须遵从ICH的《药物临床试验管理规范》。
中药组编制的《中成药注册申请手册》规定,为中成药进行各项安全性试验、品质性试验、主要药效学研究及一般药理学研究的场所,必须达到国际标准化组织所制定的规范,即ISO 17025、《药物非临床研究质量管理规范》(GLP),或须为中药组接纳的化验所,国家药品监督管理局及中药组认同的内地药检所亦可被接纳。根据《中医药条例》,为方便在香港进行中成药临床试验,中药组可因申请而发出临床试验及药物测试证明书。进行中成药临床试验的场所,必须达到《中成药药品临床试验质量管理规范》(GCP)或同等水平的标准,国家药品监督管理局及中药组认同的内地临床试验基地亦可被接纳[17]。
2.4.2 澳门澳门对于进口药品采取预先登记制度,主要对其注册资料进行审查以及对上市后的药品进行抽样检验监测,并不要求进行临床试验。
3 内地药品在港澳地区注册申报程序比较 3.1 内地药品在香港的注册程序自2017年1月1日起,香港西药注册申请不再递交到卫生署药物办公室,而必须通过药剂制品/物质注册系统2.0(PRS2.0)的网址(https://www.drugoffice.gov.hk/prs2-ext/client_authentication.jsp)递交新的注册申请,并提供申请费以及相关资料。在香港以外制造的药剂制品,申请人须提交由海外制造商发出的授权信。
所有中成药必须经中药组注册,注册之前需完成所有化验、文件和包装设计,由中成药制造商的香港代理或合作的香港进口商提交申请,并缴纳申请费用。之后由卫生署发出收据及提供申请编号,审核资料是否齐全。如有问题,会再要求提交文件或化验,一般限期14日内,可商议延期;如果没有问题,交予中药组审核,获批注册,提供HKC-XXXXX,并要求缴纳发证费[21]。卫生署发出《中成药注册证明书》,并批准销售。内地中成药在香港注册程序如图 1所示:
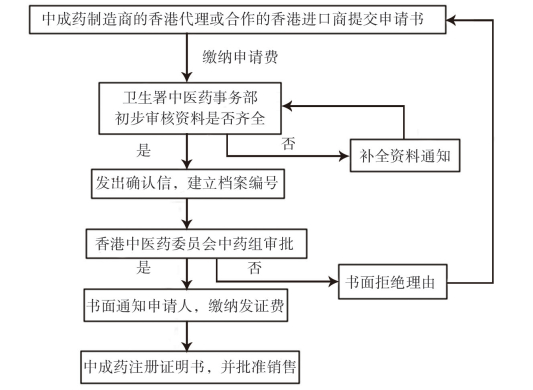
|
图 1 内地中成药在香港的注册程序 |
澳门西药注册实行预先许可制度。进口药品申请人须为持有“药物出进口及批发商号”牌照的公司。所有药品被批准进口前,必须预先呈交前文提到的相关文件及资料。文件及资料必须在首次申请有关药品进口的预先认可证前15天送交药物事务厅并由药物事务部保密存档,而且每次申请进口时必须填写相关的“预先许可”。药物事务厅根据药品检验结果,向卫生局提议是否给予登记。若注册成功,同时获得注册证书与销售许可,方可投放市场。
内地中成药和传统药物在澳门注册需要由澳门持有“药物出进口及批发商号”执照的公司提出申请,进口商须在进口前3个工作日,向澳门卫生局递交产品产地或来源国/地区有权限行政当局发出的注册证书。倘若产品来自没有注册制度的国家/地区,则须提交每批的重金属含量检测报告及微生物限度监测报告。每次进口须递交填写进口传统药物的预先许可、外包装样本及说明书等资料。
澳门中西药注册程序大致相同,具体如图 2:
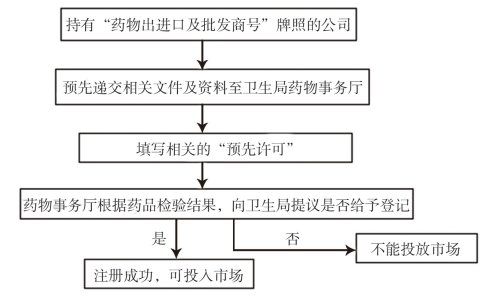
|
图 2 内地药品在澳门注册程序 |
通过分析比较港澳的药品注册管理机制可以看出,内地企业在港澳申请注册时,应根据药品的类别明确注册管理机构,熟悉港澳药品注册的基本要求以及申报程序。内地药品在港澳注册上市,不仅可以借助港澳独特的地理优势走向国际化,还能促使内地企业提升研发水平,提高药品质量。
内地中成药企业到香港上市具有一定的优势,三地同为中华文化的传承者,港澳对中医药有着较高的认可度。同时,内地药品在港澳注册上市存在一些困难,主要表现在以下3个方面:一是内地企业不了解港澳的药品注册管理政策,对如何进入港澳市场缺乏经验,很多事情无从下手;二是内地药品质量标准与发达国家存在一定差距,对于西药,港澳对内地企业的认可度低;三是内地与港澳临床试验数据不互认,导致内地企业在香港注册的动力不足,内地企业香港上市必须在香港进行临床试验,提高了注册成本。
为使内地药品在港澳成功注册上市,促进我国药品走向国际化,医药企业应积极面对,采取有效措施。首先,应加强交流合作,熟悉港澳药品注册审评政策,企业可积极参加学术交流,拓展优秀临床人才研修项目,联合开展医药科学研究以及相关学术活动等,与港澳政府及学术机构建立广泛的联系,促进三方充分交流;其次,与当地经销商密切合作,推动药品注册与推广,内地制造的药品不能由内地企业作为申请人进行申报注册,只能通过港澳当地的进口代理商和企业驻港澳代表或代理人进行注册申请,因此,内地企业应尽量与有实力的药品经销商合作,同时建议有条件的企业在港澳考虑设立相关办事机构,推动药品注册与推广;第三,港澳接受国际多中心临床数据,因此,内地企业应主动提高药品研发质量,积极开展国际多中心临床试验,可以节约香港上市的注册费用。
此外,在条件成熟时,政府可推动三地医疗卫生机构互认试验数据,规范内地企业新药临床试验标准,以进一步与国际接轨,提高港澳对内地企业临床试验数据的认可度。实际上,三地临床试验数据互认,不仅有利于内地企业加快港澳上市进程,也有利于港澳企业到内地上市,拓展港澳医药企业的市场空间,达到互利共赢的目标。
| [1] |
海关统计资讯网[EB/OL]. [2018-03-01]. http://www.chinacustomsstat.com/.
|
| [2] |
人保财险信用保证保险. 2017年医药行业研究报告[EB/OL]. (2017-07-21)[2018-03-01]. https://mp.weixin.qq.com/s/BMOvX_WZkJUMJ-Ezgv0hWA.
|
| [3] |
黄进明. 香港中成药营销环境分析[J]. 医药世界, 2005, 12: 49-51. |
| [4] |
黄洲萍, 王一涛, 胡豪. 澳门中医药科技与产业发展策略研究[J]. 世界科学技术-中医药现代化国际化, 2008, 10(2): 112-115. |
| [5] |
吴潇湘. 统一标准加速中医药海外发展[N]. 中国中医药报, 2015-4-23(001).
|
| [6] |
徐伟, 李梦姣. 香港澳门药品采购制度及其启示[J]. 价格理论与实践, 2015(7): 40-42. |
| [7] |
韩淑杰, 赖舒坤, 吴海文. 香港药品监管法规简介[N]. 中国医药报, 2013-07-25(2).
|
| [8] |
岳新, 单友亮, 赖舒坤. 香港食品药品法律体系[N]. 中国医药报, 2016-02-22(003).
|
| [9] |
钟翎, 肖霄, 毛秋荣, 等. 中国香港特别行政区与大陆药品不良反应监测体系的比较[J]. 中国药物警戒, 2017, 14(3): 153-157. DOI:10.3969/j.issn.1672-8629.2017.03.007 |
| [10] |
岳新, 单友亮, 赖舒坤. 香港食品药品监管组织体系[N]. 中国医药报, 2016-02-24(003).
|
| [11] |
韩淑杰, 赖舒坤, 吴海文. 香港药品监管组织体系简介[N]. 中国医药报, 2013-08-01(4).
|
| [12] |
曾建武, 吴翠玲, 蒋杰. 港澳台地区中药注册政策与技术要求比较[J]. 时珍国医国药, 2015, 26(3): 701-705. |
| [13] |
张婷. 反思澳门药品市场准入制度[J]. 法制与社会, 2014, 5(上): 48-49. |
| [14] |
澳门印务局. 第59/90/M号法令[EB/OL]. (1990-09-19)[2018-03-01]. http://bo.io.gov.mo/bo/i/90/38/declei59_cn.asp.
|
| [15] |
香港卫生署. 香港的药物注册简介[EB/OL]. [2018-03-01]. http://www.dh.gov.hk/chs/useful/useful_registration/useful_registration.html.
|
| [16] |
宋景政, 徐宏喜. 香港中药注册制度和研究开发概况[J]. 亚太传统医药, 2005(1): 17-20. |
| [17] |
香港中医药管理委员会. 中成药注册制度[EB/OL]. [2018-06-01]. http://www.cmchk.org.hk/pcm/chs/#main_reg11.htm.
|
| [18] |
郑永红, 李先元. 香港中成药注册管理工作概述[J]. 中国药事, 2009, 23(9): 857-860. |
| [19] |
王飞. 香港药品监管政策的启示[J]. 中国药物经济学, 2011(1): 78-83. DOI:10.3969/j.issn.1673-5846.2011.01.010 |
| [20] |
王海南. 澳门特区中药安全监管的现状与面临的[J]. 中国药事, 2008, 22(8): 631-633. |
| [21] |
香港中医药管理委员会. 香港中成药注册申请手册[M]. 香港: 政府物流服务署, 2004: 8.
|
 2018, Vol. 32
2018, Vol. 32 
