2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
医疗器械作为一种特殊的商品,其使用对人体健康有着直接的影响,在世界各国都受到严格监管。2000年,我国发布了《医疗器械监督管理条例》,标志着对医疗器械开始实施更为规范的监管,并随后在2002年发布《医疗器械分类目录》(以下简称2002版目录),以促进和规范医疗器械的行业发展。经过十几年的发展,新的医疗器械不断涌现,2002版目录一定程度上已经不能满足需求。原国家食品药品监督管理总局于2015年启动了全面修订《医疗器械分类目录》的计划,并于2017年8月31日发布新《医疗器械分类目录》(以下简称新分类目录)。新分类目录在结构框架、内容设置、产品数量上都进行了较大的调整和丰富,为更方便地服务于医疗器械的注册提供法规基础,为医疗器械的科学监管提供更有力的技术支撑,有利于促进医疗器械行业的规范发展。
1 概述医疗器械消毒灭菌器械是指通过物理或化学的方式对医疗器械表面的微生物进行杀灭的器械。其中,消毒是指杀灭或去除病原微生物的过程,使之无害化,不致引起感染或致病;灭菌是指杀灭或去除一切微生物的过程,包括病原和非病原微生物及细菌芽孢,使之完全无菌。消毒和灭菌的区别在于杀灭或去除的目标微生物和程度不同,即消毒处理不一定都能达到灭菌要求,而灭菌一定可达到消毒的目的[1]。医疗器械消毒灭菌器械一般用于医疗机构的手术器械、医用卫生敷料等可重复使用的医疗器械的消毒和灭菌,属于不与患者直接接触的医疗器械。该类器械通常在医疗机构的消毒供应中心使用,是医疗机构控制感染的重要环节。医疗器械消毒灭菌不严会引起各类疾病的感染,具有一定的风险。在2002版目录和新分类目录中,医疗器械消毒灭菌器械都是被单独设立一个子目录进行管理[2]。
1.1 2002版目录中医疗器械消毒灭菌器械的分类管理情况在2002版目录的43个子目录中,《6857消毒和灭菌设备及器具》 [3]涵盖了主要的物理和化学形式的消毒和灭菌器械,详见表 1,包括压力蒸汽灭菌器、干热灭菌器和环氧乙烷灭菌器等。2002版目录只设立一级产品类别,主要以消毒灭菌的原理和形式进行划分。这种设置适合最初我国医疗器械产品类别较少的情况。这种目录结构下,医疗器械产品类别主要通过品名举例进行判定,若产品名称稍有不同,就会因审评人员理解的不同,有可能产生不同的决定结果。此外,若产品的名称不能真实反映产品的原理和使用情况,这种根据品名举例而进行类别的判定也存在不规范和不科学性之处。
|
|
表 1 《6857消毒和灭菌设备及器具》 |
新分类目录对2002版目录进行了整合。由于医疗器械消毒灭菌器械在临床使用上比较独立,因此新分类目录中仍然单独设立《11医疗器械消毒灭菌器械》子目录。它的主要内容来自2002版目录中的《6857消毒和灭菌设备及器具》,并在6857基础上对新出现的器械进行了扩增,对淘汰或不按照医疗器械管理的器械进行了删减。此外,由于医疗器械消毒灭菌前的清洗是消毒灭菌过程的必要环节,因此,医用清洗器仍被保留在目录中。
2015年我国发布《医疗器械分类规则》 [4](以下简称《规则》),医疗器械分类管理仍然实行分类规则指导下的分类目录制。根据《规则》,消毒灭菌类医疗器械按分类判定表应按照不低于第二类进行管理。《11医疗器械消毒灭菌器械》子目录中除了不具有消毒灭菌功能的清洗器械按第一类管理外,其他均按照第二类管理,符合分类规则。
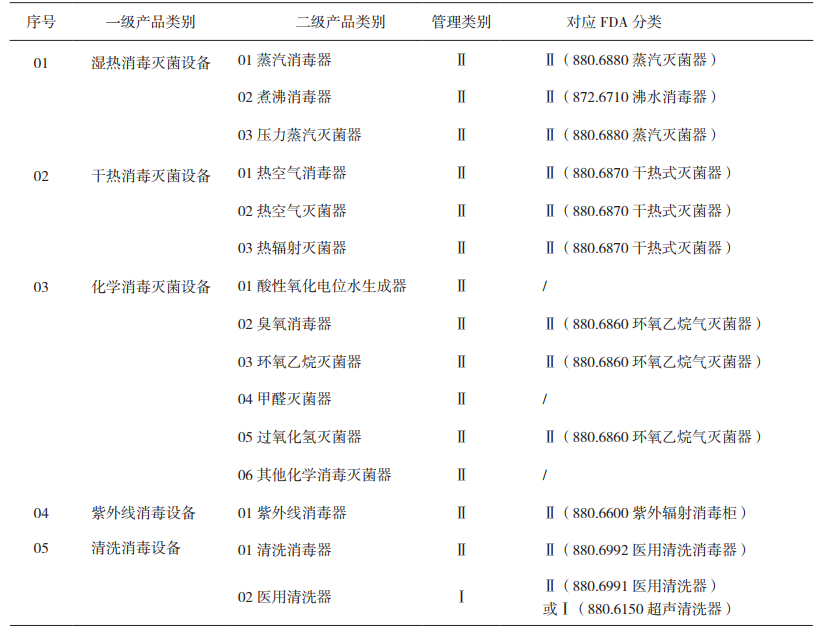
《11医疗器械消毒灭菌器械》子目录按灭菌原理划分,共设置了5个一级产品类别,涵盖了现有医疗器械消毒灭菌方法中的湿热消毒灭菌、干热消毒灭菌、化学消毒灭菌、紫外线消毒、清洗消毒5个大类的产品,并细分为15个二级产品类别。其中,蒸汽消毒器和压力蒸汽灭菌器的结构特征、风险特征相似,不同之处在于二者设定的消毒/灭菌参数不同,进而导致预期用途不同;热空气消毒器和热空气灭菌器的区别也是预期用途不同;紫外线消毒器如果仅用于空气或物体(不包括医疗器械)表面消毒,则仍然沿用以往分类界定结果继续不作为医疗器械管理,因此,新分类目录中明确了紫外线消毒器的预期用途为用于医疗器械的消毒。
1.3 新旧目录对比与2002版目录中《6857消毒和灭菌设备及器具》相比,新分类目录中的《11医疗器械消毒灭菌器械》子目录新增了蒸汽灭菌器、酸性氧化电位水、臭氧消毒器、甲醛灭菌器、过氧化氢灭菌器、其他化学消毒灭菌器6个二级产品类别,以涵盖新出现的医疗器械2002版目录中用于医疗机构的空气消毒灭菌的高压电离灭菌器械参考已经发布的分类界定结果不再作为医疗器械管理,无源的煮沸消毒器类器械“贮槽”已经多年无此类注册证,新分类目录中未保留这两类器械。《11医疗器械消毒灭菌器械》子目录中,将产品类别细分为一级产品类别和二级产品类别。二级产品类别对产品的结构和消毒灭菌原理等进行了概括,对产品的特定临床用途进行了描述和区分,为使用者更好地定位产品的位置和在不同维度对产品进行判定提供便利和依据。
2 与FDA、欧盟分类的比较 2.1 FDA消毒灭菌器械的分类FDA的医疗器械分类模式是分类目录制加注册数据库。如果分类目录中没有具体分类,那么产品可以通过实质等同的方式确定分类并注册。其中分类目录相关法规集中在联邦法规第21章的862部分到892部分。产品目录的划分以临床科室的划分为依据,共设置16个产品大类[5]。
FDA分类法规中涉及消毒灭菌器械的部分主要集中在联邦法规第21章的880部分-医院与个人常规设备中,另外在872部分-牙科器械中也设置有两类专门用于牙科器械消毒灭菌的设备。通过对比可以看出,《11医疗器械消毒灭菌器械》子目录中二级产品类别与FDA的对应关系比较明显,且对应产品管理类别比较一致。其中,可比较的二级产品类别中,管理类别完全一致的比例达83%,详见表 2。有些产品的管理因别不同,在FDA按第一类管理的沸水消毒器在我国按第二类管理。由于沸水消毒器消毒效率低,不适用于自动化控制管理,在美国已经被淘汰,实际FDA中并没有相应注册产品。我国在部分不发达地区的基层医疗机构还在普遍使用沸水消毒器。由于沸水消毒器消毒具有控制感染的重要功能,具有一定风险,我国把该类产品管理类别定为第二类以加强管理,仍具有实际意义。此外,从表 2可以看到,我国按一类管理的医用清洗机,在FDA细分为两类,一种是按第一类管理的超声清洗器,另一种是按第二类管理的主要用于清洗、干燥麻醉器械、手术器械的医用清洗器。
|
|
表 2 《医疗器械消毒灭菌器械》对应FDA分类 |
FDA医疗器械目录中设置的消毒灭菌类产品种类较少,目录中没有涵盖的产品可以通过与注册产品实质等同的方式进行分类。例如,对于臭氧消毒器、过氧化氢等离子灭菌器这类产品,FDA并没有设立相关的分类,而是通过实质等同对应到环氧乙烷消毒器这一分类中。除了表 2中所列产品类别外,FDA目录中还包括按第三类管理的用于牙科根管器械干热灭菌的专用器械和液态消毒剂。虽然FDA规定用于牙科根管器械干热灭菌的器械按第三类管理,但是上市前审批(Premarket Approval,PMA)数据库并没有该类产品的注册信息,即实际上美国也不存在按第三类管理的消毒灭菌器械。而非专用的液态消毒剂在我国不按医疗器械管理。
2.2 欧盟消毒灭菌器械的分类欧盟的医疗器械分类模式是分类规则制,最新的欧盟医疗器械2017/745号法规根据产品的预期用途,即作用方式、作用时间、作用部位等,规定了22条分类规则。根据2017/745号法规附录Ⅷ的规则16,用于消毒侵入式器械,或作为消毒处理终点的消毒液、清洗消毒器的管理类别为Ⅱb类[6]。其他用于医疗器械消毒灭菌的器械的管理类别为Ⅱa类。显然,欧盟的分类原则与我国和FDA有所不同。它的分类原则更细致,是根据产品的预期使用目的,即根据产品的预期消毒灭菌的器械来划分的。同一种消毒灭菌器械,如果预期用于消毒灭菌的产品不同,管理类别分别划分为Ⅱa类或Ⅱb类。与此同时,根据欧盟的分类,消毒灭菌产品并没有按第一类或第三类管理,即跟我国的管理类别相对一致。
3 小结新分类目录中的医疗器械消毒灭菌器械种类较2002年版目录有所增加,根据分类界定明确不按医疗器械管理的器械不再纳入目录;新分类目录增加设置了二级产品类别、产品描述和预期用途,有利于界定产品管理属性、确定产品管理类别及在分类目录的位置,对消毒灭菌类医疗器械的规范、发展具有正面意义。消毒灭菌类器械的管理类别相对美国、欧盟具有较高的一致性,一定程度上说明我国对该类器械的监管力度也是与世界发达国家和地区一致性较高。对于美国等发达国家和地区已经淘汰的部分相对落后的消毒灭菌产品,由于在我国的基层卫生机构还在普遍使用,所以仍应加强管理。
| [1] |
王志敏. 消毒与灭菌方法的选择[J]. 医药工程设计, 2003(3): 39-46. DOI:10.3969/j.issn.1008-455X.2003.03.013 |
| [2] |
国家食品药品监督管理总局. 总局关于发布医疗器械分类目录的公告(2017年第104号)[EB/OL]. [2017-09-04]. http://www.sda.gov.cn/WS01/CL0087/177089.html.
|
| [3] |
国家食品药品监督管理总局. 医疗器械分类目录[S]. 2002.
|
| [4] |
国家食品药品监督管理总局. 医疗器械分类规则[S]. 2015.
|
| [5] |
U. S. Food and Drug Administration. Code of Federal Regulations Title 21-Food And Drugs Chapter Ⅰ-Food And Drug Administration Department Of Health And Human Services Subchapter H[S]. 2018(update).
|
| [6] |
The Council of the European Communities. Regulation (EU)2017/745 of the European Parliament and of the Council[S]. 2017.
|
 2018, Vol. 32
2018, Vol. 32