药品是人类维持生命及保证生命尊严的必需品。鼓励新药研发和保证药品可及性是永恒的话题。药品研发周期长、投入大;同时,也面临成功率极低的风险,需要借助于相关制度对药品研发的成果予以充分保护。另一方面,为了药品的可及性,保证高质低价的仿制药在原研药专利期满后尽早仿制上市,需要鼓励仿制者进行专利挑战,促进仿制药的良性竞争。
2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确指出探索建立药品专利链接制度,开展药品专利期限补偿制度试点,以促进药品创新和仿制药发展。
1 我国药品知识产权保护存在的问题 1.1 现行的专利链接制度不完善目前,我国已经在《专利法》中增加了Bolar例外条款,《药品注册管理办法》中也规定仿制药申请人需提交不侵权申明,但是配套的法律、法规并不健全,不能发挥其作用,而专利链接制度是解决这一问题的有效手段。
由于我国没有建立起相应制度,当仿制药申请出现专利纠纷时,药品审批部门为避免陷入“共同侵权”而不得不中止审评,致使国内仿制药无法及时上市;出现了外资进口药专利过期后被迫退出美国市场,但在中国仍以非专利原研药地位继续保持高价占领市场,实质上是在变相延长进口专利药市场独占期的不合理现象。因此,建立专利链接制度不能简单地认为是在单方面保护专利药,这一制度同时也在推动仿制药的发展。
1.2 创新药上市后剩余有效专利期限短2008-2016年我国共批准上市13个国产“1.1类”化药,尽管多数产品获得了特殊审批或重大专项绿色通道的加速审批,但从申请临床受理开始到获得生产批件平均需要7.9年,其中上市申请审批时间平均为2.3年,上市后剩余专利期平均仅9年。
根据新药上市后市场收益规律,这些药品市场投资回报期非常短,盈利空间非常小。如获得“十一五”“十二五”国家重大新药创制专项支持“1.1类”药物苹果酸奈诺沙星,上市后专利剩余期限仅2年。该创新品种面临尚未完成临床推广应用就要直接沦为仿制药的窘境,这种现象极大地打压了研发创新药的积极性;进一步说明提高药品审评审批效率和实施专利期补偿制度的必要性。
2 专利链接制度创新与仿制的平衡 2.1 专利链接制度的内涵1984年美国颁布了《Hatch-Waxman法案》(又名《药品价格竞争与专利期补偿法》),设立专利链接制度和专利期补偿制度。药品专利链接制度是仿制药上市申请审批与相应药品专利有效性审核之间的链接。从运作角度看,美国药品专利链接制度主要包括两方面的内容[1-4]:1)橘皮书制度:创新药企业向美国药品监督管理局(FDA)进行新药申请时,需提交覆盖该新药的药品或使用方法专利信息,新药申请批准后,FDA将上述信息公布于《经治疗等同性评价批准的药物》一书中(又称为“橘皮书”)。仿制药注册过程中涉及的专利,仅针对橘皮书记载的专利。2)仿制药简化申请制度(ANDA):仿制药进行上市申请时,不需要再重复提交新药申请已经提交的证明药品安全性和有效性的数据,只需进行生物等效性研究。同时,仿制药申请人应提交相关药品专利状态的声明:①声明Ⅰ:橘皮书没有相关药物的专利登记信息;②声明Ⅱ:相关药物的专利已经过期;③声明Ⅲ:在相关专利失效前,不要求FDA批准该仿制药;④声明Ⅳ:相关专利无效或仿制行为不侵权。
“声明Ⅰ”“声明Ⅱ”类声明,FDA可以直接批准;“声明Ⅲ”类声明,是仿制药企业承认该注册申请涉及某项专利,并承诺在专利到期前不生产该药品。因此,针对此类申请,FDA只有在相关专利期届满后方可批准ANDA申请。
提交“声明Ⅳ”的ANDA申请,通常被称为专利挑战。ANDA申请者应在申请提交后20 d内通知专利权人或批件持有者。专利权人在收到通知后的45 d内可向法院提出专利侵权的诉讼,仿制药申请者也同样可以提出确认专利无效的反诉。若45 d内专利权人未向法院提起诉讼,FDA完成仿制药的审评后将批准符合条件的仿制药的上市。若专利权人在45 d内提起诉讼,对仿制药的批准FDA会自动推延30个月,期间FDA不停止对仿制药的审评。为了避免遏制期被滥用,规定每个ANDA仅有一次30个月遏制期。
为了鼓励仿制药公司挑战原研药专利,使仿制药能提早进入市场,给予挑战专利的首仿药180 d市场独占期。
如图 1所示美国通过完善药品专利制度,在仿制药生命周期的各个阶段建立了专利纠纷解决机制:提交上市申请前的研究阶段,实施相关专利的行为可适用Bolar例外规定,不视为侵犯专利权;仿制药企业提交ANDA申请进入专利链接程序,依据上述规定解决专利侵权纠纷。专利链接制度实现药品监管部门和法院的链接,专利的有效性和侵权纠纷由法院判决,而药品监管部门专注于药品的审评审批工作,免于陷入专利侵权纠纷的漩涡。
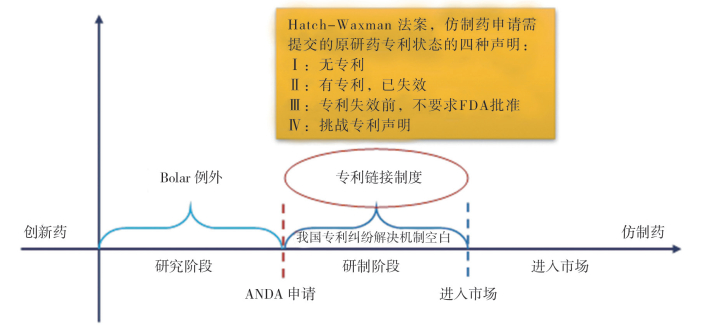
|
图 1 仿制药申请各阶段专利纠纷解决机制示意图 |
药品专利链接制度通过设立药品专利纠纷的特殊解决机制,有利于在仿制药审批阶段解决专利权属纠纷。一方面能够为创新专利药研发企业在仿制药上市前给予充分的预警,维护专利权人的合法权益。同时,该制度通过设立药品专利纠纷的特殊解决机制,有利于在仿制药审批阶段解决专利权属纠纷,给予仿制药申请人以确定的市场预期,降低上市后的侵权风险。
2.2.2 专利链接制度鼓励专利挑战,加速仿制药替代药品专利链接制度促进了新药和仿制药共存发展,促进了仿制药与新药的竞争。美国是全球专利挑战仿制药最多的国家,1995-2014年新分子实体受到专利挑战的比例增高了8倍,且原研药上市后提出首个专利挑战的平均时间由18.7年缩短至5.9年,仿制药企业通过专利挑战并取得美国首仿药资格上市,不仅仅可为企业赢得巨额利润[5],专利链接制度的实施提高了仿制药替代率,加快了仿制药上市后市场份额的增长速度。首个仿制药上市后一到两年内,品牌药的销量快速下降,市场占有率快速降低,甚至撤出市场。近年来品牌药市场份额在首个仿制药上市后下降的趋势和速度更为显著,1999-2000年间首个仿制药上市12个月后品牌药的市场份额为45%,而到了2013-2014年这一数字仅为12%[5]。
美国在此期间成为全球仿制药大国,美国仿制药处方量占比从1984年的12%上升到2016年的89%,2007-2016年仿制药为美国的医保系统节约了1.67万亿美元[6]。
3 专利期限补偿制度延长创新药获益时间刺激创新产出 3.1 专利期限补偿制度的内涵药品专利期补偿制度是指由于研究药品在获准上市销售之前必须经过一系列证明其安全性和有效性的评价试验,以获取药品审批部门的批准,这些试验需要投入大量的时间和资金,为弥补政府审批所造成的药品有效专利期损失,对符合特定条件的获得某项专利的药品,在该专利期满后再给予额外的专利期补偿。专利期补偿制度最直接的作用就是增加了专利药的市场独占期。
美国是最早建立专利期补偿制度的国家,并成为支撑美国创新药产业发展的基础。日本紧随美国之后建立,但内容与美国有较大的差异,主要体现在延长次数和延长期内保护范围。一般情况下,与美国相比,日本的专利期补偿制度给予药品更长的延长期。欧盟自1993年开始实行补充保护证书(SPC)制度,该制度是欧盟根据实际情况对专利期补偿制度的一种变型。SPC制定的目的是通过政策优势吸引创新型制药企业,减少其向美国和日本等国迁移的趋势,缩小欧盟制药商与国际竞争者的差距[7]。
表 1列示了美国、日本和欧盟在药品专利期补偿制度上的主要差异。其中,美国和日本的专利期补偿制度有一定程度的相似性,申请延长的专利类别一致,产品专利和方法、用途专利均可申请补偿,并且都是对原专利期限的延长。同时美国和日本也存在较多差异,美国专利期补偿仅针对首次上市或商业使用的药品,并且一个新药只能选择一项专利延长一次,而日本放宽了对申请的条件、补偿范围和延长次数的限制;延长期限的差异主要在于美国在计算时将临床试验占用的时间减半,而日本没有减半计算,并且日本没有对原专利剩余保护期与补偿期限之和的限制。
|
|
表 1 美国、日本、欧盟专利期补偿制度的比较 |
欧盟与美国、日本的专利期补偿制度存在较大差异,SPC证书是授予新药一种以专利权为基础的市场独占权,因此SPC证书的授予条件、保护范围注重基础专利与药品成分的匹配[8]。对于SPC保护期限的计算,欧盟采取用专利申请至药品上市的期限减去合理推定的专利实施时间的计算方法,目的在于保证药品上市后具有较充足的有效专利期。按照欧盟算法,在专利申请日后第5年至第10年之间上市的药品都可以享有15年的有效专利期,在专利申请日后第10年至专利到期日之间上市的药品享有最短5年、最长15年的有效专利期。欧盟与美国计算方法的差异,一是计算时并不考虑专利授权日期,不是对临床试验和行政审批占用的有效专利期进行补偿;二是相比较于美国算法,一般情况下按欧盟算法计算的专利期限补偿更长。
3.2 专利期限补偿制度实施效果美国实践证明,专利期补偿制度充分激励了创新药企业的研发积极性,通过制度优势,吸引着全球医药创新企业将美国作为创新药的上市的第一市场,迅速带动美国医药创新行业的繁荣,使美国成为全球医药创新发展霸主。美国1984-2012年获得专利补偿的323个药品,平均专利延长期限为2.7±1.4年(中位数为2.2年)[9]。对美国2001-2016年批准上市30个专利药的上市后剩余专利期进行统计,原始专利剩余专利期为11.3年,延长后平均为13.2年。
该法案颁布前,全球生物医药领域的创新活动发轫于欧洲,但如今美国成为了新药研发的首要基地。法案实施之后,全球创新药首次在美国上市量由1984年不到10%上升到2017年的78%[10]。率先在美国上市的前提是创新药物率先在美国开展临床试验,由此带来美国临床试验水平,尤其是探索性临床试验的快速提升。根据欧洲制药工业协会(EFPIA)统计,全球顶级的100家医学研究中心分布在北美的有56家,分布在欧洲有37家。其中,前10的机构中,美国有8家,欧洲有2家[11]。
4 中国引入专利链接制度和专利期补偿制度的思考和建议国际实践经验证明,完整、可操作的专利链接制度为全体市场参与者提供了市场可预测性,在保护专利权人合法权益的同时,提供了一种早期有效解决药品专利权纠纷的机制,避免了专利纠纷对药品审批的影响;并且,鼓励仿制药企业挑战专利,促进高质量仿制药的及早上市,实现对专利药品替代。药品专利期补偿制度在激励制药企业增加研发投入、降低新药投资的风险、保证创新者的合理回报、维持产业持续的创新活力等方面具有重要的推动作用。
4.1 建立并完善专利链接制度的建议1)明确专利链接制度的内涵和实施主体
药品专利链接制度的核心是建立仿制药上市审批与仿制药申请人是否侵权审核之间的链接。申请人在向国务院药品监督管理部门提交仿制药注册申请时,专利权人认为仿制药申请人侵犯其专利权,由人民法院对仿制药申请人是否侵权及相应的药品专利有效性进行审核的制度。
2)完善《中国上市药品目录集》制度
《中国上市药品目录集》作为专利链接制度实施的前提,由国务院药品监督管理部门负责编纂和更新。为防止专利权人滥用药品专利信息备案制度阻止合法仿制,应由对申请人提交的专利相关信息、专利保护范围与批准药品的关联性进行审核。并且设置专利信息收载异议解决机制。
3)完善专利链接制度的司法诉讼体系
仿制药申请人应当在提交上市申请时提交专利权属状态声明,并在规定日期内告知专利权人,专利权人在规定期限内向指定的法院提出侵权诉讼的,药品监督管理部门将给予18个月的等待期,等待期内药品监督管理部门不停止审评;在此期间,法院做出终审判决的,按照法院判决执行;法院没有做出生效判决的,可以发放药品批准文件。为了保证人民法院适用法律尺度均一和审判标准统一,受理因专利申请而引发的药品专利诉讼的应为药品监督管理部门所在地的专门法院。
批准等待期应根据专利侵权案件的平均审判时间和国家药品监督管理部门仿制药的审批时间综合判断。一个药品应只设置一次批准等待期。
4)明确首仿药的概念,鼓励仿制药企业挑战专利
“首仿药”应是首个提交符合要求的仿制药上市申请,及专利无效或不侵权声明,并且成功挑战专利的仿制药。专利挑战成功的条件为专利侵权诉讼案件中仿制药申请人胜诉,法院判决被仿制药品专利无效或仿制药申请人不侵犯专利权。为了鼓励仿制药申请人挑战专利,给予其18个月的首仿药独占期。但是为了避免出现挑战成功者与原专利权人合谋,形成市场垄断,应设置市场独占期失效的规定。
4.2 建立专利期补偿制度的建议1)明确药品专利期限补偿的定义和补偿品种的范围
对因依照国家法律、法规及规章的规定,开展临床试验和行政机关审评审批占用的授权后有效专利期给予适当专利期限补偿。考虑到我国在化学药品审批和专利审查实施方面具有较长期的实践,因此,首先对化学药品进行专利期限补偿试点。建议先对与新药审批直接相关的专利进行补偿,即化合物专利、含有新活性成分的组合物专利及用途专利。
2)明确申请专利期限补偿的条件
依据鼓励高水平的创新药、利益平衡的原则,对申请条件进行限制。获得补偿药品应是己获得上市批准的新药,在药品在获批上市前专利已授权,药品与专利必须具有相关性,一项专利只能补偿一次,一个药品只能选择一项专利进行补偿。鼓励跨国制药公司及早地在中国开展临床试验,有效提高我国的临床试验水平,可要求申请补偿的药品必须在我国开展完整的临床试验。
3)专利补偿期限的计算方法
建议专利补偿期限的计算方法为临床试验时长的一半与正常行政审批期限之和,并扣除申请者未尽责时长。此计算方法符合公平、公正的原则。核心在于关键时间节点的确定。补偿期最长为5年,并且药品在全球首次上市后剩余的专利期与补偿期限之和不超过14年。
另外,应建立专利期补偿和药价平衡机制。药品获得专利期补偿,应当与专利管理部门签订补偿期内年度降价协议,并向社会公布。
| [1] |
丁锦希, 韩蓓蓓. 中美药品专利链接制度比较研究[J]. 中国医药工业杂志, 2008, 39(12): 950-955. DOI:10.3969/j.issn.1001-8255.2008.12.020 |
| [2] |
陈敬, 史录文. 美国药品专利链接制度研究[J]. 中国新药杂志, 2012(22): 16-19. |
| [3] |
张鹂, 宋瑞霖, 陈昌雄, 等. 药品注册审批工作中专利相关问题探讨[J]. 中国药房, 2006, 17(9): 644-650. DOI:10.3969/j.issn.1001-0408.2006.09.001 |
| [4] |
杨莉, 李野. 美国的药品专利连接制度研究[J]. 中国药房, 2007, 18(4): 251-253. DOI:10.3969/j.issn.1001-0408.2007.04.005 |
| [5] |
Henry Grabowski. Updated Trends in US Brand-name and Generic Drug Competition[J]. J Med Econ., 2016, 19(9): 1-26. |
| [6] |
FDA. Generic Drug Access and Savings in the U. S. Report. Association for Accessible Medicines[S]. 2017.
|
| [7] |
EEC. Proposal for a COUNCIL REGULATION(EEC) Concerning the Creation of a Supplementary Protection Certificate for Medicinal Products[S]. 1990.
|
| [8] |
Ulrich Storz. Patent Lifecycle Management, Supplementary Protection Certificates and Data Exclusivity in Biopharmaceutics[J]. Springer Berlin Heidelberg, 2012, 25-41. |
| [9] |
Bin Sawad AH. Analysis of the Waxman-hatch Act Pharmaceutical Patent Extensions(1984-2012)[J]. Value in Health, 2013, 16(3): A245-A245. |
| [10] |
FDA. Advancing Health Through Innovation 2017 New Drug Therapy Approvals[S]. 2018.
|
| [11] |
EFPIA. Annual Review and forward look[S]. 2013.
|
 2018, Vol. 32
2018, Vol. 32 
