2. 中国食品药品检定研究院国家药物安全评价监测中心、药物非临床安全评价研究北京市重点实验室, 北京 100176;
3. 中国食品药品检定研究院, 北京 100050
2. Beijing Key Laboratory for Safety Evaluation of Drugs, National Center for Safety Evaluation of Drugs, National Institutes for Food and Drug Control, Beijing 100176, China;
3. National Institutes for Food and Drug Control, Beijing, 100050, China
神经毒性是新药及先导化合物早期筛选和临床前安全性评价的重要组成部分。传统的神经毒性评价试验主要采用大鼠功能观察组合试验以及组织病理学检查方法[1, 2],缺点是需要使用大量的实验动物,周期长,费用高,结果判断主观性强[3]。近年来,随着国际上动物试验的“3R”原则要求以及各种体外细胞培养技术的发展[4],可以实现从细胞结构和功能改变的多指标筛选和评价药物引起的神经毒性,其优势在于可实现高通量高内涵筛选[5],并从作用机制上解释和评价药物的神经毒性作用。
神经系统体外研究的细胞模型包括细胞系[6]、原代培养细胞[7]以及干细胞模型[8]。神经干细胞可分化为中枢神经系统的三种主要细胞,包括神经元、星形胶质细胞和少突胶质细胞;其增殖性和多能性为预测药物毒性和体内代谢作用提供了丰富的资源[9]。然而单一的体外细胞模型并不能完全评价所有神经毒物的毒性靶点,因此,选择相应的细胞模型和评价指标评价特定类型神经毒物的神经毒性。
在神经毒性评价方面,OECD提出了综合测试和评估方法[10],试图从各种神经细胞模型获得数据、通过验证和综合评估后用于药品监管[11]。本研究利用体外培养SD大鼠神经干细胞。选用已知具有神经毒性的抗肿瘤药长春新碱、顺铂;选用具有发育神经毒性作用的抗癫痫药丙戊酸钠、苯妥英钠;选用具有神经毒性和发育神经毒性的化合物乙醇、丙烯酰胺;选用具有神经毒性的麻醉剂丙泊酚、瑞芬太尼;选用具有神经毒性的纳米制剂氧化铁纳米粒子[12];检测SD大鼠神经干细胞对神经毒性的检出能力。选用可促进神经干细胞生长的神经生长因子[13]以检测该模型的敏感性。通过检测对神经干细胞球聚集的抑制作用以及对神经干细胞的增殖毒性作用;评价药物的神经毒性和发育神经毒性,以期为新药早期筛选和神经毒性的临床前安全性评价提供有效的体外替代方法。
1 实验材料 1.1 实验动物怀孕14~14.5 d SD大鼠,1只。购自北京维通利华实验动物技术有限公司。
1.2 主要试剂和试剂盒OriCellT M SD大鼠神经干细胞完全培养基(100 mL每瓶,RASNF-01001,赛业生物科技);Anti-Nestin Antibody(100μg,Lot. No.2780475,Millipore);Goat pAb to Ms IgG(Cy3)(0.5mg·mL-1,Lot. No.GR251063-6,Abc a m);胎牛血清(500 mL每瓶,Lo t. No.1565565,Gibco);D-Hanks液(500 mL每瓶,Lot. No.8115074,Invitrogen);胰酶-EDTA(100 mL每瓶,Lot. No.20141211,北京北科慧宇实验器材有限公司);CollagenⅠRat Tail(100 mL每瓶,Lot. No.1834231,Gibco);Click-iT® EdU Alexa Fluor® 488 Flow Cytometry Assay Kit(50 assays)(Lot. No. 1711804,Thermo Fisher)。
1.3 受试物 1.3.1 检测组注射用硫酸长春新碱(简称,长春新碱)(1 mg,Lot. No.1405V1,深圳万乐药业有限公司);注射用顺铂冻干型(每瓶10 mg,Lot. No. H20023460,齐鲁制药有限公司);瑞芬太尼(每瓶20 mg,171260-200601,中检院标准物质);氧化铁纳米粒子(10 mL,直径5 nm的磁性纳米颗粒溶液,胺官能化的,1 mg·mL-1 Fe,在H2O中的分散体,MKBR2641V,Sigma);丙泊酚注射液(10 mL,0.1g,Lot. No.H20040079,四川国瑞药业有限责任公司);丙戊酸钠(50 mg,Lot. No.100963- 201302,中检院标准物质);苯妥英钠(50 mg,Lot. No.100210-201303,中检院标准物质);丙烯酰胺(1 mg·mL-1,Lot. No.20150427,国药集团化学试剂有限公司);乙醇(纯度100%,Lot. No.20150917,国药集团化学试剂有限公司)。
1.3.2 对照组空白对照组(SD大鼠神经干细胞完全培养基);神经生长因子组(20 μg,Lot. No.GF028,Millipore)。
1.4 主要仪器设备实体显微镜(型号:MZ APO,厂家LEICA;灯型号:LG-PS2;厂家OLYMPUS);倒置显微镜(型号:CKX31;厂家:日本OLYMPUS);倒置荧光显微镜(型号:IX71;厂家:日本OL YMP US);光学显微镜(型号:BX- 51;厂家:OL YMP US);超净工作台(型号:BCN1360B,厂家:北京东联哈尔仪器制造有限公司);CO2培养箱(型号:10-0221;厂家:日本R.K.J);高速冷冻离心机(型号:H-500FRS,厂家:日本KOKUSAN);CCD显微成像系统(型号:DP73-ST-SET;厂家:OLYMPUS);Cell Sens standard分析软件(厂家:OLYMPUS);流式细胞仪(型号:FACS Calibur;厂家:BD公司)。
2 试验方法 2.1 SD大鼠神经干细胞培养怀孕14~14.5 d;SD大鼠经异氟烷麻醉后,剖开腹腔,完全放血,连同胎盘和胎膜摘取双侧胚胎组织,置于75%乙醇溶液中浸泡消毒10 min。置于无菌操作台中,剥离胎膜和胎盘,将完整的胚胎移入D-Hanks液中,清洗2~3遍,在体视显微镜下剥离胚胎脑部皮肤、颅骨、脑膜肉眼清楚可见的大血管后取出全脑,置于冰板上的D-Hanks液中。脑组织剪碎后,加入0.25%胰酶-EDTA,置37℃ 5% CO2温箱中消化15 min,用含10%胎牛血清的DMEM/F12培养基终止消化。将消化好的脑组织吹打成单细胞悬液,于200目筛网过滤,1000 rpm·min-1离心5 min,弃上清液,用1 mL SD大鼠神经干细胞完全培养基洗细胞2次,加入适量SD大鼠神经干细胞完全培养基后吹打成单细胞悬液,细胞计数并调整密度为5×105·mL-1,接种于细胞培养瓶中。将神经干细胞置于37℃ 5% CO2温箱中培养3~4 d,神经干细胞开始聚集成神经球,采取半数换液法继续培养3~4 d。神经干细胞传代:将形成一定大小的神经球培养液离心,1000 rpm·min-1离心5 min,沉淀物重悬后,反复吹打成单细胞悬液,再继续于新的SD大鼠神经干细胞完全培养基中培养1代。此时,形成的第2代神经干细胞球生长稳定,可应用于神经毒理学研究。
2.2 神经干细胞鉴定将悬浮生长的神经球接种于包被有多聚赖氨酸的多孔培养板中,使细胞贴壁生长。贴壁细胞用预温的PBS洗3次;应用4%多聚甲醛在室温固定细胞20 min;PBS洗3次;0.2%Triton X-100透化15 min;PBS洗3次;5%羊血清封闭37℃孵育30 min;加入1:100稀释的一抗anti-Nestin antibody,4℃过夜;PBS洗3次;加入1:1000稀释的二抗Goat pAb to Ms IgG(Cy3),避光、室温孵育30 min;PBS洗3次;Hoechst染核、室温避光5 min,丙三醇封片后,倒置荧光显微镜下观察。
2.3 神经球聚集毒性试验将第二代神经球培养3~4 d时,按照神经球密度1×104·mL-1每孔移至96孔板中。给药分组及神经球聚集毒性试验给药分组设计如表 1所示。每孔的培养基与药物体积之和为100 μL。同时,接种3个相同的培养板,每个试验组设置4个复孔,分别于给药后24 h、48 h和72 h时收集50 μL神经球培养液,倒置显微镜下观察神经球聚集情况,采用CCD显微成像系统和Cell Sens standard分析软件,观察和测量每个复孔中5个视野的神经球大小。各给药组数据均以均数±标准差(x±s)表示,给药各组均数均与空白对照组比较,P<0.05表示两组比较差异显著,P<0.01表示两组比较差异非常显著。
|
|
表 1 神经球聚集毒性试验给药分组设计 |
第二代神经干细胞培养4~6 d左右再次形成神经球,将神经球和培养基的混合液按照每孔750μL体积接种到12孔培养板中,培养次日进行给药。给药分组情况与神经球聚集毒性试验给药分组设计相同。给药后的每孔溶液终体积为1 mL。
按照Click-iT® EdU Alexa Fluor® 488 Flow Cytometry Assay Kit的操作规程进行试验:(1)应用EdU标记神经干细胞:在超净台内进行操作,神经干细胞在给药24 h后,每孔加入1μL的10 mM EdU溶液、混匀,使得10 mM EdU溶液与培养基的稀释比例为1:1000(10 μM)。将加入EdU的培养板再次放入37℃培养箱中孵育2 h。取出后采用机械分离法将神经球打散成单细胞悬液,移入流式管,1000 rpm·min-1离心3 min,弃上清液。(2)固定和渗透:用3 mL含1%胎牛血清的PBS洗涤细胞一次,1000 rpm·min-1离心3 min,弃上清液。向沉淀中加入100 μL Click-iT固定剂,并充分混匀。室温下,避光孵育细胞15 min。用3 mL含1%胎牛血清的PBS洗涤细胞,1000 rpm·min-1离心3 min,弃上清液。将沉淀细胞重悬于100μL Click- iT渗透洗涤剂中,并充分混匀,孵育15 min。(3)Click-iT反应:每个样本中加入0.5 mL的Click-iT反应试剂,充分混匀。反应混合物在室温下避光孵育30 min。用3 mL Click-iT渗透洗涤剂洗涤一次,1000 rpm·min-1离心3 min,弃上清液。加入400~500μL的Click-iT渗透洗涤剂重悬细胞,流式细胞仪上进行分析。上机前,将较大的、没有充分分离的神经干细胞球过滤。每份样品收集5000个左右的细胞,用紫外发射滤光片(450/400 nm)405 nm激发荧光检测EdU的表达。
数据均以均数±标准差(x±s)表示,两组数据的比较采用单因素方差分析法,设定P<0.05为差异显著,P<0.01为差异非常显著。
3 结果 3.1 SD大鼠神经干细胞培养第一代分离培养的神经干细胞,在培养7 d时聚集成折光性较好的神经干细胞球(见图 1-A)。如果培养时间过长,神经球聚集过大,中心部分的神经干细胞会因为缺乏营养而发生坏死,呈深色(见图 1-B),外周神经干细胞会交错成神经网络不易在传代时将神经球吹打为单细胞悬液。本研究中,调整神经球的培养密度为1×104·mL-1,神经球大小均值为1500 μm2,此时的神经球在毒理学试验中能维持较好的神经干细胞活力。当神经球贴壁后,神经干细胞不断由中心向外生长延伸,胞体呈多边形、较小,突触短而不明显。抗Nestin抗体鉴定神经干细胞为阳性。如图 1-C及图 1-D所示。
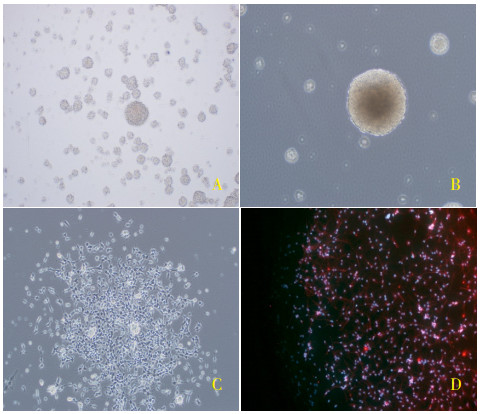
|
图 1 神经球和神经干细胞形态学观察及鉴定 注:A:悬浮生长的神经球(100×);B:聚集过大的神经球中心位置细胞呈深色(100×);C:神经球/神经干细胞贴壁生长(100×);D:抗Nestin抗体标记神经干细胞呈阳性(200×) |
神经球聚集毒性实验结果如表 2和图 2所示。A长春新碱从给药24 h起即可引起神经球解离、破碎、神经干细胞坏死;B顺铂具有显著的抑制神经球生长作用;C瑞芬太尼未见明显神经球聚集毒性作用;D氧化铁纳米粒子、E丙泊酚和H丙烯酰胺可引起神经球解离、破碎、神经干细胞坏死;F丙戊酸钠、G苯妥英钠具有显著的抑制神经球生长作用。神经生长因子促进神经球聚集;I乙醇未见明显神经球毒性作用。试验结果表明神经球聚集毒性指标适用于评价顺铂、丙戊酸钠和苯妥英钠药物的抑制神经球生长毒性作用;而长春新碱、氧化铁纳米粒子、丙泊酚和丙烯酰胺的细胞毒性作用较强,可选用检测细胞毒性的指标进行评价。
|
|
表 2 神经球聚集/毒性作用观察结果 |
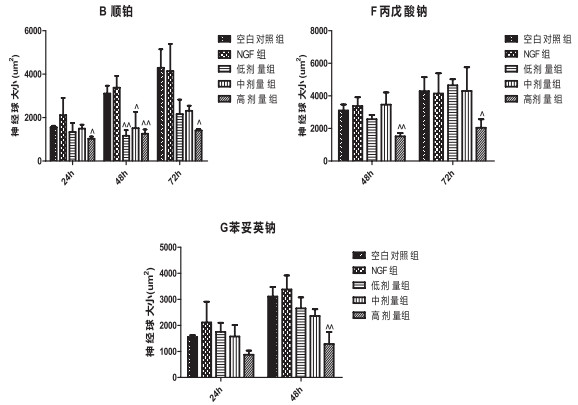
|
图 2 神经球聚集/毒性试验结果显著性差异分析 注:数据为均数±标准差(x±s), n=4;^表示与空白对照组相比有显著性差异(P < 0.05);^^表示与空白对照组相比有极显著性差异(P < 0.01) |
神经干细胞EdU增殖毒性试验结果如图 3所示。在给药24h,A长春新碱、B顺铂、C瑞芬太尼、D氧化铁纳米粒子、E丙泊酚、F丙戊酸钠、G苯妥英钠、H丙烯酰胺、I乙醇均具有抑制神经干细胞增殖作用,且呈剂量相关性。J神经生长因子可见促进神经干细胞增殖趋势。
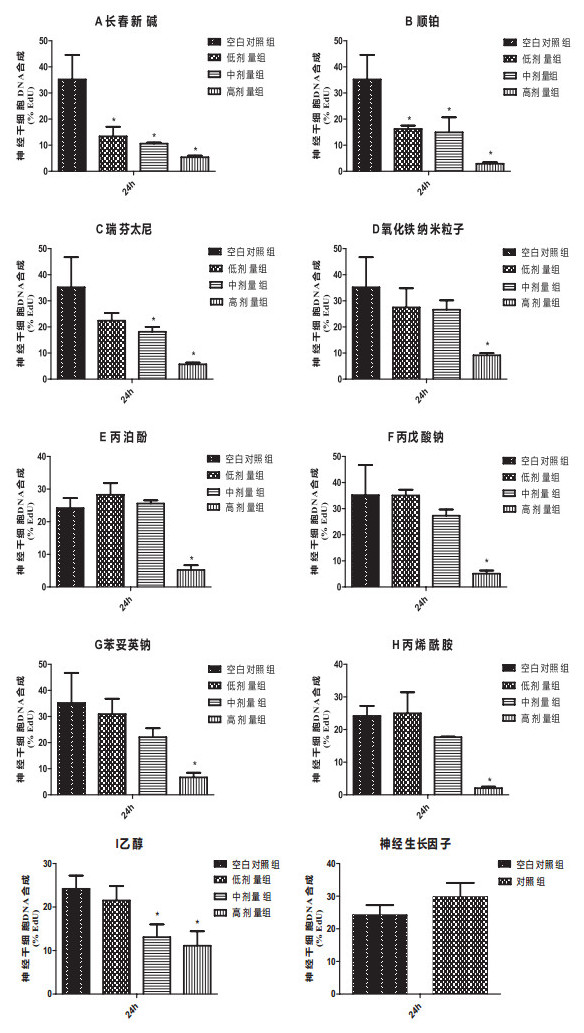
|
图 3 给药24 h神经干细胞增殖毒性作用统计结果 注:数据为均数±标准差(x±s),n=4;*与空白对照组相比有显著性差异(P<0.05);**与空白对照组相比有极显著性差异(P<0.01);NGF:神经生长因子。 |
为了在药物研发早期筛选神经毒物,国内外药物研发企业和监管机构都试图建立一种新的检测策略和方法,目的是能够快速、可靠、减少使用实验动物数来评价药物的神经毒性。随着各种神经干细胞及细胞模型的开发,可实现体外神经毒性和发育神经毒性研究,甚至还能模拟慢性神经毒性研究[14]。本研究中,选用几类已知具有神经毒性和发育神经毒性的药物和化合物,利用SD大鼠神经干细胞模型评价药物对神经球聚集、神经干细胞增殖的毒性作用,以探讨该评价体系的适用性,以及验证评价结果的准确性和敏感性。
神经球聚集毒性试验中,丙戊酸钠和苯妥英钠表现为抑制神经球聚集,该检测终点可有效地评价这两种抗癫痫药物的发育神经毒性作用,但其对神经干细胞的存活并无影响。长春新碱、顺铂、氧化铁纳米粒子、丙泊酚注射液、丙烯酰胺可直接引起神经干细胞凋亡坏死,证明了其较强的神经毒性作用。
本研究应用更加快速、灵敏和准确的EdU细胞增殖毒性检测法评价药物对神经干细胞的增殖毒性作用,能有效地检测处于S期的细胞百分数[15]。在试验设定的3个时间点中给药6 h,各药物剂量组未见明显干细胞增殖毒性。给药48 h,各种药物的中、高剂量组增殖毒性作用较强几乎未检测出细胞增殖率。给药24 h,则表现显著的增殖毒性剂量效应关系,说明给药24 h即为检测药物影响神经干细胞增殖毒性的最佳时间点。试验结果表明长春新碱、顺铂、瑞芬太尼、氧化铁纳米粒子、丙泊酚注射液、丙戊酸钠、苯妥英钠、丙烯酰胺、乙醇均具有剂量相关性的增殖毒性作用。
本研究利用SD大鼠神经干细胞模型验证了10种已知药物的神经毒性作用,结果证明这些药物影响神经球聚集和具有神经干细胞增殖毒性;提示该SD大鼠神经干细胞模型可作为药物神经毒性早期筛选和临床前安全性评价。
| [1] |
Fonck C, Easter A, Pietras MR, et al. CNS Adverse Effects:From Functional Observation Battery/Irwin Tests to Electrophysiology[J]. Handb Exp Pharmacol, 2015, 229: 83-113. DOI:10.1007/978-3-662-46943-9 |
| [2] |
Kaufmann W, Bolon B, Bradley A, et al. Proliferative and Nonproliferative Lesions of the Rat and Mouse Central and Peripheral Nervous Systems[J]. Toxicol Pathol, 2012, 40(4): 87-157. |
| [3] |
Tsuji R, Crofton KM. Developmental Neurotoxicity Guideline Study:Issues with Methodology, Evaluation and RegμLation[J]. Congenit Anom (Kyoto), 2012, 52(3): 122-28. DOI:10.1111/j.1741-4520.2012.00374.x |
| [4] |
Schultz L, Zurich MG, Culot M, et al. Evaluation of Drug-Induced Neurotoxicity Based on Metabolomics, Proteomics and Electrical Activity Measurements in Complementary CNS in Vitro Models[J]. Toxicology in Vitro, 2015, 30(1): 138-165. DOI:10.1016/j.tiv.2015.05.016 |
| [5] |
Wilson MS, Graham JR, Ball AJ. Multiparametric High Content Analysis for Assessment of Neurotoxicity in Differentiated Neuronal Cell Lines and Human Embryonic Stem Cell-Derived Neurons[J]. Neurotoxicology, 2014, 42(5): 33-48. |
| [6] |
Esmaeelpanah E, Razavi BM, Vahdati Hasani F, et al. Evaluation of Epigallocatechin Gallate and Epicatechin Gallate Effects on Acrylamide-Induced Neurotoxicity in Rats and Cytotoxicity in PC 12 Cells[J]. Drug Chem Toxicol, 2017, 26(10): 1-8. |
| [7] |
Radio N, Frank S. Neuronal Cell Morphology in Primary Cerebellar Granule Cells Using High-Content Analysis[J]. Methods Mol Biol, 2018, 1727: 227-237. DOI:10.1007/978-1-4939-7571-6 |
| [8] |
Schultz L, Zurich MG, Culot M, et al. Evaluation of Drug-Induced Neurotoxicity Based on Metabolomics, Proteomics and Electrical Activity Measurements in Complementary CNS in Vitro Models[J]. Toxicology in Vitro, 2015, 30(1): 138-165. DOI:10.1016/j.tiv.2015.05.016 |
| [9] |
Gorba T, Conti L. Neural Stem Cells as Tools for Drug Discovery:Novel Platforms and Approaches[J]. Expert Opin Drug Discovery, 2013, 8(9): 1083-1094. DOI:10.1517/17460441.2013.805199 |
| [10] |
Bal-Price A, Lein PJ, Keil KP, et al. Developing and Applying the Adverse Outcome Pathway Concept for Understanding and Predicting Neurotoxicity[J]. Neurotoxicology, 2017, 59(5): 240-255. |
| [11] |
OECD. [ENV/JM/MONO(2017)4] Report of the OECD/EFSA Workshop on Developmental Neurotoxicity (DNT): The Use of Non-Animal Test Methods for Regulatory Purpose[S]. 2017.
|
| [12] |
Valdiglesias V, Kilic G, Costa C, et al. Effects of Iron Oxide Nanoparticles:Cytotoxicity, Genotoxicity, Developmental Toxicity, and Neurotoxicity[J]. Environ Mol Mutagen, 2015, 56(2): 125-48. DOI:10.1002/em.v56.2 |
| [13] |
Wang Q, Song YH, Tang Z, et al. Effects of Ganglioside GM1 and Neural Growth Factor on Neural Stem Cell Proliferation and Differentiation[J]. Genet Mol Res, 2016, 15(3): 1-8. |
| [14] |
Schmidt BZ, Lehmann M, Gutbier S, et al. In Vitro Acute and Developmental Neurotoxicity Screening:An Overview of Cellular Platforms and High-Throughput Technical Possibilities[J]. Arch Toxicol, 2017, 91(1): 1-33. DOI:10.1007/s00204-016-1805-9 |
| [15] |
罗涛, 王彤敏, 李力燕. EdU与BrdU在检测细胞增殖中的特点及应用进展[J]. 重庆医学, 2015, 32(44): 4581-4583. |
 2018, Vol. 32
2018, Vol. 32 


