单抗稳定性研究是贯穿于整个药品研发、临床试验、药品上市及上市后研究的重要内容,是药品储存条件、有效期等的设定依据,也是对产品生产工艺、制剂处方、包装材料等的适用性进行判断的参考,同时也是产品质量标准制订的基础[1-2]。在单抗稳定性研究中,单抗分子往往会发生聚集,形成由小而大的不同粒径级别的聚体,这些聚体是产品相关杂质,具有潜在的免疫原性[3-6]。目前,没有一种方法可以将纳米到微米、甚至毫米级别的蛋白聚体全部表征出来,往往需要采用多种方法联合应用,才能全面表征蛋白聚体的形成和分布。
不同检测方法有各自的优劣,SEC-HPLC由于其所使用的流动相温和,能保持抗体的天然构象,常被用于表征单抗二聚体/寡聚体的占比[7-8],这是从纳米级别表征单抗的纯度及聚体形成情况,不过由于方法本身的操作方法和分辨率等因素,可能会低估蛋白聚体的占比[9]。MDI技术则是对微米级别的不溶性微粒进行拍摄,并可通过多种参数对微粒的性质进行分析判断,进而提示微粒的来源[10-11],但该方法只能从形态上对微粒进行分类,并报告不同粒径大小和微粒类别的绝对计数,不能报告其在所有蛋白分子中的占比。通过目视法对澄清度和可见异物进行检查是一种简单的检测手段,对大量蛋白聚体的产生具有一定的提示价值,但灵敏度有限[11]。本文以抗TNFα单抗为例,采用上述四种方法对蛋白聚体进行分析,显示了该单抗在稳定性研究中某一时间点的蛋白聚体形成情况,综合分析后判断该样品在稳定性研究中已产生较大的蛋白聚体,避免了仅采用某一方法对样品真实状态的估计不足,降低安全风险。
1 材料和方法 1.1 样品本文所采用的抗TNFα单抗为本室留样,规格为40 mg,0.8 mL,剂型为预充式注射剂。三种储存条件分别为4℃ 6个月,37℃和6000 lx光照储存28 d。
1.2 主要仪器Waters ACQUITY Arc系统;美国Fluid Imaging公司亚可见微粒成像系统FlowCAM®VS-1;天大天发科技有限公司YB-2型澄明度检测仪。
1.3 检测方法 1.3.1 SEC-HPLC采用Waters ACQUITY Arc系统、TSK3000SWXL 7.8×300 mm凝胶色谱柱,流动相为0.l mol· L-1磷酸氢二钠、0.l mol· L-1磷酸二氢钠、0.l mol· L-1硫酸钠缓冲液,pH6.7,柱温25℃±0.5℃,流速为1 mL·min-1,检测波长为214 nm。用流动相将供试品稀释至1 mg·mL-1,并用流动相作为空白对照,上样量为10 μL,每个样品重复检测3次。
1.3.2 MDI采用美国Fluid Imaging公司亚可见微粒成像系统FlowCAM®VS-1,系统主要参数设定如下:流通池采用FC100,物镜放大倍数为10倍,上样量为200 μL,测试流速为0.1 mL·min-1,拍照频率为每秒22帧,每个样品重复检测3次。
1.3.3 一般检查澄清度检查时,将样品分别置于比浊用玻璃管中,在暗室内垂直置于伞棚灯下,照度为l000 lx,从水平方向观察、比较。可见异物检查时将样品转移至洁净透明的玻璃管中,置伞棚灯遮光板边缘处,照度为l000 lx,轻轻旋转和翻转容器使样品中可能存在的可见异物悬浮,并避免产生气泡,分别在黑色和白色背景下于明视距离重复观察,总检查时限为20 s。
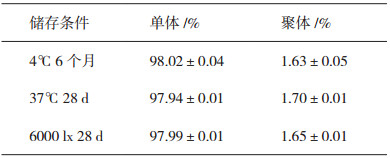
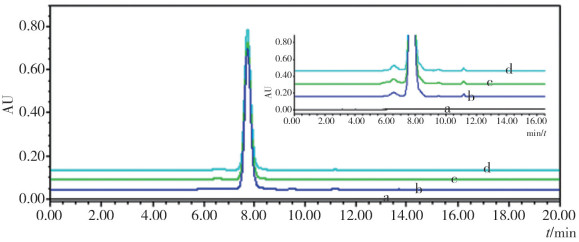
2 结果 2.1 SEC-HPLC检测结果SEC-HPLC因方法简便、快捷、重现性好,常被用于单抗聚体的检测,反映纳米级别蛋白分子的大小变异体。采用SEC-HPLC检测在4℃储存6个月,37℃和6000 lx照度储存28 d后,抗TNFα单抗其单体、聚体的含量占比情况,如表 1所示。结果与4℃储存6个月的抗TNFα单抗结果相比,37℃或6000 lx照度储存28 d后,聚体含量仅有略微增加,但均不具有显著性差异。图 1显示了三种储存条件下抗TNFα单抗的SEC-HPLC代表性图谱。
|
|
表 1 三种储存条件下抗TNFα单抗的SEC-HPLC检测结果(x±s,n=3) |
|
图 1 三种储存条件下抗TNFα单抗的SEC-HPLC图谱 注:a.空白对照;b. 4℃ 6个月;c. 37℃ 28 d;d. 6000 lx照度28 d |
MDI法可检测单抗药物中微米级的不溶性微粒,它可以将微粒拍摄成像,进而通过参数分析判断样品中微粒的性质和来源。该方法的检测灵敏度高于《中国药典》(2015年版)不溶性微粒的检测方法光阻法,故目前常用于单抗药物的不溶性微粒研究,也常用于单抗药物的配方筛选及稳定性研究。采用MDI法比较抗TNFα单抗分别在4℃储存6个月,37℃和6000 lx照度储存28 d后,总微粒及其中蛋白聚体的产生情况。结果见表 2所示。
|
|
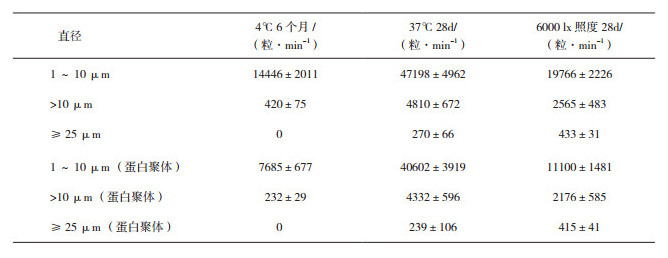
表 2 MDI法检测抗TNFα单抗不同储存条件下不溶性微粒及蛋白聚体(x±s,n=3) |
从表 2中可以看出,抗TNFα单抗在经37℃储存或6000 lx光照28 d后,1~10 μm、>10 μm及≥25 μm粒径范围内颗粒数量比4℃储存6个月均明显增加。利用Flowcam Visual Spreadsheet软件去除非蛋白类颗粒,我们发现4℃储存的样品中颗粒数量大大降低,6000 lx光照28 d后的样品中1~10 μm的颗粒数量也大幅减少,说明该条件下的颗粒主要为硅油等非蛋白聚体,对于预充式注射器剂型来说,是一种常见的现象[12-13]。而经37℃储存28 d的样品,颗粒数量仅略有降低,说明样品中增加的颗粒多为蛋白聚体。更进一步分析发现,6000 lx光照28 d后的样品在1~10 μm、>10 μm粒径上的蛋白聚体比37℃储存28 d的样品少,而≥25 μm粒径的微粒则比37℃储存的样品中明显增多,说明37℃储存易导致<25 μm粒径的蛋白聚体产生,光照条件更易在该样品中产生≥25 μm粒径的蛋白聚体,这可能是由于光照使更多硅油从注射器内表面脱落到单抗液体中,作为核心,引发了较大蛋白聚集的产生。
2.3 澄清度和可见异物检查结果我们还采用目视法对三种储存条件下的抗TNFα单抗进行了澄清度和可见异物检查。澄清度是单抗药物分子对光的散射特性的反映,它是从纳米至微米级别提示样品中较宽粒径范围的蛋白聚集体的形成。可见异物检查是对50 μm以上的颗粒进行识别的一种检查方法,可发现较大的异物,是单抗药物的一种基本的筛查手段。澄清度检查结果显示,样品在37℃储存和6000 lx光照28 d后澄清度要低于4℃储存6个月的样品。三种储存条件下的抗TNFα单抗中均未发现可见异物。
2.4 检测结果总结我们将4种分析方法对三种储存条件下的抗TNFα单抗检测结果进行了汇总,结果见下表 3。
|
|
表 3 四种分析方法对两种不同储存条件下的抗TNFα检测结果汇总 |
SEC-HPLC可高效、快捷地检测单抗药物的聚体含量,已广泛用于单抗等生物制品的质控分析,本试验发现,与4℃储存6个月相比,不管抗TNFα单抗在37℃储存28 d还是在6000 lx光照条件下储存28 d,其聚体增加都不明显;而MDI方法则显示在两种条件下,均检测到大量微米级蛋白聚体。从这两种方法的检测结果可见,由于不同方法原理不同、各有侧重,所检测到的单抗药物中纳米级蛋白聚体与微米级蛋白聚体的结果并不平行,造成这种结果的原因可能为以下几种:(1)由于蛋白聚体的形成是可逆的,SEC-HPLC检测时对样品进行了前处理,如稀释,导致不稳定的纳米级蛋白聚集体发生了解离。(2)对于该抗TNFα单抗来讲,可能37℃储存或在6000 lx光照28 d后,已经产生了大量微粒级蛋白聚体,且这些颗粒已达到饱和,故而抑制了纳米级蛋白分子的进一步聚集,也会出现上述结果。(3)较大的蛋白聚体也有可能被截留在色谱柱外或色谱柱的凝胶中,并不能通过该方法得到有效展示[14]。(4)此外,本试验中的SEC- HPLC采用紫外检测器,该检测器的分辨率有限,可能使聚体得不到有效分离,如果同时采用其他检测器如动态光散射检测器,则可能显示出更佳的分离效果[8, 15-16]。鉴于以上发现,由于SEC-HPLC反映的是纳米级蛋白聚体的百分含量,而MDI反映的是微米级蛋白聚体的绝对数量,二者的原理和方法均不相同,结果也不能简单相比,故结合起来分析更有助于对稳定性研究中样品各粒径级别蛋白聚体真实状态的全面评估。
本试验还采用目视法对澄清度和可见异物进行了检查,这两种检查与MDI一样,均为原倍检测,是对样品原始状态进行分析评价。澄清度是对样品中蛋白分子的浓度与体积的反映,蛋白浓度越高,分子体积越大,澄清度越低,不过澄清度检查并不能对各粒径级别的蛋白聚体分别进行定量。检测结果显示,37℃储存和6000 lx光照28 d后,样品的澄清度要低于4℃储存6个月的样品,由于三者蛋白浓度相同,说明有较多蛋白聚体产生,导致澄清度下降。这一结果与MDI法所提示的信息相吻合,说明虽然37℃储存和6000 lx光照28 d产生<25 μm与≥25 μm的蛋白聚体的能力不同[17],但这两种粒径的蛋白聚体均能导致澄清度降低。可见异物检查是对单抗药物的一项基本检查,可对50 μm以上的异物进行识别,该检查简单易行,但并不能判断异物的性质是否为蛋白。检测并未发现三种储存条件的抗TNFα单抗含有可见异物,说明不管37℃储存还是在6000 lx光照后的样品,其中的蛋白聚体并未聚集成50 μm以上的不溶性可见颗粒[18]。
从上述分析可见在单抗的稳定性研究中,将不同方法的检测结果结合起来分析是必要的,可以避免单一方法的局限性,并能相互印证,获得更多信息[19-21]。本文以抗TNFα单抗为例,发现尽管用SEC-HPLC方法并未检出在高温和光照处理后的样品中检出蛋白聚体的明显增加,但MDI法却检出较多蛋白聚体,澄清度检查的结果也印证了这一点,说明该样品对温度和光照较为敏感。稳定性研究过程中不同时间点的动态监测结果怎样,这些新增的蛋白聚体是否为可逆聚集,在给药环节能否重新解聚为单体,是否会降低药物安全性和有效性,值得我们进一步研究。
| [1] |
Manning MC1, Chou DK, Murphy BM, et al. Stability of Protein Pharmaceuticals:an Update[J]. Pharm Res, 2010, 27(4): 544-575. DOI:10.1007/s11095-009-0045-6 |
| [2] |
Young BL, Khan MA, Chapman TJ, et al. Evaluation of the Physicochemical and Functional Stability of Diluted REMSIMA(R) upon Extended Storage——A Study Compliant with NHS (UK) Guidance[J]. International journal of pharmaceutics, 2015, 496(2): 421-431. DOI:10.1016/j.ijpharm.2015.10.016 |
| [3] |
Rosenberg AS. Effects of Protein Aggregates:An Immunologic Perspective[J]. The AAPS journal, 2006, 8(3): E501-E7. DOI:10.1208/aapsj080359 |
| [4] |
Wang W, Singh Sk Fau, Li N, et al. Immunogenicity of Protein Aggregates-Concerns and Realities[J]. International journal of pharmaceutics, 2012, 431(1-2): 1-11. DOI:10.1016/j.ijpharm.2012.04.040 |
| [5] |
Ratanji KD, Derrick JP, Dearman RJ, et al. Immunogenicity of Therapeutic Proteins:Influence of Aggregation[J]. Journal of immunotoxicology, 2014, 11(2): 99-109. DOI:10.3109/1547691X.2013.821564 |
| [6] |
Freitag AJ, Shomali M, Michalakis S, et al. Investigation of the Immunogenicity of Different Types of Aggregates of a Murine Monoclonal Antibody in Mice[J]. Pharm Res, 2015, 32(2): 430-444. DOI:10.1007/s11095-014-1472-6 |
| [7] |
Uversky VN. Use of Fast Protein Size-exclusion liquid Chromatography to Study the Unfolding of Proteins which Denature through the Molten Globule[J]. Biochemistry, 1993, 32(48): 13288-13298. DOI:10.1021/bi00211a042 |
| [8] |
Fekete S, Beck A, Veuthey JL, et al. Theory and Practice of Size Exclusion Chromatography for the Analysis of Protein Aggregates[J]. Journal of pharmaceutical and biomedical analysis, 2014, 101: 161-73. DOI:10.1016/j.jpba.2014.04.011 |
| [9] |
Kraus BR, Raso C. Rational Boundaries for SEC Cost-Benefit Analysis[J]. Social Science Electronic Publishing, 2012, 30: 273-279. |
| [10] |
Sharma DK, King D, Oma P, et al. Micro-flow Imaging:Flow Microscopy Applied to Sub-visible Particulate Analysis in Protein Formulations[J]. The AAPS journal, 2010, 12(3): 455-464. DOI:10.1208/s12248-010-9205-1 |
| [11] |
Narhi LO, Jiang Y, Cao S, et al. A Critical Review of Analytical Methods for Subvisible and Visible Particles[J]. Curr Pharm Biotechnol, 2009, 10(4): 373-381. DOI:10.2174/138920109788488905 |
| [12] |
Strehl R, Rombach-Riegraf V, Diez M, et al. Discrimination between Silicone Oil Droplets and Protein Aggregates in Biopharmaceuticals:A Novel Multiparametric Image Filter for Sub-visible Particles in Microflow Imaging Analysis[J]. Pharm Res, 2012, 29(2): 594-602. DOI:10.1007/s11095-011-0590-7 |
| [13] |
Gerhardt A, McGraw NR, Schwartz DK, et al. Protein Aggregation and Particle Formation in Prefilled Glass Syringes[J]. Journal of pharmaceutical sciences, 2014, 103(6): 1601-1612. DOI:10.1002/jps.23973 |
| [14] |
Telikepalli SN, Kumru OS, Kalonia C, et al. Structural Characterization of LgG1 mAb Aggregates and Particles Generated under Various Stress Conditions[J]. Journal of pharmaceutical sciences, 2014, 103(3): 796-809. DOI:10.1002/jps.23839 |
| [15] |
Panchal J, Kotarek J, Marszal E, et al. Analyzing Subvisible Particles in Protein Drug Products:a Comparison of Dynamic Light Scattering (DLS) and Resonant Mass Measurement (RMM)[J]. The AAPS journal, 2014, 16(3): 440-451. DOI:10.1208/s12248-014-9579-6 |
| [16] |
Ball S. The Benefits of Multi-Detector SEC for Protein Analysis[J]. Spectroscopy, 2015, 11(3): 125-127. |
| [17] |
Joubert MK, Luo Q, Nashed-Samuel Y, et al. Classification and Characterization of Therapeutic Antibody Aggregates[J]. The Journal of biological chemistry, 2011, 286(28): 25118-25133. DOI:10.1074/jbc.M110.160457 |
| [18] |
Zolls S, Gregoritza M, Tantipolphan R, et al. How Subvisible Particles Become Invisible-relevance of the Refractive Index for Protein Particle Analysis[J]. Journal of pharmaceutical sciences, 2013, 102(5): 1434-1446. DOI:10.1002/jps.23479 |
| [19] |
Yoshino T, Ishikawa T, Ishihara T, et al. Evaluation of the Aggregation States of Monoclonal Antibodies by Diverse and Complementary Methods[J]. Biol Pharm Bull, 2011, 34(8): 1273-1278. DOI:10.1248/bpb.34.1273 |
| [20] |
Filipe V, Hawe A, Carpenter JF, et al. Analytical Approaches to Assess the Degradation of Therapeutic Proteins[J]. Trac Trends in Analytical Chemistry, 2013, 49(3): 118-125. |
| [21] |
Thiagarajan G, Semple A, James JK, et al. A Comparison of Biophysical Characterization Techniques in Predicting Monoclonal Antibody Stability[J]. mAbs, 2016, 8(6): 1088-1097. DOI:10.1080/19420862.2016.1189048 |
 2018, Vol. 32
2018, Vol. 32