藏药莪大夏的基源药材是镰形棘豆、轮叶棘豆以及小叶棘豆,其中,以镰形棘豆为主要药材来源。镰形棘豆为豆科棘豆属植物镰形棘豆Oxytropisfalcate Bunge的干燥全草,每年五至七月份花期旺盛时采挖,洗去泥土,除去枯叶及根须,用棒砸碎,以纸遮蔽,晒干即可;藏药称之为“莪大夏,达夏,大夏”,它收载于《中华人民共和国卫生部药品标准》藏药(第一册)。镰形棘豆主要分布于我国西部地区海拔2700~4300 m的沟谷、河滩、沙地和草甸,是青藏高原常用的民间草药,因其药效广泛,有“草药之王”之称。该药性寒、味辛,归肺、脾经,有小毒,具有解毒生肌、止血通便等功效。内服用于流行性感冒、扁桃体炎、气管炎、便秘、高烧、出血等症,外敷用于创伤、肿痛、骨折,民间多用于刀伤[1]。镰形棘豆是多种复方藏药制剂的主要组成药材,为更好地开发、利用镰形棘豆,本文就近年来对镰形棘豆的化学成分、质量控制、制剂及其临床应用、药理作用等研究情况进行综述。
1 化学成分 1.1 黄酮类现代研究表明:黄酮类化合物是莪大夏的主要化学成分,在该植物中所占比例较高。已发现的黄酮类成分主要为黄酮苷、黄酮、二氢黄酮、二氢查耳酮、黄酮醇、查耳酮、异黄烷及黄烷酮等[2-3]。
1.2 生物碱类生物碱类是莪大夏中抗肿瘤的主要活性成分,主要集中于正丁醇萃取部分,按其基本结构可以分为喳诺里西咤类、叫垛里西咤类、有机酞胺类和吗啡烷类等[2, 4]。
1.3 微量元素杨光明等[5]运用电感藕合等离子体原子发射光谱法测定莪大夏及其炭品水煎液中砷、锌、铅、钻、锅、铁、锰、铬、镁、铜、钙11种微量元素的含量,结果发现莪大夏制炭后钙元素的含量显著提高,而其他10种微量元素的含量均有不同程度的降低。
1.4 挥发性成分王栋等[6]通过水蒸气蒸馏、超临界CO萃取和顶空萃取3种方法,并利用气相色谱和气相色谱-质谱联用技术分析藏药莪大夏中的挥发性成分,共鉴定出58个化合物,其中烷烃类和醛类化合物为主要挥发性成分,分别占71.0%和84.5 %。郑尚珍等[7]采用GC-VIS联用方法对莪大夏的精油化学成分进行了研究,共鉴定出57个成分,精油总量达3.8%。
1.5 其他类成分莪大夏中还含有很多其他化合物,如β-族类化合物,包括胡萝卜苷。
2 莪大夏质量控制 2.1 总黄酮和总酚含量的检测莪大夏黄酮类成分和多酚类成分具有较好的抗炎和抗氧化作用。总黄酮的测定一般采用NaNO2-Al(NO3)3-NaOH比色法,但文献报道,此反应对以鼠李柠檬素为代表的黄酮类化合物会显假阴性。李茂星等[8]建立了以芦丁为对照品,30 g·L-1二氯氧锆为显色剂,样品经2.5 mol·L-1盐酸甲醇溶液在摄氏90℃水解30 min后于波长453 nm处测定莪大夏总黄酮的方法,测得水提取物中总黄酮含量为5.79%。目前,对莪大夏所含的酚类化合物报道较少。李茂星等人的方法简便易行、灵敏、准确、精密度高、稳定性好、重复性强,可为莪大夏总黄酮和总酚的进一步开发应用提供参考。
2.2 总生物碱含量的检测莪大夏总生物碱具有明显的抗肿瘤活性,因此,建立总生物碱的含量测定方法对莪大夏和其制剂的质量评价、药理作用研究显得尤为重要。由于所含生物碱无紫外吸收,检测难度大,相关报道很少。顾青等[9]采用溴麝香草酚蓝酸性染料比色法,以野决明碱为对照品,于最大吸收波长413 nm处测定青海、西藏、甘肃3个不同产地和不同批号的莪大夏总生物碱含量,其中,青海药材总生物碱含量最高,约为0.1 mg·g-1。
2.3 黄酮单体成分检测高效液相色谱法具有分析速度快、检测灵敏度高的特点,已被广泛用于莪大夏黄酮类单体成分的定量检测。袁涛等[10]采用HPLC法测得3批莪大夏药材中2',4'-二羟基查耳酮的平均含量为0.64%。姜华等[11]采用HPLC法测出5批莪大夏药材中鼠李柠檬素的平均含量为0.39%。朱建明等[12]采用HPLC法同时测定6批莪大夏中2',4'-二羟基查耳酮和鼠李柠檬素的含量,结果两者含量分别为0.63 mg·g-1、3.65 mg·g-1。另外,侯丰灏等[13]采用RP-HPLC测定出莪大夏中球松素的含量为0.16%。上述成分的定量分析研究为制订莪大夏质量标准提供了可靠依据。
2.4 指纹图谱分析由于指纹图谱能全面反映药物内在化学成分的种类与数量,在评价药物真实性、稳定性和有效性方面具有很大优势。为全面控制莪大夏质量,燕珂等[14]对10批莪大夏药材进行了高效液相分析,建立了其高效液相色谱指纹图谱,经相似度评价共得到8个特征峰,特征峰的相对峰面积积分比值差别较大,基本反映了莪大夏药材的内在化学特征,但是,8个特征峰所对应的具体化学成分有待进一步研究。
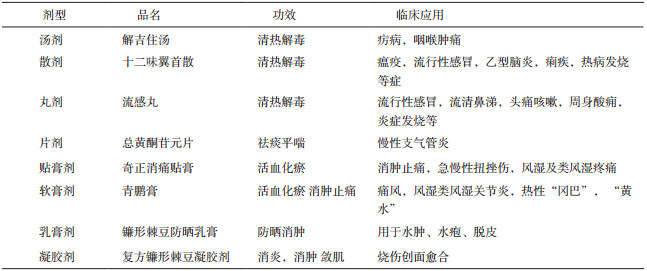
3 制剂及其临床应用莪大夏在临床上主要与其他药物配伍应用,文献中很少报道其单味药制剂;目前,含莪大夏的制剂及其临床作用如表 1所示。
|
|
表 1 莪大夏在临床上主要与其他药物的配伍应用 |
近年来,莪大夏的药理作用研究逐年增加,主要集中在总黄酮及其单体的抗炎、抗氧化、镇痛、抗肿瘤、糖尿病等方面,以及生物碱抗肿瘤等方面的研究。
4.1 抗炎、镇痛、祛痰作用莪大夏对急性和慢性炎症都有较好的作用,其抗炎药理作用已经得到了认可。古秋莉等[15]研究发现,莪大夏总黄酮苷元可通过促进大鼠肾上腺皮质激素分泌而起到抗炎、祛痰的作用。抗炎与镇痛作用往往是相互联系的,莪大夏醇提物和水提物能明显抑制小鼠二甲苯引起的耳肿胀,能抑制鸡蛋清引起的大鼠足肿胀,显著减少醋酸引起的小鼠扭体次数;莪大夏鼠李柠檬素也具有同样的抗炎作用。另外,顾鹏程等[16]研究发现,在热刺激模型(热板法)和化学刺激模型(醋酸扭体法和福尔马林法)中,莪大夏对热板实验中的小鼠舔足或跳离时间影响不大,对化学刺激引起的疼痛具有显著效果。这些研究都表明莪大夏对炎症和疼痛的抑制作用。此外,姜华等[17]研究报道了莪大夏具有一定的平喘作用,在离体豚鼠空肠上具有抗乙酰胆碱的作用,在离体豚鼠气管上总黄酮苷元具有抗组胺的作用。
4.2 抗氧化作用莪大夏属于高原植物,对强紫外线具有较强的耐受作用,具有较好的抗氧化作用。以莪大夏总黄酮为物质基础的霜剂对急性紫外线损伤大鼠的皮肤组织具有较好的修复作用。林小凤等[18]体外研究表明:莪大夏总黄酮具有羟自由基清除能力、DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除作用,以及具有还原能力,且有一定的剂量依赖性。扎西东主等[19]研究报道:在D-半乳糖致亚急性衰老小鼠抗氧化试验中,以莪大夏总黄酮提取物连续灌胃70d后,小鼠血浆、心脏和肝脏中的丙二醛含量显著降低,超氧化物歧化酶和谷胱甘含量显著升高,表明莪大夏总黄酮在抗氧化、抗衰老方面具有显著作用。
4.3 对循环系统的作用研究发现,莪大夏对循环系统具有有益的药理作用。魏学红等[2]在离体心脏冠脉灌流试验中,莪大夏总黄酮苷元能够抑制心脏收缩力,增加心脏灌流量;对在体心脏可产生心脏收缩短暂加强或抑制减弱的作用。在小鼠止血试验中,莪大夏总提取物能够明显缩短小鼠出、凝血时间。此外,莪大夏药效筛选试验显示:对凝血酶原时间和血浆复钙时间具有明显缩短的药效部位正是正丁醇提取部位和水溶性部位。此外,文献研究记载莪大夏粉末撒疮生新肌、去骨结、内服涩脉止血功效。
4.4 免疫调节、抗肿瘤作用汪云峰等[20]将莪大夏煎液给小鼠灌胃后,油镜下观察腹腔渗液瑞氏染片,计数已吞噬红细胞的巨噬细胞,发现其能够明显促进巨噬细胞的吞噬功能。同时,2,4-二硝基氯苯皮肤试验和植物血凝素皮肤试验中发现,莪大夏煎液对细胞免疫具有抑制作用。顾青等[21]在抗肿瘤研究方面,发现莪大夏黄酮类化合物对人癌细胞株SMMC-7721、HeLa、A549、MGC-803、MDA-MB-231、LOVO的增殖具有不同程度的抑制作用。此外,杨光明等[22]采用莪大夏总生物碱进行体内抗肿瘤试验中,通过观察S180荷瘤小鼠模型体质量、抑瘤率、胸腺指数和脾指数,发现小鼠没有出现任何毒性反应,体质量未降低,显示其有明显的抗肿瘤作用。
5 结论近年来,人们对莪大夏的化学成分、药理作用和临床应用等方面都做了大量的研究工作,为科学地开发莪大夏资源奠定了良好的基础,但仍有较多科学问题值得我们深入研究。首先,藏药莪大夏质量受气候、生态环境、产地、采收期和加工炮制方法等多种因素的影响,虽有较多文献报道不同产地或批次莪大夏的质量存在较大差别,但均未深入研究该差别的形成原因。因此,需要积极探求莪大夏的质量和生态环境的相关性,寻找其道地性的形成规律和优质品种,并建立一种能够快速鉴别该药材真伪和质量优劣的检测方法,从而推进藏药产业的健康发展。其次,莪大夏的现行药材标准收载于《中华人民共和国卫生部药品标准》,仅对莪大夏的基源、性状等做了描述,无理化鉴别和含量测定项,对药材质量的可控性较差,其质量标准需进一步修订完善。最后,目前已有学者证实莪大夏中含有毒成分苦马豆素及其类似物,故其毒性量的剂量反应关系、中毒机制、配伍减毒、苦马豆素类似物结构鉴定等诸多问题都是今后待研究的热点。
| [1] |
扎西东主, 李先加, 童丽. 藏药莪达夏概况[J]. 青海医学院学报, 2006, 27(2): 137-138. DOI:10.3969/j.issn.1006-8252.2006.02.021 |
| [2] |
魏学红, 金莉. 藏药镰形棘豆的研究进展[J]. 中国药理学通报, 2010, 26(11): 1535-1538. |
| [3] |
陈晨, 赵静, 冀恬, 等. 微波消解/ICP-MS法测定镰形棘豆中18种元素含量[J]. 分析测试技术与仪器, 2017, 23(3): 171-175. |
| [4] |
詹珺雁, 燕珂, 杨光明, 等. 藏药镰形棘豆总生物碱提取纯化的研究[J]. 西北药学杂志, 2013, 28(6): 551-556. DOI:10.3969/j.issn.1004-2407.2013.06.001 |
| [5] |
杨光明, 戴衍朋, 李强, 等. 电感耦合等离子体原子发射光谱法同时测定镰形棘豆及其炭品中的微量元素[J]. 中华中医药学刊, 2009, 27(12): 2545-2547. |
| [6] |
王栋, 杨欢, 杨光明, 等. 藏药镰形棘豆挥发性成分研究(英文)[J]. 天然产物研究与开发, 2010, 22(4): 614-619. DOI:10.3969/j.issn.1001-6880.2010.04.018 |
| [7] |
郑尚珍, 确生, 许先芳. GC/MS联用法测定镰形棘豆石油醚浸提物的化学成分[J]. 西北师大学报, 2003, 39(2): 51. |
| [8] |
李茂星, 兰芝荟, 樊鹏程, 等. 藏药镰形棘豆的研究进展[J]. 中药材, 2009(08). |
| [9] |
顾青, 蔡银娜, 杨光明, 等. 藏药镰形棘豆的化学成分及其抗肿瘤活性研究[J]. 中国实验方剂学杂志, 2013, 19(11): 72-74. |
| [10] |
袁涛, 王森, 管咏梅, 等. HPLC同时测定奇正消痛贴膏中3种成分的含量[J]. 中国实验方剂学杂志, 2014, 20(19): 72-74. |
| [11] |
姜华, 胡君茹, 刘霞. 镰形棘豆的研究进展[J]. 中草药, 2006, 37(2): 315-316. DOI:10.3321/j.issn:0253-2670.2006.02.061 |
| [12] |
朱建明, 郭敏, 胡君茹, 等. HPLC法同时测定6批莪大夏中2', 4'-二羟基查耳酮和鼠李柠檬素的含量[J]. 中国中医药信息杂志, 2013, 20(6): 50-52. DOI:10.3969/j.issn.1005-5304.2013.06.019 |
| [13] |
侯丰灏, 杨欢, 许慧琴, 等. RP-HPLC分析莪大夏中球松素的含量[J]. 南京中医药大学学报, 2008, 24(3): 171-172. DOI:10.3969/j.issn.1000-5005.2008.03.010 |
| [14] |
燕珂, 顾青, 杨光明, 等. 镰形棘豆HPLC指纹图谱研究[J]. 南京中医药大学学报, 2013, 29(4): 376-380. DOI:10.3969/j.issn.1000-5005.2013.04.021 |
| [15] |
古秋莉, 黄聪琳, 张丽, 等. 镰形棘豆中鼠李柠檬素抗炎作用研究[J]. 中国中医药信息杂志, 2014, 21(12): 48-50. DOI:10.3969/j.issn.1005-5304.2014.12.014 |
| [16] |
顾鹏程, 许惠琴. 镰形棘豆化学成分和药理毒理作用的研究进展[J]. 时珍国医国药, 2009, 20(10): 2549-2550. DOI:10.3969/j.issn.1008-0805.2009.10.084 |
| [17] |
姜华, 张丽, 黄聪琳, 等. 藏药镰形棘豆总黄酮苷元急性毒性实验研究[J]. 西部中医药, 2013, 26(8): 50-52. DOI:10.3969/j.issn.1004-6852.2013.08.018 |
| [18] |
林小凤, 陈开杰, 石鹤坤, 等. 复方镰形棘豆凝胶剂的皮肤安全性评价[J]. 中国医院药学杂志, 2015, 35(5): 449-454. |
| [19] |
扎西东主, 李先加, 等. 藏药莪达夏抗缺氧作用的初步实验研究[J]. 青海医学院学报, 2008(4): 266-267. DOI:10.3969/j.issn.1006-8252.2008.04.016 |
| [20] |
汪云峰, 秦文涛, 刘宗权. 镰形棘豆煎液对细胞免疫的影响[J]. 西南民族大学学报(自然科学版), 1984(4): 9-11. |
| [21] |
顾青, 蔡银娜, 杨光明, 等. 藏药镰形棘豆的化学成分及其抗肿瘤活性研究[J]. 中国实验方剂学杂志, 2013, 29(11): 72-74. |
| [22] |
杨光明, 燕茹, 王兆先, 等. 镰形棘豆提取物抗肝癌的体内外活性研究(英文)[J]. 中国天然药物, 2013, 11(5): 519-525. |
 2018, Vol. 32
2018, Vol. 32