2. 国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室, 北京 100050
2. The Key Laboratory of Biotechnology Product Test Method and Its Standardization, National Health Commission, Beijing 100050, China
自1956年研究人员首次在细胞培养中发现支原体污染以来,支原体污染问题无处不在,包括以细胞为基质生产的生物制品,如病毒性疫苗、重组生物技术产品等[1]。在生物制品生产过程中和细胞培养过程中使用的任何动物源性和植物源性材料(如血清、胰酶等)、无机来源成分、操作环境、操作人员、操作习惯及交叉污染等均是引入支原体污染的途径,支原体污染已经成了各国药品监管机构始终关注的影响生物制品安全性的问题之一[2-7],因此,支原体污染检查也成了生物制品外源因子污染检查的经久不衰的话题,生物源性原材料、采用细胞培养技术制备的疫苗、抗体、基因治疗产品在生产过程的不同阶段都要进行支原体污染的检查。同样,这一要求对目前正处于快速发展期的细胞治疗产品也不例外,正如由我院牵头联合国内CAR-T细胞基础研究及产品研发单位共同完成并发布的《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》(以下简称《要点》)中所述[8],研究者需要在与CAR-T细胞治疗产品相关的多个阶段进行支原体污染的检查,包括有可能引入支原体风险的所有生物源性材料、病毒载体生产细胞、病毒载体、CAR-T细胞产品等,以最大程度地降低CAR-T细胞产品支原体污染的风险,提高产品的安全性。
但由于我国现有药典要求支原体检查方法的检测时间相对较长,不能完全满足CAR-T细胞治疗产品的要求,如新鲜剂型的CAR-T细胞制备后有效期不超过12 h,冻存剂型的CAR-T虽然保存时间可以满足现行药典支原体检查法的要求,但在实际应用中,因CAR-T细胞治疗产品主要用于无现行治疗手段的自体肿瘤患者,从采集患者的初始细胞至临床应用的时间间隔也是非常有限的,因此,很多研发者更倾向于采用支原体污染快速检测方法用于中间品放行检测甚至CAR-T细胞治疗产品的放行检验的补充或替代方法,由此,也带来了另一个药品监管机构所关注的重要安全性问题之一,即所用的方法是否具有与经典方法相同的灵敏度可以满足支原体检查的要求,于是在《要点》中提出“鼓励研究者开发快速的支原体检查法用于中间过程监测或放行检测,但在临床试验过程中必须对快速方法进行充分的验证,验证方法可参考中国药典的相关规定及国际要求,证明所用快速方法的最低检出限至少不能低于药典方法。”本文即就目前我国生物制品支原体污染现状、支原体核酸快速检测方法(以下简称支原体NAT法)的研发现状、国外法规对支原体NAT法的验证要求进行了总结及分析,并就我国目前对支原体NAT法方法学验证的现状提出解决的思路,以期对我国研究者自行建立或评估选用何种支原体核酸扩增检测方法提供借鉴。
1 近年来我国生物制品相关样本支原体污染现状我国自2000年版《中国生物制品规程》增加了支原体检查的DNA染色法后,药典收录支原体检查的法定方法一直都是培养法和DNA染色法。十多年来,我们采用这两种方法分别对不同生产或研发单位送检的多种生物样本进行了支原体检查,包括细胞基质、毒种、干细胞制剂、免疫细胞制剂、生物技术产品的收获液及新生牛血清等,结果显示基本上每年都会发现送检的样本存在支原体污染的问题。2003-2011年,支原体污染率最高达10%以上(如图 1所示);近年来,支原体污染阳性率虽然有所好转,但仍高居外源因子污染的榜首,如近五年DNA染色法检出的支原体污染阳性率约为1%~3%(见图 2),这些样本有的来自于有丰富生产经验的生物制品企业,有的来自于新兴的研发及生产机构,有的来自于新兴治疗领域,如干细胞或免疫细胞研发机构。污染的支原体种类与文献报道的常见支原体污染种类略有不同,排在首位的是猪鼻支原体而不是精氨酸支原体[9],未发现有莱氏无胆甾原体污染,但发现有牛支原体及肺支原体污染。从这些研究数据可以看出,支原体污染风险存在于各个产品领域,包括细胞治疗产品领域,因此,支原体污染检查依然是生物制品安全性的一个重要保障措施。
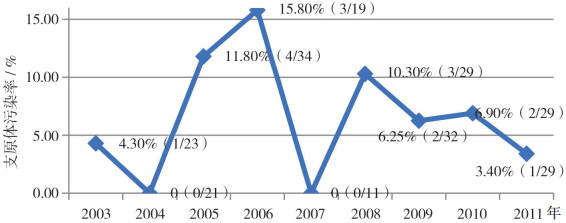
|
图 1 2003-2011年生物制品样本支原体污染情况 |
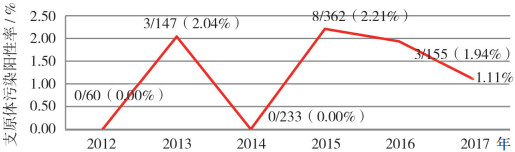
|
图 2 2012-2016年用DNA染色法检测生物制品样本的支原体污染情况 |
支原体现归属于原核生物门柔膜体纳,自1898年法国Nocard及Roux首次分离以来,现种类接近200种,因其基因组中缺乏能量代谢途径中所需的许多重要基因,使得支原体生长对营养的需求较高,有的可在营养丰富的培养基上生长,如肺炎支原体,有的在细胞上生长更好,如猪鼻支原体,有的尚不能培养,如植原体。因此,经典的支原体污染检查需要采用两种方法,即培养法和DNA染色法,这两种方法具有广谱性,可以检出不同生长特性的支原体,这也是我国药典及国际药品监管机构认可的支原体检查方法。通常来说,支原体培养法的灵敏度可达1~10 CFU支原体,DNA染色法的灵敏度至少为100 CFU支原体。
这两种方法检测到的支原体均为活的支原体,也就是说,若检出为阳性,则证明样本中确实有支原体污染,而不仅仅是与支原体相关的遗传物质。但这两种方法也存在一定的局限性:一方面表现为支原体培养法检测所需的时间相对较长,不能满足那些保存有效期短的产品或需要快速放行的中间品,如细胞治疗产品放行或生物技术产品中间品放行等。不论是我国药典规定的液体和半流体培养基接种法,还是美国、欧洲或日本药典规定的液体培养转接固体琼脂培养的方法,基本上都需要28 d;DNA染色法时间虽然稍短,但从指示细胞复苏到完成检测至少也需要14 d,所以对于需要快速放行的样本就存在一定的局限性。另一方面,对可能会引起指示细胞病变的且缺少有效中和抗体的高滴度病毒样本来说,不能采用DNA染色法检测,会影响支原体污染检出的水平;再者,支原体污染检查对操作人员有一定的技术要求,同时,因这两种方法均需要用支原体菌株作为阳性对照,而支原体污染后难以去除,因此,研究者还要对支原体检测实验室设置严格的防止交叉污染的措施等。基于经典方法的这些不足,越来越多的新兴生物技术领域的研发者会更倾向于采用更快速的支原体污染检查方法用于中间品放行检测甚至CAR-T细胞治疗产品的放行检验的补充或替代方法,如各种类型的支原体核酸检测法、DNA芯片法、化学发光法或荧光素酶法等,其中支原体核酸检测方法最为常见,但由此也带来了另一个药品监管机构所关注的重要安全性问题,即所用的检查方法是否具有与经典方法相同的灵敏度,是否可以有效控制支原体污染的风险。
3 支原体核酸检测方法的研究现状支原体核酸扩增检测方法(Nucleic Acid Amplification Techniques,NAT)是通过扩增并检测特定的支原体基因组保守序列来进行支原体污染检测的方法,它具有快速、便捷、受样本类型影响小等特点,已成为实验室检测支原体污染的常用方法。
自1989年Bernet. C等[10]人最早利用传统的PCR技术建立了支原体核酸检测方法以来,支原体NAT法也经过了一个不断发展的过程,目前,国内外已有多种基于NAT原理的支原体检测方法,每种方法均有一定的优点和缺点,下面对其中的几种方法的特点进行简述。
1994年,Wirth. M等[11]人通过比对25种常见支原体的核糖体RNA基因16S序列,建立了一种使用6条上游引物及3条下游引物的支原体多重PCR检测方法。2002年,Uphoff.CC等[12]人使用该方法对319例已知支原体污染阴/阳性样本进行了检测,结果显示与传统支原体检测方法符合率为96%。但多种引物的配比、引物间的竞争及不同引物对靶片段的竞争都可能对试验结果产生影响。
1995年,Pruckler. M等[13]人使用3条针对支原体核糖体16S rRNA的特异性引物建立了半巢式支原体PCR检测方法,并使用该方法对细胞污染常见的14种支原体进行检测,均检测为阳性。尽管巢式PCR法提高了检测的特异性及灵敏度,但是,进行两轮扩增反应无疑增加了试验操作污染的风险,同时也提高了扩增产物对实验室环境的威胁。
2004年,Eldering. A等[14]人针对8种不同类型常见支原体的核糖体16S rRNA基因设计了一对特异性引物并建立了一套基于降落PCR技术的支原体检测方法,通过首轮PCR反应的退火温度高于最佳退火温度,并在之后的循环中使退火温度逐渐降低至最佳退火温度,从而可以有效抑制PCR反应的非特异性扩增,提高反应特异性,同时亦可增强目的片段的竞争,提高反应敏感度。但降落PCR归根到底也仅是对普通PCR的扩增程序进行优化,因此该方法也会存在普通PCR法的一些缺点,如易引起交叉污染、单一对引物能否达到足够的检测范围等问题。
2005年,Saito. R等[15]人针对肺炎支原体P1基因设计了基于环介导等温扩增法(Loop-mediated isothermal amplification, LAMP)的肺炎支原体快速检测方法。灵敏度验证结果显示该法可检出至少200个基因拷贝数的肺炎支原体。特异性验证显示该方法能够检测出3种不同株肺炎支原体,并且对于其它5种不同类型支原体及19种不同类型细菌并未出现非特异性扩增。相较于其它PCR法,LAMP法以检测时间短、操作便捷、不易污染、检测设备要求低等特点成为了临床疾病诊断、食品药品安全检查的常用快速检测方法。但由于其方法需要针对6个不同的特异性核酸序列片段设计4条特异性引物,且目的片段大小及引物结合区域间隔都有限制,因此,在支原体检测中往往只用于单一类型支原体检测。但近年来也有研究者开发了基于此原理的可检测多种支原体的方法。
为提高支原体检出的灵敏度,研究者开发了检测支原体16S rRNA基因转录产物的方法,即RT- PCR法。2009年,Peredeltchouk. M等[16]人使用针对16S rRNA基因的相同引物比较了RT-PCR和PCR的灵敏度,结果显示针对发酵支原体,RT-PCR比PCR检测灵敏度高大约100倍。尽管该方法在理论上能够提高检测方法的灵敏度,但增加的反转录步骤无疑也提高了交叉污染的风险。
2010年,Laborde. S等[17]人针对支原体的16S rRNA基因建立了基于荧光探针的实时定量PCR支原体检测方法。相较于其它PCR方法,荧光定量PCR法可通过分析扩增曲线进行结果判定,具有较好的特异性,及更好的准确性,同时,因其扩增过程为封闭系统可减少试验扩增的核酸产物对实验室环境造成的交叉污染。但是,因荧光定量PCR除上下游引物外,还需设计荧光探针,且该方法扩增的目的片段较小,因此对目的片段的选择更加严格。
不同的支原体核酸检测方法对支原体的最低检出能力不同,如Bernet. C等人报道其所建的传统PCR法可检出100~1000变色单位(CCU)的肺炎支原体;Eldering. A等人报道其建立的降落PCR法可检出10~0.1 CFU·mL-1的支原体,2010年Deutschmann. M等[18]人对该方法的验证结果显示不同支原体最低检出水平可达到10~0.1 CF U·mL-1;Laborde. S等人建立的qPCR法对支原体的最低检出限为10 CFU·mL-1。针对这些不同原理的方法,目前已有多种商品化试剂盒问世,如基于普通PCR法的Sigma公司生产的LookOut® Mycoplasma PCR支原体检测试剂盒、基于qPCR法的TAKARA公司生产的CycleavePCR® Mycoplasma Detection Kit、Applied Biosystems生产的MycoSEQ™ Mycoplasma Detection Kit和Sartorius公司的Microsart ATMP Mycoplasma等。
支原体NAT法虽然具有快速、灵敏、便捷等特点,但是,由于NAT方法检测支原体的能力依赖于扩增引物序列能否包含足够广泛的常见污染支原体以及在生产中可能通过相关动物源材料所引入的支原体类型,且不同的核酸提取方法、扩增反应体系及扩增程序都可能会对阳性样本的检出效率产生影响。另外,因NAT方法检出的是支原体的基因组,无法鉴别样品中的支原体是否存活、是否为支原体相近种属的微生物污染、是否存在环境或试剂中的支原体核酸或质粒污染以及是否存在待检细胞核酸或待检样品中其它成分对扩增反应所引起的抑制。因此,开展充分的支原体NAT法的方法学验证就显得十分必要,其验证结果也是使用者评估及筛选支原体NAT检测试剂的重要参数。
4 国内外法规对使用支原体NAT法的态度尽管研究者开发了多种支原体核酸检测方法,在实验室研究领域内也被广泛采用,但因其方法的局限性,在生物制药领域被药品监管机构接受、而一定程度上作为质控检测方法的时间并不长,且仍持较为谨慎的态度。
WHO于2010年发布的《生物医药产品生产用动物细胞基质的评价及细胞库检定规程》中首次描述了采用NAT法进行支原体污染检查的要求,即“支原体检查的NAT法经过充分的方法学验证并与国家药品监管机构讨论后,单独、与细胞培养法或其它适宜的方法联合使用,有可能会作为一种或两种法定方法的替代方法。这种替代方法需要与法定方法进行可比性研究,包括最低检出限及特异性的可比性,详细内容可参照欧洲药典”[5]。
FDA也是在2010年发布的《传染性疾病病毒性疫苗生产用细胞基质及生物源性材料检定工业指南》中才提出,有某些情况下,如因疫苗病毒无法完全中和而不能采用基于培养的支原体检查方法时,可以使用基于PCR的检测方法,但需要证明这种方法与琼脂和肉汤培养以及DNA染色法具有可比性,且可以将培养法和PCR法联合使用[6]。美国药典41版(USP 41)在支原体检查法一章中也提出,可以使用经过验证的NAT法或依赖酶活性的方法检测支原体,但同样要求新方法要与药典方法有可比性[7]。
在支原体检测的NAT法使用上,欧洲药典的态度更为积极,欧洲药品质量管理局EDQM于2008年颁布的欧洲药典6.1版(EP 6.1)“2.6.7-支原体”章节中就已经将支原体NAT法作为支原体检查的第三种可选方法,并一直保持至现行版(EP 9.5)。与WHO与FDA的态度一样,EP中要求NAT法必须根据本章节中验证指南的要求进行验证后方可使用。经充分验证后,NAT法可替代培养法和DNA染色法,如拟替代培养法,NAT法的灵敏度需达到10 CFU·mL-1;如替代DNA染色法,NAT法的灵敏度应能达到至少100 CFU·mL-1。NAT法可单独使用,如检测有细胞毒性的样品或有快速检测需求时;也可与DNA染色法联合使用,即将样本先接种于指示细胞上培养一定时间后,再提取细胞和上清中的支原体核酸用NAT法检测。
与欧洲药典不同,2002年颁布的第14版日本药典(JP 14)“生物制品生产用细胞基质支原体检查”一章中提到,若仅DNA染色法检查显示样品支原体阳性时,可以使用PCR法确定样本中是否真的存在支原体,且在文中给出了一个具体的两步PCR检测方法示例[19]。该方法在JP 15和JP 16中得到了保留,但在2016年颁布的JP 17中,将“PCR法”修改为更具通用性的“NAT法”,且不再收录上述PCR方法示例,取而代之的是与欧洲药典的支原体NAT法验证指导原则大部分内容一致的方法学验证的指导原则,且在NAT法的使用态度上也与欧美的态度基本一致,即NAT法经过充分验证后,可能会作为培养法和/或DNA染色法的替代方法。
我国自1979年版《中国生物制品规程》开始收录支原体检查培养法,2000年版增加了支原体检查的DNA染色法,其后虽有不断补充完善,但药典收录的法定方法一直是培养法和DNA染色法[2],尚未在药典中对NAT法的应用提出明确要求。但随着国际法规的变化以及行业的需要,我国药典也正在开展支原体NAT法的相关研究工作,并已将增订支原体NAT法列入工作计划。
5 支原体NAT法的方法学验证要求如前所述,国际药品监管机构均提出支原体NAT法在使用前须进行充分的方法学验证,且EP及JP中分别提出了具体的支原体NAT法的方法学验证要求。JP中的验证要求上与EP基本一致,仅在一些细节上稍有不同,如在最低检出限验证中,JP 17在EP中描述的8种支原体外,还要求对唾液支原体的验证(M. salivarium),但未提及鸡毒支原体。对于特异性验证采用非支原体的微生物,JP 17并未给出推荐的验证菌种,但提出需对阳性检测结果进行原因分析。为方便研究者参考,下面将就EP中支原体NAT检测法验证指导原则的相关要求进行简述。
支原体NAT法须进行特异性(Specificity)、最低检出限(Detection Limit)和耐用性(Robustness)验证。如使用商品化试剂盒进行支原体NAT检测,则需试剂盒生产商提供完整的方法学验证数据。
特异性验证目的是证明支原体NAT法可检测出一系列支原体种类,同时又不会检出与支原体有近缘进化关系的革兰氏阳性细菌,包括梭菌属、乳杆菌属和链球菌属。因不能穷尽这类细菌,因此,在验证时如果发现有交叉反应,则需建立一个阳性结果的判定原则以便于在日常使用该方法时进行结果判断,如要求采用支原体法定方法进行二次检测或采用其它可以确证的方法。
最低检出限验证:指导原则要求至少对以下类型的支原体进行最低检出限验证,包括莱氏无胆甾原体(A. laidlawii)、发酵支原体(M. fermentans)、猪鼻支原体(M. hyorhinis,需使用营养需求苛刻株)、口腔支原体(M. oral)、精氨酸支原体(M. arginini)、肺炎支原体(M. pneumonia)[或鸡毒支原体(M. gallisepticum)]。在生产过程中如涉及禽类物质还需增加滑液支原体(M. synoviae)进行最低检出限验证,如涉及到昆虫或植物来源的待检样本则需增加螺原体(Spiroplasma citri)的最低检出限验证。
为建立方法的最低检出限,需确定方法的阳性临界值,即多次试验95%的概率可检出的样本单位体积中目的序列的最低量。通过将准确并标定好的支原体菌种在不同日期进行系列稀释,对不同稀释度的菌种进行NAT检测以确定最低检出限。在进行最低检出限验证时,每一种支原体菌种均需至少进行3次独立的10倍系列稀释,并对所选的每一个稀释度至少要有24个重复数据,才能进行结果的统计学分析。如在至少3 d时间分别进行一次独立10倍稀释,选取的每个稀释度每次试验至少做8个平行重复检测,或至少在4 d分别进行一次独立10倍稀释,选取的每个稀释度每次试验至少做6个平行重复检测,每个稀释度至少获得24个重复结果,通过统计学评估确定95%可信水平检出支原体阳性的浓度。
耐用性验证:耐用性验证是评估方法不被细微且刻意的参数变化而受到影响的能力,并且能够体现方法在日常使用中的可靠性。不同提取试剂、扩增体系、扩增程序以及检测所用设备的变化均能够为方法的耐用性评估提供参考数据。该指导原则建议NAT方法可以在方法学建立的过程中通过不同参数的调整来获得耐用性数据。
2010年,Deutschmann. M等人即按照上述验证指导原则的要求对Eldering. A等人建立的支原体降落PCR检测方法开展了方法学验证,包括特异性、最低检出限和耐用性的评估。特异性验证结果显示该方法不会检出牛链球菌,但对于103 CFU·mL-1的嗜酸乳酸杆菌和梭状芽孢杆菌检测结果为阳性。最低检出限验证中不仅采用了指导原则中所述的8种支原体,还补充了唾液支原体和人型支原体。他们分别在3 d对每个支原体菌种的3个临界水平的稀释度悬液进行8次重复检测,按照应不少于95%可信限的标准判定,该方法对发酵支原体、莱氏无胆甾原体、猪鼻支原体、口腔支原体、肺炎支原体、精氨酸支原体、螺原体、唾液支原体和人型支原体的最低检出限分别为1、5、1、1、0.1、0.1、1、1及10 CFU·mL-1。耐用性验证结果显示在3 d分别使用3批试剂对10倍系列稀释的口腔支原体悬液进行检测,在10 CFU·mL-1时具有很好的耐用性[18]。
开展支原体NAT方法学最低检出限验证需要2个关键元素的支持:1)需要有正确鉴定的不同种类的支原体菌株,这些菌株的选择一方面可参考指导原则中的菌种种类,另一方面还要补充待检样本类型最可能污染的支原体菌株种类;2)这些菌株需要经过标化,即将支原体菌株制备分装后,通过准确的支原体菌落计数或基因拷贝数定量对验证用的支原体菌株样本进行标化。目前,国际上有相关机构可提供这样标定好的支原体菌株。
6 我国支原体NAT法方法学验证的现状及解决方案到目前为止,国内已有多家机构开发了或正在开发支原体NAT法,一方面,这些方法为CAR-T细胞治疗产品研发者提供了选择的可能性;另一方面,由于国内在用于支原体检查法参比物质方面的研究工作尚不充分,一定程度上影响了其支原体NAT法方法学验证研究的速度,而且,我国药典中也尚未收录支原体NAT检测法的方法学验证要求,让CAR-T研究者依据何种标准从众多的商品化支原体NAT检测试剂中筛选出满足其CAR-T细胞治疗产品质控要求的试剂,成了一个需要合理解决的现实问题。
针对国内目前这种现状,有如下几种解决方案可以考虑:其一,使用者可以优先考虑那些已按国外法规要求(如EP或JP要求)进行过充分方法学验证、且可以提供验证报告的检测方法或商品化试剂盒,但使用者在使用前需按照待测样本类型进行方法的适用性验证,并同步开展药典方法的平行检测研究,以积累数据为替代药典方法提供数据支持;其二,近两年国外有些机构已能够提供可供支原体NAT法方法学验证的支原体参比物质,并获得本国药品监管机构的认可,支原体NAT法的开发者可以考虑引进用于方法学验证的参比物质样本;其三,当然也是最根本的解决方法,就是加快国内支原体检查法参比物质的研究工作,为国内试剂研究者及使用者提供技术支撑。
7 结语支原体污染是生物制品外源因子污染检查的经典话题,同样也是CAR-T细胞治疗产品安全性质控的一项重要指标。支原体NAT法因其快速且可以减少因支原体培养而带来操作环境污染的风险,深得新兴生物技术领域研发者的偏好而考虑用于过程控制或细胞类产品的放行检验方法。但由于现在有多种支原体NAT法,且其灵敏度水平参差不齐,到目前为止,仍然没有一种国际上公认的可以替代经典检测方法的支原体NAT法,加之支原体NAT法固有的一些缺陷使得世界各国药品监管机构对采用支原体NAT法代替传统方法的态度仍相对谨慎,且明确要求支原体NAT法需要充分验证后使用。因此,对于支原体NAT法的研发者来说,就需要按照国际相关法规开展方法学验证后才能为用户提供符合药品监管要求的试剂,而对于CAR-T细胞治疗产品的研发者来说,选择这种经过充分验证的支原体NAT法并进行方法适用性验证,且在使用过程中积累与药典方法的比较数据,才能为后期的方法学替代提供充分的数据支持。同时,结合多方力量加快我国支原体NAT法方法学验证用参比物质的研究、开展不同方法的平行性比对研究以及加强支原体药典方法的培训,也必将会为如CAR-T细胞治疗产品的安全性控制提供重要的技术保障。
| [1] |
Volokhov DV, Graham LJ, Brorson KA, et al. Mycoplasma Testing of Cell Substrates and Biologics:Review of Alternative Non-microbiological Techniques[J]. Mol Cell Probes, 2011, 25(2-3): 69-77. DOI:10.1016/j.mcp.2011.01.002 |
| [2] |
中国药典: 三部[S]. 2015: 通则生物制品生产检定用动物细胞基质制备及检定规程.
|
| [3] |
European Pharmacopoeia Commission. European Pharmacopoeia[S]. 9th Edition, 2017: Section 2. 6. 7.
|
| [4] |
Pharmaceutical Affairs and Food Sanitation Council. The Japanese Pharmacopoeia[S]. 17th Edition, 2016: 2460-2464.
|
| [5] |
World Health Organization. Recommendations for the Evaluation of Animal Cell Cultures as Substrates for the Manufacture of Biological Medicinal Products and for the Characterization of Cell Banks[S]. 2010.
|
| [6] |
U. S. Department of Health and Human Services Food and Drug Administration. Characterization and Qualification of Cell Substrates and Other Biological Materials Used in the Production of Viral Vaccines for Infectious Disease Indications[M]. Rockville: The Office of Communication, Outreach and Development (OCOD), 2010.
|
| [7] |
The United States Pharmacopeial Convention. United States Pharmacopeia[S]. 40th Edition, 2017.
|
| [8] |
吴雪伶, 赵翔, 孟淑芳. CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点[J]. 中国药事, 2018, 32(7): 879-885. |
| [9] |
赵翔, 寿成超, 袁宝珠. 中国生产用细胞基质污染支原体类型的分析及猪鼻支原体特异性检测方法的初步建立[J]. 中国生物制品学杂志, 2015, 28(8): 832-836, 840. |
| [10] |
Bernet C, Garret M, de Barbeyrac B, et al. Detection of Mycoplasma Pneumoniae by Using the Polymerase Chain Reaction[J]. J Clin Microbiol, 1989, 27: 2492-2496. |
| [11] |
Wirth M, Berthold E, Grashoff M, et al. Detection of Mycoplasma Contaminations by the Polymerase Chain Reaction Cytotechnology[J]. Cytotechnology, 1994, 16(2): 67-77. DOI:10.1007/BF00754609 |
| [12] |
Uphoff C, Drexler G. Detection of Mycoplasma in Leukemialymphoma Cell Lines Using Polymerase Chain Reaction[J]. Leukemia, 2002, 16(2): 289-93. DOI:10.1038/sj.leu.2402365 |
| [13] |
Pruckler M, Ades W. Detection by Polymerase Chain Reaction of All Common Mycoplasma in a Cell Culture Facility[J]. Pathobiology, 1995, 63(1): 9-11. DOI:10.1159/000163929 |
| [14] |
Eldering A, Felten C, Veilleux A, et al. Development of a PCR Method for Mycoplasma Testing of Chinese Hamster Ovary Cell Cultures Used in the Manufacture of Recombinant Therapeutic Proteins[J]. Biologicals, 2004, 32(4): 183-93. DOI:10.1016/j.biologicals.2004.08.005 |
| [15] |
Saito R, Misawa Y, Moriya, K, et al. Development and Evaluation of a Loop-mediated Isothermal Amplification Assay for Rapid Detection of Mycoplasma Pneumonia[J]. J Med Microbiol, 2005, 54(11): 1037-1041. DOI:10.1099/jmm.0.46071-0 |
| [16] |
Peredeltchouk M, Wilson A, Bhattacharya B, et al. Detection of Mycoplasma Contamination in Cell Substrates Using Reverse Transcription-PCR Assays[J]. J Appl Microbiol, 2011, 110(1): 54-60. DOI:10.1111/jam.2010.110.issue-1 |
| [17] |
Laborde S, Degrave A, Lehmann D, et al. Detection of Mollicutes in Bioreactor Samples by Real-time Transcription-mediated Amplification[J]. Lett Appl Microbiol, 2010, 50(6): 633-638. DOI:10.1111/lam.2010.50.issue-6 |
| [18] |
Deutschmann M, Kavermann H, Knack Y. Validation of a NAT-based Mycoplasma Assay According European Pharmacopoiea[J]. Biologicals, 2010, 38(2): 238-48. DOI:10.1016/j.biologicals.2009.11.004 |
| [19] |
Pharmaceutical Affairs and Food Sanitation Council. The Japanese Pharmacopoeia[S]. 14th Edition, 2002: 1316-1319.
|
 2018, Vol. 32
2018, Vol. 32 
