国家标准(GB/T 19619-2004)[1]纳米材料的定义:物质结构在三维空间中至少有一维处于纳米尺度, 或由纳米结构单元构成的且具有特殊性质的材料。其纳米尺度通常指1~100 nm。纳米材料独特的物理化学性质及其与生物体相互作用特性为其在食品加工、抗菌产品生产、药物载体开发、疾病诊断和治疗、体内示踪等领域的应用提供了广泛的前景。新型纳米材料的诞生为人类带来机遇的同时也带来了挑战。大量纳米材料的涌现,极大程度上增加了人体与纳米材料接触的机会,纳米材料的安全性评价成为关注的热点。如何合理评价纳米材料对人体的潜在毒性,预测其潜在毒性风险是目前全世界科学界及各相关监管部门亟需解决的问题。
遗传毒性试验是非临床安全性评价的重要内容,可通过一系列试验预测受试物是否有遗传毒性,对受试物的致癌性进行预测,降低人群的危害风险。随着对纳米材料作用机制及毒性评价研究的不断深入,科学界及监管部门逐渐意识到,使用传统的遗传毒性评价方法可能无法科学且充分地评价纳米材料的潜在风险,当前传统的药物遗传毒性试验组合可能不适用于纳米材料[2]。因此,有必要针对纳米材料的特殊性对传统的遗传毒性试验方法及试验组合进行优化,为纳米材料的研发、遗传毒性评价及技术审评等相关人员提供参考,并为纳米材料的科学监管提供保障。
2 适用范围本文件包括纳米材料体外及体内遗传毒性试验选择的基本原则、可选择的遗传毒性试验方法以及推荐使用的试验组合方案;适用于纳米材料及含纳米材料的药物、诊断试剂及医疗器械产品的潜在遗传毒性评价。
3 纳米材料遗传毒性试验方法选择 3.1 总则纳米材料的遗传毒性试验目的是评价人体接触纳米材料的潜在遗传毒性风险。遗传毒性试验方法众多,根据试验系统不同可分为体外和体内试验;主要的遗传毒性评价终点包括基因突变、染色体损伤和多倍体形成。目前,没有任何单一的试验方法可同时涵盖所有遗传终点。为全面考察受试物的潜在遗传毒性风险,通常需开展一系列机制上互相补充的试验,即标准化试验组合,来进行综合性评价[3-4]。参考ICH S2(R1),标准试验组合的选择应针对不同的遗传终点[4]。
纳米材料的毒性特点主要表现为其体内吸收、分布、代谢和排泄过程的特殊性。体内试验能够考虑到上述影响遗传毒性的因素,针对纳米材料的体内分布和蓄积特点开展的靶器官遗传毒性研究具有重要意义。体内研究通常在体外研究基础上开展,并强调靶器官相关毒性研究。然而,当含纳米材料的受试物需要进行遗传毒性评价时,考虑到动物实验替代、减少和优化的3R原则,优先开展体外遗传毒性试验。目前,认为其可能的遗传毒性作用机制主要包括两方面[5-6],一是通过诱导大量活性氧或炎症介质的生成从而间接导致遗传物质损伤;二是通过扩散、穿越核孔复合体和在细胞有丝分裂或减数分裂过程中被核膜包裹三种途径进入细胞核,直接作用于DNA导致遗传物质损伤。氧化应激和慢性炎症是纳米材料诱导遗传物质损伤最常见的作用机制[7],开展遗传毒性评价时,可针对氧化应激及炎症作用机制展开。
不同来源的纳米材料的理化性质和稳定性往往差异较大,是决定其毒性强弱的关键因素。相同组分的材料成为纳米级材料时,其生物体内代谢动力学、体内分布及蓄积的特征可发生明显改变[8]。纳米材料的毒性与其粒径,表面修饰和分布等因素密切相关[9]。纳米材料在理化性质上的微弱差异可直接导致其安全性和毒性靶器官的不同。因此,安全性评价需强调纳米材料的理化性质鉴定。如果拟评价受试物为医用纳米材料或者含纳米材料产品,应为可充分代表临床试验或上市后人拟用产品质量和安全性的样品。对不同产品进行评价时遵循“具体案例具体分析(case by case)”的原则。
3.2 样品制备和表征在开展遗传毒性试验之前,需参考ISO/TR 13014(2012)、OECD ENV/JM/MONO(2016)及ISO/TC229等相关标准,充分考察纳米材料的物理化学性能和稳定性[10-12](包括粒径、形状、横纵比值、粒径分布、聚集及沉降状态、结晶度、表面积、分散性及纯度等)。对于理化性质和稳定性不同的纳米材料,其潜在的遗传毒性风险可能不同,需要分别评价。如受试物经鉴定为可溶性纳米材料,可参考《药物遗传毒性研究技术指导原则》[3, 13]进行常规的遗传毒性评价。因制备受试液的介质,特别是生物介质及温度等试验条件可能对纳米材料的理化性质及稳定性产生影响,应对试验体系中的纳米材料进行全面的表征,且试验条件应尽量与体内条件保持一致。
受试物制备的总体原则是最大程度上模拟受试物与人体实际接触的方式。分散介质可影响聚集体的大小,从而影响受试物的沉降、聚集、细胞暴露、细胞毒性、剂量选择和遗传毒性试验结果。单纯的纳米材料受试物,需充分考虑其分散性,选择合适的介质,确保分散均匀,减少团聚。含纳米材料产品(含纳米材料的基质类固体产品),如医疗器械,可参考GB/T 16886.3和GB/T 16886.12选择含纳米材料产品的浸提液[4, 14]。需根据含纳米材料产品预期临床使用的微环境和纳米材料的释放特征选择合适的浸提介质。在合理情况下,含纳米材料固体产品的表面积/质量和浸提液体积之比(以cm2/ mL或mg/mL表示)应尽可能高。应对浸提液中的纳米材料进行必要的表征,如颗粒物尺寸、分散性、表面电荷等。必要时测定浸提液中纳米材料的浓度,以便对结果进行量-效关系的分析。应选择不易吸附纳米材料的浸提容器。其他,如浸提温度、时间等可参照GB/T 16886.3(样品准备条款)[4]。
当特殊金属纳米材料可能会释放金属离子时,需考虑所释放的金属离子可能与分散介质中的离子发生反应,会影响结果的判断。如:纳米银会释放带正电荷的银离子,在分散介质,如氯化钠或者模拟体液中,当银离子的浓度足够高时可与介质中的氯离子形成不溶性氯化银颗粒物。此时,应采取相应措施避免颗粒物形成,并充分评价非纳米材料颗粒物对试验体系和结果的影响。
由于有些纳米材料具有极强的吸附特性,特别是对蛋白成分的吸附。因此,在样品制备时如采用含有机成分的生理介质,应充分评价纳米材料对介质中有机成分的吸附,及其对试验体系和试验结果解释的影响。
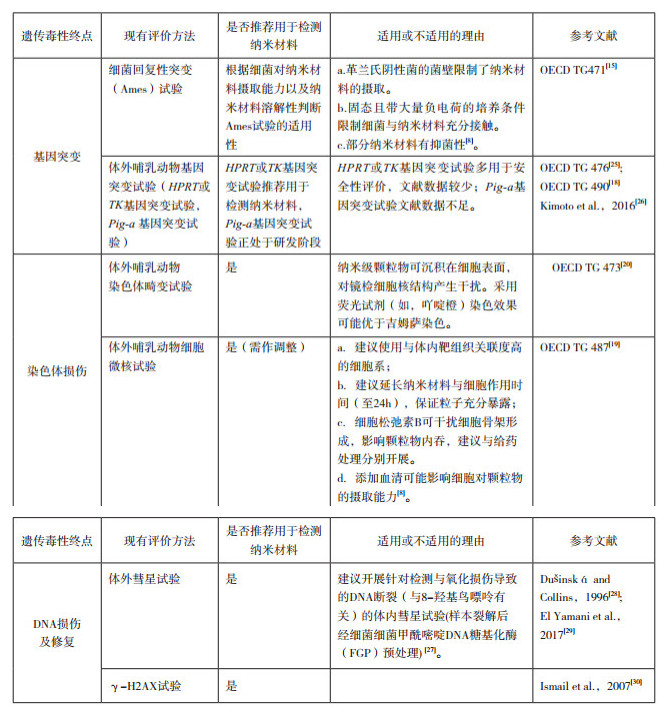
3.3 试验方法的选择 3.3.1 体外遗传毒性体外遗传毒性试验纳米材料评价的适用性如“4.1”节下附录A所示。
传统的Ames试验使用固态培养基,培养基为碱性环境,加之革兰氏阴性菌的菌壁较厚等因素,可导致纳米材料不易穿透胞壁,与细菌接触不充分。另外,有些纳米材料具有一定的抑菌作用,如:纳米银及其释放的银离子等。因此,很多研究及其文献显示,Ames试验(OECD TG 471)[15]不是研究纳米材料遗传毒性的推荐方法。
纳米材料体外遗传毒性试验可根据ICH S2(R1)细胞增殖和细胞毒性试验结果,选择最高受试物处理浓度[3]。某些情况下,如受试物细胞毒性较大,可考虑增加浓度间隔,设置大于标准范围(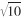
为保证纳米材料在体外试验系统中生物和物理环境中的状态与体内应用时的状态有可比性,应使用现有的方法对给药处理开始和给药处理结束的细胞培养基中的纳米材料进行表征。
纳米材料细胞摄取程度是解释试验结果的关键因素,因此,根据OECD相关文件《合成纳米材料安全性试验的样本制备和剂量测定指导原则纳米材料产品安全性系列文件N0.36》(Guidance on Sample Preparation and Dosimetry for the Safety Testing of Manufactured Nanomaterials Series on the Safety of Manufactured Nanomaterials No. 36)[16]开展体外遗传毒性试验时,应同时对细胞摄取能力进行分析。通常从直接遗传毒性的角度分析,如哺乳动物对纳米材料摄取能力有限,可提示内在风险较低。
纳米材料进入细胞发挥作用的时间较久,建议体外哺乳动物细胞试验受试物处理时间至少为24 h,以保证纳米材料与遗传物质(直接或间接)充分地接触。
胞质分裂阻断法微核试验添加细胞松弛素B(cytochalasin B,CytoB)可干扰细胞骨架的形成,从而影响细胞对纳米粒子的内吞作用。CytoB的给药方法可采用后处理(细胞与受试物处理一段时间后,更换含CytoB的培养基)或延迟的共同处理(细胞与受试物处理一段时间后,更换同时含受试物与CytoB的培养基)的方法,从而保证纳米材料与细胞培养系统在无CytoB的情况下充分暴露。
建议使用可摄取纳米材料,遗传物质稳定且p53功能完整的细胞系(如CHO、CHL、V79等)开展体外研究。
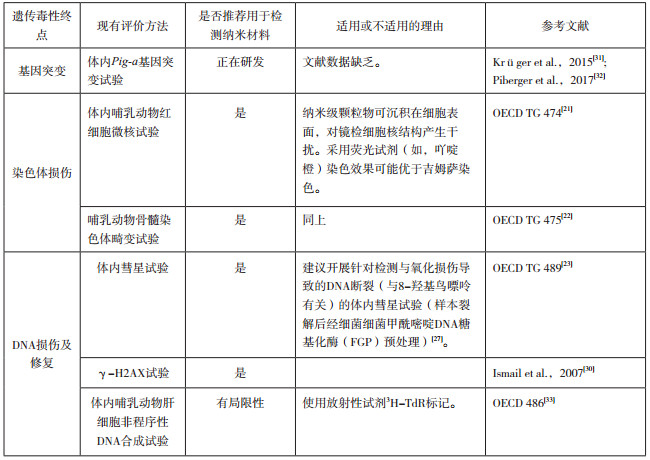
3.3.2 体内遗传毒性体内遗传毒性试验纳米材料评价的适用性如“4.2”节下附录B所示。
开展体内遗传毒性研究前,需在遗传毒性试验检测组织中确定纳米材料的含量水平,必要时开展毒代动力学研究。如在遗传毒性试验检测组织中纳米材料含量较低,则相应试验方法不适用于检测直接遗传毒性[17]。
体内研究中,当前没有足够的数据支持某种给药方式优于另一种给药方式。试验的给药方式需根据人最常见的暴露途径选择。
3.3.3 遗传毒性试验优化组合的考虑(如图 1所示)
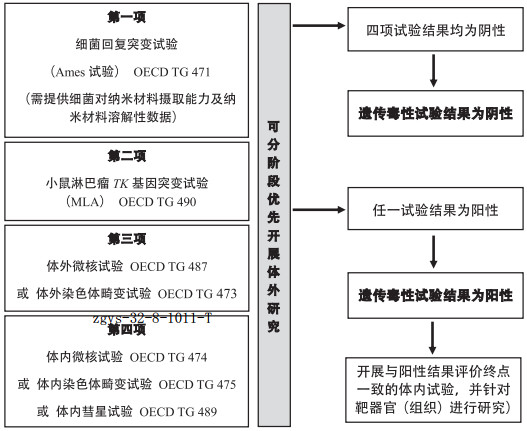
|
图 1 纳米材料遗传毒性试验优化组合 |
纳米材料产品的差异较大,使用传统遗传毒性试验方法评价纳米材料的遗传毒性时可能存在一定的局限性。纳米材料的遗传毒性评价应尽量全面,以提供充分数据对纳米材料的致癌性进行预测,降低接触人群的危害风险。
尽管当前观点认为传统Ames试验不适用于纳米材料遗传毒性检测,但Ames试验作为对啮齿类动物肿瘤发生率预测效果最好的遗传毒性试验方法,不应完全排除在现阶段纳米材料遗传毒性评价组合之外。应在提供研究所用试验条件下,在细菌对该纳米材料摄取能力以及纳米材料溶解性证据的基础上,考虑是否选择Ames试验,或者作为Ames试验结果判定的参考。
小鼠淋巴瘤TK基因突变试验(MLA,OECDTG 490[18])涵盖了基因突变和染色体断裂两个检测终点,可作为第二项纳米材料潜在致突变能力检测方法。
体外微核试验(OECD TG 487 [19])或体外中期分裂相染色体畸变试验(OECD TG 473[20])可针对致断裂剂在检测终点上与Ames试验和MLA互补,可任选一项作为第三项遗传毒性评价方法。体外微核和体外染色体畸变试验中细胞的选择可使用遗传物质稳定的常规遗传毒性试验用细胞系(如CHO、CHL、V79等),或根据体内分布数据选择基于靶器官/组织细胞系开展。在提供相应研究数据的同时应提供研究所用试验条件下细胞对该纳米材料摄取能力以及纳米材料溶解性的证据,作为试验结果判定的参考。
此外,纳米材料的遗传毒性试验组合应参考药物遗传毒性试验,包括一项体内研究。可在啮齿类动物红细胞微核试验(OECD TG 474)或哺乳动物骨髓染色体畸变试验(OECD TG 475)或啮齿类动物体内彗星试验(OECD TG 489)中任选一项作为组合中的第四项试验[21-24]。
上述遗传毒性试验优化组合中的四项试验内容,可分阶段优先开展体外研究。如体外研究中获得阳性结果再根据出现阳性结果的遗传毒性终点选择相应的体内评价方法。如果四项遗传毒性试验结果均为阴性,且根据受试物毒性作用机制分析不存在潜在致遗传毒性的风险,则判断受试物遗传毒性结果为阴性,无需进一步评价其遗传毒性。如果在四项遗传毒性试验中至少一项研究结果为阳性,则判定遗传毒性试验结果为阳性,考虑受试物存在遗传毒性风险。可进一步开展与检出阳性结果的评价终点一致的体内试验,并针对靶器官(组织)进行研究。
4 附录 4.1 附录A 纳米材料体外遗传毒性试验的适用性(表 1)|
|
表 1 纳米材料体外遗传毒性试验的适用性 |
|
|
表 2 纳米材料体内遗传毒性试验的适用性 |
起草单位及起草人:
中国食品药品检定研究院:文海若、徐丽明、陈亮、邵安良、王雪、淡墨
参与提出意见及建议的单位:
第二军医大学朱江波;中山大学公共卫生学院何云;中国疾病预防控制中心李毅民;北京大学公共卫生学院陈章健;国家纳米科学中心吴晓春、刘颖、杨延莲、谢黎明;万舒(北京)医药科技有限公司施畅;中国食品药品检定研究院安全评价研究所张河战、霍艳、耿兴超;中国食品药品检定研究院实验动物资源研究所范昌发;北京大学口腔医院口腔医疗器械检验中心韩建民;南京工业大学纳米生物技术研究所朱岩;国家药品监督管理局医疗器械技术审评中心赵艳红;中国科学院苏州纳米技术与纳米仿生研究所王强斌;中国科学院化学研究所高明远;复旦大学丁建东。
编者按:纳米材料(nanomaterial)指物质结构在三维空间中至少有一维处于1~100 nm尺度范围,或由纳米结构单元构成的且具有特殊性质的材料。我国已成为纳米技术研发和纳米产业大国。随着纳米技术的突飞猛进和大量纳米材料的涌现,人体与纳米材料接触的机会日益增加,纳米材料的安全性评价逐渐成为关注的热点。遗传毒性试验是非临床安全性评价的重要内容,其通过一系列试验评估受试物是否有遗传毒性,对受试物的致癌性进行预测,从而降低人群的危害风险。纳米材料的尺寸效应和表面高活性等特点使它易于透过细胞膜,并可在表面活性和蓄积性的共同作用下,与细胞遗传物质产生直接或间接的相互作用。尤其是携带金属离子的纳米粒子,在进入体内后有可能通过氧化应激或炎症等作用机制诱发染色体或DNA断裂。而纳米材料是否会因长期留存于某些脏器而对细胞的增殖产生影响并进而诱发肿瘤,也是需要考虑的重要因素之一。对纳米材料的遗传毒性研究,当前已发展为一个专门的亚分支研究领域-“纳米遗传毒理学”。
纳米材料的遗传毒性评价具有一定特殊性。纳米材料通过较为缓慢的模式出入细胞,并具有易于在肝脏、肾脏、肺脏、脑及免疫器官分布,以及脏器蓄积性和缓释效应这些特点,与普通化合物和小分子生物制品有所区别,现行经典的遗传毒性评价方法可能无法有效而可靠地进行评价。比如,与啮齿类动物肿瘤相关度最高的标准细菌回复性突变试验无法有效检出纳米材料的潜在致突变性,而体外微核试验、染色体畸变试验及彗星试验却通常可以得到阳性结果。此外,主要针对化学药物设计的体内遗传毒性研究通常使用外周血液作为监测窗,对检测时的采样部位和采样时间有一定限制,其结果可对纳米粒子的遗传毒性作出误判。如何合理评价纳米材料对人体的潜在毒性,预测其风险是目前全世界科学界及监管部门需迫切解决的问题。
美国食品药品监督管理局、法国药监局及经合组织(OECD)等国际监管机构,自2010年以来已逐渐意识到当前的标准化遗传毒性组合试验应用于纳米材料遗传毒性风险评价时存在一定局限。OECD纳米材料产品工作组(Working Party on Manufactured Nanomaterials,WPMN)于2014年发布的《纳米材料产品遗传毒性:OECD专家专题研讨会报告“纳米材料产品安全性系列文件N0.43”》(以下简称为43号文件)中,专家组针对纳米材料遗传毒性评价中的共性问题达成7项共识。与会专家建议继续对纳米材料遗传毒性相关研究数据进行深入挖掘,以确定是否需要对遗传毒性试验指导原则进行相应的调整。当前我国尚未形成纳米材料遗传毒性试验方法选择相关的指南文件。
本文主要参考OECD发布的43号文件和相关遗传毒性指导原则拟定,并经全国纳米技术和遗传毒理研究领域专家、纳米材料及相关产品的研发机构代表讨论并达成共识。征求意见期间共收到修改意见50条,采纳或修改采纳47条,最终形成“纳米材料遗传毒性试验方法选择的技术共识”,供含纳米材料药物、诊断试剂及医疗器械的研发、安全性评价及监管参考。
Editor's Note:A nanomaterial refers to a material that has at least one dimension within a range of 1-100 nanometers in three dimensions or it is a material composed of nanostructured units withspecial properties. China has been a great nation in the nanotechnology research and development (R&D) and nano industry. With the rapid advancement of nanotechnology and the emergence of a large number of nanomaterials, the opportunities for human beings to be exposed to nanomaterials are increasing, so the safety evaluation of nanomaterials has gradually become a hot spot. Genetic toxicity test is an important part of non-clinical safety evaluation. It evaluates whether subjects have genetic toxicity through a battery of tests, and predicts the carcinogenicity of the subjects, so as to reduce their risk of harm to population. The size effect and high surface activity of nanomaterials make them easily penetrate cell membranes, and interact directly or indirectly with cellular genetic materials (DNA or chromosome) due to the combination of their surface activity and accumulation of quantity. In particular, when nanoparticles carrying metal ions enter human body, they may induce chromosome or DNA breakage by mechanisms of action, such as oxidative stress or inflammation. Whether nanomaterials will affect cell proliferation and induce tumors due to long-term retention in certain organs is also an important factor to take into consideration. The study of the genotoxicity of nanomaterials has now developed into a specialized sub-branch research field, that is, "NanoGentoxicology".
The evaluation of genotoxicity of nanomaterials is of certain distinctiveness. Nanomaterials enter and leave cells in a relatively slow mode, and have the characteristics of easy distribution, accumulation and sustained release in liver, kidney, lung, brain and immune organs, which are different from ordinary chemical compounds and small molecular biological products. As a result, the current classical genotoxicity testing battery may not work effectively and reliably. For instance, the standard bacterial reversion mutation test which demonstrates the highest degree of correlation with the generation of rodent tumors, cannot effectively detect the potential mutagenicity of nanomaterials, but in vitro micronucleus tests, chromosome aberration tests, and comet assays can usually yield positive results. In addition, the genotoxicity testing in vivo, mainly designed for chemical drugs, usually uses peripheral blood as a monitoring window and has certain limitations on sampling location and time, which is apt to misjudge the genotoxicity of nanomaterials. How to reasonably evaluate the potential toxicity of nanomaterials to the human and predict the risk are currently urgent problems need to be solved by scientific communities and regulatory authorities worldwide.
International regulatory agencies, including US Food and Drug Administration (FDA), Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) in France and the Organisation for Economic Co- operation and Development (OECD) have gradually realized the limitations of current genotoxicity testing battery in genotoxicity risk evaluation for nanomaterials since 2010. The OECD Working Party on Manufactured Nanomaterials (WPMN) has reached seven consensuses on the common problems of genotoxicity evaluation for nanomaterials in "Series on the Safety of Manufactured Nanomaterials No. 43. Genotoxicity of Manufactured Nanomaterials: Report of the OECD expert meeting" (hereinafter referred as file No.43). Experts at the meeting suggested carrying out an in- depth data review on the genotoxicity data of nanomaterials so as to determine if the guidelines for genotoxicity testing need to be modified accordingly. At present, no guidance document related to the selection of the genotoxicity testing methods for nanomaterials exists in China.
This article was drafted according to the OECD file No.43 and relevant genotoxicity guidelines. Experts in the fields of nanotechnology and genetic toxicology research, as well as representatives of R&D institutions of nanomaterials and related products in China discussed and reached a consensus. During the consultation period, 50 suggestions were received, and 47 suggestions were adopted or adopted with modification, which finally formed the following "Technical Cousensus on the Selection of Genotoxicity Testing Methods for Nanomaterials" to provide reference for future R&D, safety evaluation and regulation on the nanomaterials containing drugs, diagnostic reagents and medical devices.
| [1] |
GB/T 19619-2004, 纳米材料标准术语[S], 2004.
|
| [2] |
OECD. OECD Environment, Health and Safety Publications Series on the Safety of Manufactured Nanomaterials No. 43: Genotoxicity of Manufactured Nanomaterials: Report of the OECD Expert Meeting[EB/OL]. (2018-07-02)[2014-12-3]. http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=env/jm/mono(2014)34&doclanguage=en.
|
| [3] |
ICH. Guidance on Genotoxicity Testing and Data Interpretation for Pharmaceuticals Intended for Human Use S2(R)[EB/OL]. (2011-11-09)[2018-07-02]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S2_R1/Step4/S2R1_Step4.pdf.
|
| [4] |
GB/T 16886. 3: 2011. Biological Evaluation of Medical Devices-Part 3: Tests for Genotoxicity, Carcinogenicity, and Reproductive Toxicity[S], 2011.
|
| [5] |
Magdolenova Z, Collins A, Kumar A, et al. Mechanisms of Genotoxicity. A Review of in vitro and in vivo Studies with Engineered Nanoparticles[J]. Nanotoxicology, 2014, 8(3): 233-278. DOI:10.3109/17435390.2013.773464 |
| [6] |
Manickam V, Velusamy R K, Lochana R, et al. Applications and Genotoxicity of Nanomaterials in the Food Industry[J]. Environ Chem Lett, 2017, 15(3): 1-14. |
| [7] |
郭雅娟, 王雪, 淡墨, 等. 生物医用纳米材料的遗传毒性及其致毒机制研究进展[J]. 药物分析杂志, 2018, 38(1): 50-55. |
| [8] |
Doak SH, Manshian B, Jenkins GJ, et al. In vitro Genotoxicity Testing Strategy for Nanomaterials and the Adaptation of Current OECD Guidelines[J]. Mutat Res, 2012, 745(1-2): 104-111. DOI:10.1016/j.mrgentox.2011.09.013 |
| [9] |
Gosens I, Cassee F R, Zanella M, et al. Organ Burden and Pulmonary Toxicity of Nano-sized Copper(Ⅱ) oxide Particles after Short-term Inhalation Exposure[J]. Nanotoxicology, 2016, 10(8): 1084-1095. DOI:10.3109/17435390.2016.1172678 |
| [10] |
ISO/TR 13014: 2012 Nanotechnologies——Guidance of Physico-chemical Characterization of Engineered Nanoscale Materials for Toxicologic Assessment[S]. 2012.
|
| [11] |
OECD. Series on the Safety of Manufactured Nanomaterials No. 63. Physical-chemical Parameters: Measurements and Methods Relevant for the Regulation of Nanomaterials. [EB/OL]. (2018-07-02)[2016-01-21]. /. http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=env/jm/mono(2016)2&doclanguage=en
|
| [12] |
ISO/TC 229: 2005 Nanotechnologies[S]. 2005.
|
| [13] |
药物遗传毒性研究技术指导原则课题研究组. 药物遗传毒性研究技术指导原则2018[S]. 2018.
|
| [14] |
GB/T 16886. 12: 2005 Biological Evaluation of Medical Devices-Part 12: Sample Preparation and Reference Materials[S], 2005.
|
| [15] |
OECD Guidelines for the Testing of Chemicals TG 471: Bacterial ReverseMutation Test[S], 1997.
|
| [16] |
OECD ENV/JM/MONO(2012)40. Series of the Safety of Manufactured Nanomaterials No. 36. Guidance on Sample Preparation and Dosimetry for the Safety Testing of Manufactured Nanomaterials[EB/OL]. (2012-12-18)[2018-06-22]. http://www.oecd.org/officialdocuments/publicdisplaydocumentpdf/?cote=env/jm/mono%282012%2940&doclanguage=en.
|
| [17] |
Wang D, Dan M, Ji Y, et al. Single-dosed Genotoxicity Study of Gold Nanorod Core/silver Shell Nanostructures by Pig-a, Micronucleus, and Comet Assays[J]. J Biomed Nanotechnol, 2018, In Press.
|
| [18] |
OECD Guidelines for the Testing of Chemicals TG 490: In Vitro Mammalian Cell Gene Mutation Tests Using the Thymidine Kinase Gene[S], 2015.
|
| [19] |
OECD Guidelines for the Testing of Chemicals TG 487: In vitro Mammalian Cell Micronucleus Test[S], 2014.
|
| [20] |
OECD Guidelines for the Testing of Chemicals TG 473: In vitro Mammalian Chromosomal Aberration Test[S], 2014.
|
| [21] |
OECD Guideline for the Testing of Chemicals TG 474: Mammalian Erythrocyte Micronucleus Test[S], 2014.
|
| [22] |
OECD Guideline for the Testing of Chemicals TG 475: Mammalian Bone Marrow Chromosomal Aberration Test[S], 2014.
|
| [23] |
OECD Guideline for the Testing of Chemicals TG 489: In vivo Mammalian Alkaline Comet Assay[S], 2014.
|
| [24] |
Wen H, Dan M, Yang Y, et al. Acute Toxicity and Genotoxicity of Silver Nanoparticle in Rats[J]. PLoS One, 2017, 12(9): e0185554. DOI:10.1371/journal.pone.0185554 |
| [25] |
OECD Guidelines for the Testing of Chemicals TG 476: In vitro Mammalian Cell Gene Mutation Tests Using the Hprt and Xprt Genes[S], 1997.
|
| [26] |
Kimoto T, Horibata K, Miura D, et al. The PIGRET Assay, A Method for Measuring Pig-A Gene Mutation in Reticulocytes, Is Reliable as A Short-Term in Vivo Genotoxicity Test:Summary of the MMS/JEMSCollaborative Study Across 16 Laboratories Using 24 Chemicals[J]. Mutat Res, 2016, 811: 3-15. DOI:10.1016/j.mrgentox.2016.10.003 |
| [27] |
Møller P, Jensen DM, Wils RS, et al. Assessment of Evidence for Nanosized Titanium Dioxide-Generated DNA Strand Breaks and Oxidatively Damaged DNA in Cells and Animal Models[J]. Nanotoxicology, 2017, 11(9-10): 1237-1256. DOI:10.1080/17435390.2017.1406549 |
| [28] |
Dušinská M, Collins A R. Detection of Oxidized Purines and UV-Induced Photoproducts in DNA of Single Cells, by Inclusion of Lesion-Specific Enzymes in the Comet Assay[J]. Alternatives to Laboratory Animals:Atla, 1996, 24(3): 405-411. |
| [29] |
El Yamani N, Collins A R, Rundénpran E, et al. In Vitro Genotoxicity Testing of Four Reference Metal Nanomaterials, Titanium Dioxide, Zinc Oxide, Cerium Oxide and Silver:Towards Reliable Hazard Assessment[J]. Mutagenesis, 2017, 32(1): 117-126. DOI:10.1093/mutage/gew060 |
| [30] |
Ismail I H, Wadhra T I, Hammarsten O. An Optimized Method for Detecting Gamma-H2AX in Blood Cells Reveals a Significant Interindividual Variation in the Gamma-H2AX Response Among Humans[J]. Nucleic Acids Res, 2007, 35(5): e36. DOI:10.1093/nar/gkl1169 |
| [31] |
Krüger C T, Hofmann M, Hartwig A. The in Vitro PIG-A Gene Mutation Assay:Mutagenicity Testing Via Flow Cytometry Based on the Glycosylphosphatidylinositol (GPI)Status of TK6 Cells[J]. Arch Toxicol, 2015, 89(12): 2429-2443. DOI:10.1007/s00204-014-1413-5 |
| [32] |
Piberger AL, Krüger CT, Strauch BM, et al. BPDEInduced Genotoxicity:Relationship Between DNA Adducts, Mutagenicity in the in Vitro PIG-A Assay, and the Transcriptional Response to DNA Damage in TK6 Cells[J]. Arch Toxicol, 2017. DOI:10.1007/s00204-017-2003-0 |
| [33] |
OECD Guideline for the Testing of Chemicals TG 486: In vivo Mammalian Alkaline Comet Assay[S]. 2014.
|
 2018, Vol. 32
2018, Vol. 32