2. 山东省食品药品检定研究院, 济南 250101
2. Shandong Institute for Food and Drug Control, Jinan 250101, China
公众用药安全与药物临床前安全性评价密切相关,候选药物潜在致癌性评价是药物临床前安全性评价的重要内容,尤其是创新药物。1997年人用药品注册技术要求国际协调会议(ICH)颁布了S1B指南,要求开展大鼠2年长期致癌性试验以及小鼠1.5年长期致癌性试验,或以一个中期或短期啮齿类动物体内试验来替代小鼠长期致癌性试验。对于中期或短期啮齿类动物体内试验动物模型,目前国际常用啮齿类遗传修饰小鼠模型[1-3]包括p53+/-基因敲除模型及Tg.rasH2转基因模型。我国食品药品监督管理总局药品审评中心于2009年颁布了《药物致癌试验必要性的技术指导原则》,用于指导我国安评机构开展药物致癌性试验[4]。大鼠和小鼠长期致癌性试验周期长、费用高、需要大量受试物和实验动物,而且不符合国际动物福利的“3R”原则要求[5]。国际上,近10年来常用遗传修饰小鼠模型6个月短期致癌性试验来替代小鼠长期致癌性试验,并且,试验数据已获得日本厚生省、美国食品药品监督管理局等监管机构的认可[6]。目前,我国临床前药物安全评价领域还以啮齿类动物的长期致癌性试验为主[7],其主要原因是由于国外构建的遗传修饰小鼠模型价格昂贵,并受知识产权保护,严重限制了我国使用遗传修饰小鼠模型开展短期致癌性试验。中国食品药品检定研究院实验动物资源研究所模式动物室自主构建了p53+/-敲除小鼠模型,并命名为B6-Trp53tm1/NIFDC,由于该p53+/-敲除模型与国外的p53+/-敲除模型的背景不同,而且其基因敲除方法及饲养繁育条件与国外的p53+/-敲除模型也不一致;因此,有必要对本单位自主构建的p53+/-敲除小鼠模型进行验证[8]。另外,实验动物的体重、脏器重量、血液学及血生化指标的检测也是临床前药物长期毒性试验和致癌性试验中常规检测项目[9],因此,本文测定并分析自主建立的p53+/-基因敲除小鼠模型给予尿烷后的体重、脏器重量、血液学及血生化指标改变,目的是为该模型将来用于临床前药物安全性评价短期致癌性试验体内替代试验提供相关背景数据。
1 材料和方法 1.1 实验动物及分组情况p53+/-敲除小鼠(B6-Trp53tm1/NIFDC)和C57BL/6野生型小鼠均饲养于SPF环境,饲喂SPF级小鼠颗粒饲料,饮用灭菌自来水。动物生产许可证号为SCXK(京)2014-0013,实验动物使用许可证号为SYXK(京)2011-0008。
P53+/-敲除小鼠尿烷初步验证试验设计3个组:阴性对照组(C57BL/6野生型小鼠,给予生理盐水)、尿烷组1(P53+/-敲除小鼠,给予1000 mg·kg-1体重尿烷)和尿烷组2(C57BL/6野生型小鼠,给予1000 mg·kg-1体重尿烷),所有动物均为6周龄,每组动物数均为20只,雌雄各半。在给药期间,尿烷组1有2只雄性动物死亡,尿烷组2有1只雄性动物死亡。在试验第1d、第4d、第7d分别腹腔注射给药1次,给药体积10 mL·kg-1体重,给药后观察24周。分别测定体重、脏器重量、血液学和血生化指标。
1.2 仪器Sartorius CPA 423S电子天平(德国Sartorius公司),Hitachi 7180型全自动生化分析仪(日本日立公司),Bayer ADVIA120全自动血细胞分析仪(德国Bayer公司)。
1.3 试剂清洗液DH620、清洗液DH520、稀释液DH640、溶血剂DH680、溶血剂DH910均购自上海东湖生物医学有限公司;血液学和血清生化指标检测试剂均购自中生北控生物科技股份有限公司。
1.4 测定项目及检测方法[8]体重和脏器重量:检疫期第1d、第7d测定体重,对计划解剖及濒死动物麻醉前先测定体重(此体重用于相对脏器重量的计算),死亡动物解剖前亦需测定体重(如果发现死亡动物器官组织不完整,则无需称重)。给药期间,雌雄动物每周测定体重1次。
解剖时摘取心脏、肝脏、脾脏、肺脏、肾脏、脑、胸腺、肾上腺、颌下腺、卵巢、子宫,剔除脂肪组织后再用电子天平称重(单位:g)。成对的脏器一起称重,并以体重计算相对脏器重量。
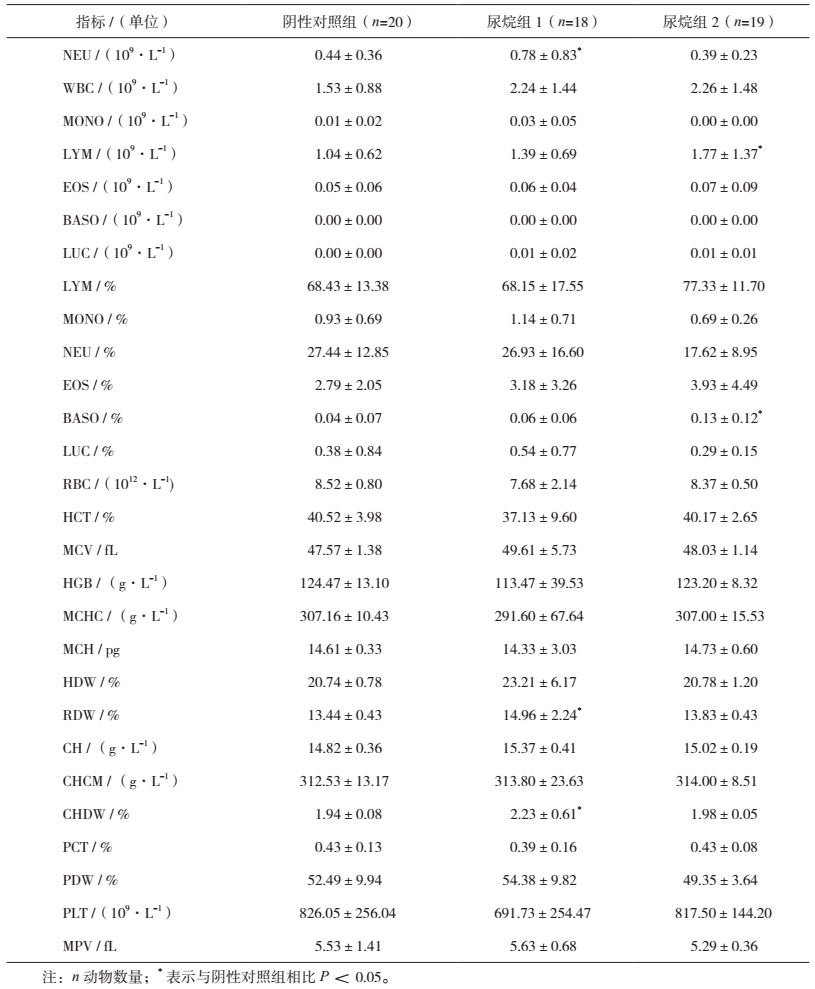
血液学检测指标共28项,包括中性粒细胞计数(NEU)、白细胞计数(WBC)、单核细胞计数(MONO)、淋巴细胞计数(LYM)、嗜酸性粒细胞计数(EOS)、嗜碱性粒细胞计数(B A S O)、大未染色细胞计数(L U C)、淋巴细胞百分比(LYM%)、单核细胞百分比(MONO%)、中性粒细胞百分比(NEU%)、嗜酸性粒细胞百分比(EOS%)、嗜碱性粒细胞百分比(BASO%)、大未染色细胞百分比(LUC%)、红细胞计数(RBC)、红细胞比容(HCT)、平均红细胞容积(MCV)、血红蛋白含量(HGB)、平均红细胞血红蛋白浓度(MCHC)、平均红细胞血红蛋白量(MCH)、红细胞血红蛋白含量分布宽度(HDW)、红细胞体积分布宽度(RDW)、红细胞内血红蛋白含量(CH)、红细胞内平均血红蛋白含量(CHCM)、血红蛋白含量分布宽度(CHDW)、血小板压积(PCT)、血小板分布宽度(PDW)、血小板计数(PLT)及平均血小板容积(MPV)。
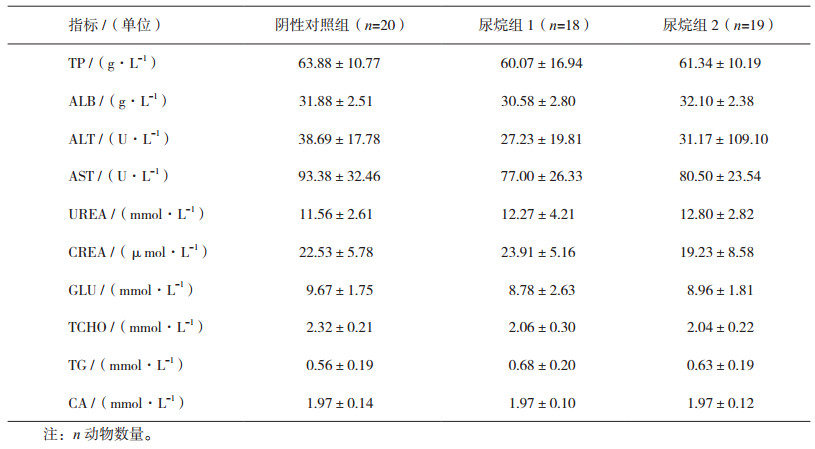
血生化检测指标共10项,包括总蛋白(TP)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、尿素(UREA)、肌酐(CREA)、葡萄糖(GLU)、总胆固醇(TCHO)、甘油三酯(TG)、钙(CA)。
1.5 统计方法所有试验数据均采用x±s表示,采用SPSS19.0软件对所测定的数据进行单因素方差分析检验,再应用Dunett参数检验法就各组间数据进行多重比较检验,P<0.05判断为显著统计学差异,P<0.01判断为高度显著统计学差异。
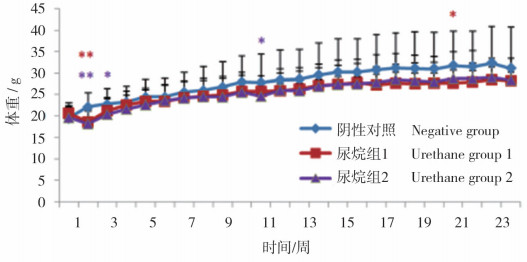
2 结果 2.1 体重给药第2周尿烷组1和尿烷组2动物的体重降低,与阴性对照组相比有高度显著统计学差异(P<0.01);给药第3周尿烷组2动物的体重与阴性对照组相比降低,具有显著统计学差异(P<0.05);给药第11周尿烷组2动物的体重与阴性对照组相比降低,具有显著统计学差异(P<0.05);给药第21周尿烷组1动物体重与阴性对照组相比降低,具有显著统计学差异(P<0.05);之后尿烷组1及尿烷组2动物的体重与阴性对照组没有显著统计学差异(P>0.05)。见图 1。
|
图 1 尿烷给药后小鼠体重的变化 *表示与阴性对照组相比P<0.05;**表示与阴性对照组相比P<0.01。 |
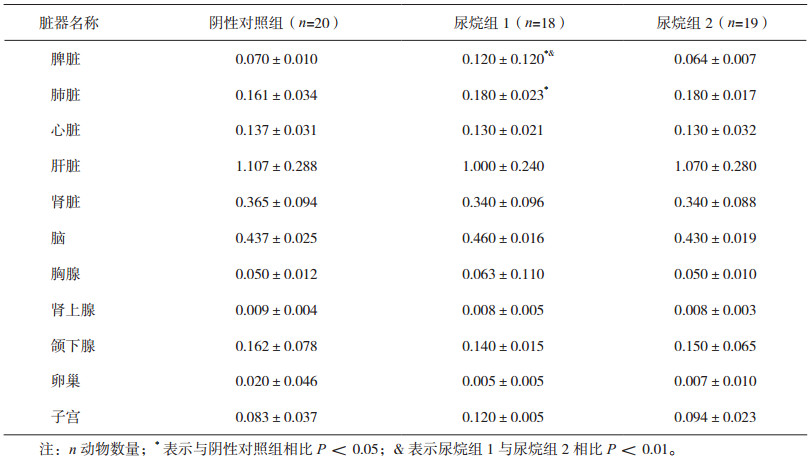
给药24周,尿烷组1动物肺脏和脾脏的绝对重量与阴性对照组相比升高,具有显著统计学差异(P<0.05);尿烷组1动物脾脏的绝对重量与尿烷组2相比升高,具有高度显著统计学差异(P<0.01)。见表 1。尿烷组1和尿烷组2动物肺脏的相对重量与阴性对照组相比均升高,具有显著统计学差异(P<0.05)。见表 2。
|
|
表 1 给药24周各组动物脏器绝对重量测定结果 |
|
|
表 2 给药24周各组动物脏器相对重量测定结果 |
给药24周,尿烷组1 NEU、RDW%及CHDW%与阴性对照组相比升高,有显著统计学差异(P<0.05);尿烷组2 LYM%、BASO%与阴性对照组相比升高,有显著统计学差异(P<0.05)。上述指标在尿烷组1和尿烷组2之间没有显著统计学差异。见表 3。
|
|
表 3 给药24周各组动物血液学指标测定结果 |
给药24周,尿烷组1、尿烷组2各项生化指标与阴性对照组相比,无显著统计学差异(P>0.05)。见表 4。
|
|
表 4 24周各组动物血生化指标测定结果(x ± s) |
自主构建的p53+/-敲除小鼠(命名为B 6 - Trp53tm1/NIFDC)是在C57BL/6背景的干细胞基础上构建的,即在C57BL/6来源的胚胎干细胞中,通过基因打靶技术敲除p53基因的第2~5外显子。获得的首建鼠经过PCR基因型鉴定、Southern杂交鉴定后再与野生型C57BL/6小鼠杂交,F1代再通过PCR筛选获得基因敲除小鼠B6-Trptm1/NIFDC。因此,通过该种方法建立的基因敲除小鼠为纯的C57BL/6(B6)背景小鼠模型,而且,目前国外常用的p53+/-敲除小鼠来自129品系,需要通过回交5~6代才能获得p53+/-敲除小鼠模型,可能还含有少部分129品系的遗传信息,因此,为混合背景小鼠模型[10-12]。目前,国内尚未见到给予尿烷后p53+/-敲除小鼠模型相关生物学特征变化的报道,包括体重、脏器重量、血液学及血生化参数,而且,实验动物的体重、脏器重量、血液学及血生化指标的检测也是临床前药物长期毒性试验及致癌性试验中常规检测项目[9],因此,有必要对自主构建的p53+/-敲除小鼠的上述参数进行测定和分析,为今后该模型用于临床前药物安全性评价短期致癌性试验体内替代试验提供相关背景数据。
给药第2周,尿烷组1和尿烷组2动物的体重明显下降,与阴性对照组相比有高度显著统计学差异(P<0.01);给药第3周,尿烷组2动物的体重与阴性对照组相比降低,具有显著统计学差异(P<0.05)。由于尿烷是实验动物中广泛使用的麻醉剂[13],实验动物单次大剂量给予尿烷后可产生麻醉作用,加上本试验是在试验第1、4、7 d分别腹腔注射给药一次,给药量为1000 mg·kg-1,给药次数较多且给药剂量较大,给药后动物临床表现为昏睡,摄食量明显下降,因此,造成体重下降。直到给药第3周,尿烷组2动物的体重还未恢复至正常范围。有文献报道连续给予100 mg·kg-1尿烷对p53+/-敲除小鼠的体重具有明显的影响,即在试验第85 d时,p53+/-敲除小鼠的平均体重低于对照组小鼠平均体重的5.5%,到试验结束时,p53+/-敲除小鼠的平均体重低于对照组小鼠平均体重的15%[14]。目前,尿烷有2种常用给药方式:一种是100 mg·kg-1连续口服给药,另一种是1000 mg·kg-1腹腔注射给药1~3次。本试验采用1000 mg·kg-1腹腔注射给药3次,一方面是为了与国外遗传修饰小鼠模型尿烷验证试验保持一致以便有更好的可比性;另一方面考虑到p53+/-敲除小鼠耐受力差,如果增加尿烷给药次数可能会导致大量尿烷组1动物早期死亡,致使验证试验不能获得足够的数据[15]。因此,本试验在试验第1、4、7 d分别腹腔注射给药1次,给药剂量为1000 mg·kg-1,虽然单次给药剂量较大,但整个试验期间给药次数较少,因而在给药之后第4周起直到试验结束,仅在第11周和第21周分别出现尿烷组2和尿烷组1动物体重与阴性对照组相比降低,具有显著统计学差异(P<0.05),而在其他时间点尿烷组1和尿烷组2动物体重与阴性对照组相比没有显著统计学差异(P>0.05),但尿烷组1和尿烷组2动物体重总体上均低于阴性对照组(见图 1),与文献报道基本一致[14]。
尿烷是一种遗传毒性致癌物,能够促进细胞有丝分裂,可引起大鼠、小鼠发生肿瘤。C57BL/6小鼠背景来源的p53+/-敲除小鼠模型因其自身的优势可作为致癌性试验短期体内替代试验的候选动物模型[16]。有文献报道给予尿烷后,C57BL/6背景的p53+/-敲除小鼠容易发生肝脏血管瘤或癌,肺脏肿瘤也有发生[17]。Carmichael等人[14]的研究表明:连续给予100 mg·kg-1尿烷可致p53+/-敲除小鼠发生肺腺瘤,发生率为25%。本试验尿烷组1动物肺脏的绝对重量升高,与尿烷诱导出现肺腺瘤有关,而尿烷组1和尿烷组2动物肺脏相对重量的升高可能与尿烷诱导动物发生肺腺瘤和动物体重下降有关(见图 1)[18]。尿烷还可引起p53+/-敲除小鼠发生脾脏恶性淋巴瘤,而野生型小鼠无脾脏恶性淋巴瘤,因此,尿烷组1动物脾脏绝对重量与阴性对照组和尿烷组2相比升高,与尿烷诱导p53+/-敲除小鼠出现脾脏恶性淋巴瘤有关[18]。
尽管血液学指标的统计发现尿烷组1 NEU、RDW%及CHDW%,尿烷组2 LYM%、BASO%与阴性对照组相比升高,有显著统计学差异(P<0.05)。但上述指标在尿烷组1和尿烷组2之间没有显著统计学差异,而且本次验证试验未进行骨髓涂片细胞计数分析,因此,上述指标变化的生物学意义未明,有待将来进行动物数更多的验证试验后进一步分析和总结。
总之,本文测定并比较了自主建立的p53+/-敲除小鼠(B6-Trp53tm1/NIFDC)和野生型小鼠分别给予尿烷后体重、脏器重量、血液学及血生化指标变化,不仅为该模型提供了给予尿烷后的体重、脏器重量、血液学及血生化指标等背景数据,也为将来该模型用于临床前药物安全性评价致癌性试验短期体内替代试验奠定了基础。
| [1] |
ICH Harmonised Tripartite Guideline: Testing for Carcinogenicity of Pharmaceuticals S1B[EB/OL]. [2016-08-10]. http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S1B/Step4/S1B_Guideline.pdf
|
| [2] |
Gulezian D, Jacobson-Kram D, McCullough CB, et al. Use of Transgenic Animals for Carcinogenicity Testing:Considerations and Implications for Risk Assessment[J]. Toxicol Pathol, 2000, 28(3): 482-499. DOI:10.1177/019262330002800320 |
| [3] |
Shah SA, Paranjpe MG, Atkins PI, et al. Reduction in the Number of Animals and the Evaluation Period for the Positive Control Group in Tg.rasH2 Short-term Carcinogenicity Studies[J]. Int J Toxicol, 2012, 31(5): 423-429. DOI:10.1177/1091581812458957 |
| [4] |
国家食品药品监督管理总局药品审评中心, 药物致癌试验必要性的技术指导原则[EB/OL]. [2017-09-10]. www.cde.org.cn
|
| [5] |
Spielmann H. Validation and Regulatory Acceptance of New Carcinogenicity Tests[J]. Toxicol Pathol, 2003, 31(1): 54-59. DOI:10.1080/01926230390173897 |
| [6] |
宋征, 徐景宏, 王庆利, 等. 转基因小鼠在药物致癌性评价中的应用[J]. 中国药理学与毒理学杂志, 2010, 24(6): 557-561. |
| [7] |
李瑞生, 李晓娟, 战大伟, 等. PLCε基因敲除小鼠血液生理生化指标分析[J]. 实验动物科学, 2012, 29(3): 1-4. |
| [8] |
叶应妩, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 第三版. 南京: 东南大学出版社, 2006: 121-451.
|
| [9] |
张桥. 卫生毒理学基础[M]. 第三版. 北京: 人民卫生出版社, 2000: 150-220.
|
| [10] |
Donehower LA, Harvey M, Slagle BL, et al. Mice Deficient for p53 are Developmentally Normal but Susceptible to Spontaneous Tumours[J]. Nature, 1992, 356(6366): 215-221. DOI:10.1038/356215a0 |
| [11] |
Donehower LA, Harvey M, Vogel H, et al. Effects of Genetic Background on Tumorigenesis in p53-deficient Mice[J]. MolCarcinog, 1995, 14(1): 16-22. |
| [12] |
Morton D, Bailey KL, Stout CL, et al. N-Methyl-NNitrosourea(MNU):A Positive Control Chemical for p53+/- mouse Carcinogenicity Studies[J]. Toxicol Pathol, 2008, 36(7): 926-931. DOI:10.1177/0192623308324959 |
| [13] |
van Asselt E, Choudhary M, Clavica F, et al. Urethane Anesthesia in Acute Lower Urinary TractStudies in the Male Rat[J]. Lab Anim, 2017, 51(3): 256-263. DOI:10.1177/0023677216657850 |
| [14] |
Carmichael NG, Debruyne EL, Bigot-Lasserre D. The p53 Heterozygous Knockout Mouse as a Model for Chemical Carcinogenesis in Vascular Tissue[J]. Environ Health Perspect, 2000, 108(1): 61-65. DOI:10.1289/ehp.0010861 |
| [15] |
Mori I, Yasuhara K, Hayashi SM, et al. Carcinogen Dose-dependent Variation in the Transgene Mutation Spectrum in Urethane-induced Lung Tumors in Transgenic Mice Carrying the Human Prototype c-Ha-ras Gene[J]. Cancer Lett, 2000, 153(1-2): 199-209. DOI:10.1016/S0304-3835(00)00372-4 |
| [16] |
Li X, Wu J J, Zheng J, et al. Altered miRNA Expression Profiles and miR-1a Associated with Urethane-induced Pulmonary Carcinogenesis[J]. Toxicol Sci, 2013, 135(1): 63-71. DOI:10.1093/toxsci/kft131 |
| [17] |
Busch SE, Gurley KE, Moser RD, et al. ARF Suppresses Hepatic Vascular Neoplasia in Carcinogen-exposed Murine Model[J]. J Pathol, 2012, 227(3): 298-305. DOI:10.1002/path.4024 |
| [18] |
霍桂桃, 杨艳伟, 刘甦苏, 等. P53+/-基因敲除小鼠对尿烷致癌性验证试验的敏感性研究[J]. 药物分析杂志, 2017, 37(7): 1188-1195. |
 2018, Vol. 32
2018, Vol. 32