伊曲康唑是一种三唑类广谱抗真菌剂,临床上广泛用于治疗浅表真菌及深部真菌引起的系统感染,还适用于其他抗真菌药物不适用或无效的系统性感染,如曲霉病、念珠菌病和隐球菌病[1-2]。伊曲康唑为低溶解、高渗透的药物,属BCS分类系统中Ⅱ类药物,其在体内的溶出释放速率是其生物利用的限速步骤,对伊曲康唑相应的口服固体制剂进行溶出度检查是评价其有效性的一种重要手段。目前,市场上口服固体制剂主要有胶囊剂、分散片和颗粒剂,其中胶囊剂、分散片的标准均有溶出度检查项,而颗粒剂现行标准中无溶出度检查。同时,该颗粒剂为混悬颗粒,按照《中国药典》2015年版四部通则0931[3]要求,应进行溶出度检查。目前,还未见伊曲康唑颗粒溶出度检测方法的相关报道,本文通过对伊曲康唑溶出行为的考察,参考相关文献报道[4-9],依据具体试验建立了伊曲康唑颗粒溶出度的测定方法,并对溶出曲线和生产工艺之间的相关性进行了初步探讨。
1 仪器与试药 1.1 仪器LC-30AD高效液相色谱仪(岛津公司),RCZ-8M溶出度测试仪(天津天大天发科技有限公司),AE-240电子分析天平(瑞士梅特勒公司),TG16-WS台式高速离心机(长沙湘仪离心机仪器有限公司)。
1.2 试药伊曲康唑标准品(中国食品药品检定研究院提供,批号:100631-201402,99.2%),甲醇、乙醚为色谱纯,醋酸铵、十二烷基硫酸钠(SDS)、盐酸为分析纯,水为高纯水,伊曲康唑颗粒样品(山东罗欣药业股份有限公司提供,批号:613101029、614071001、615045093、615045094)。
2 方法与结果 2.1 色谱条件色谱柱:Agilent 5 TC-C18型色谱柱,规格:250 mm×4.6 mm。流动相:甲醇-0.065 mol·L-1醋酸铵-乙醚(70:20:6)。柱温:35℃。检测波长:261 nm。流速:1.0 mL·min-1。进样体积:20μL。
2.2 溶出量测定方法的建立 2.2.1 溶液的制备1)供试品溶液的制备:按照溶出度测定法(通则0931第二法),以0.5% SDS的0.1 mol·L-1盐酸溶液1000 mL为溶出介质,转速为75 r·min-1,依法操作,经45 min时,取溶液适量用0.45μm滤膜滤过即得。
2)对照品溶液的制备:精密称定伊曲康唑对照品20.30 mg,置100 mL量瓶中,用0.5% SDS的0.1 mol·L-1盐酸溶液溶解并稀释到刻度,摇匀,作为对照品储备液。精密量取对照品储备液5 mL,置10 mL量瓶中,用0.5% SDS的0.1 mol·L-1盐酸溶液稀释到刻度,摇匀即得。
3)阴性对照溶液制备:按照山东罗欣药业股份有限公司提供的处方工艺,制备不含伊曲康唑的空白辅料,称取约50 mg,置100 mL量瓶中,加0.5% SDS的0.1 mol·L-1盐酸溶液适量,充分振摇后稀释到刻度,0.45μm滤膜滤过即得。
2.2.2 专属性试验取上述溶液各20μL注入液相色谱仪,记录色谱图。由图 1可见,在本色谱条件下,伊曲康唑峰形良好,阴性对照溶液在伊曲康唑峰保留时间处无吸收,杂质峰无干扰。
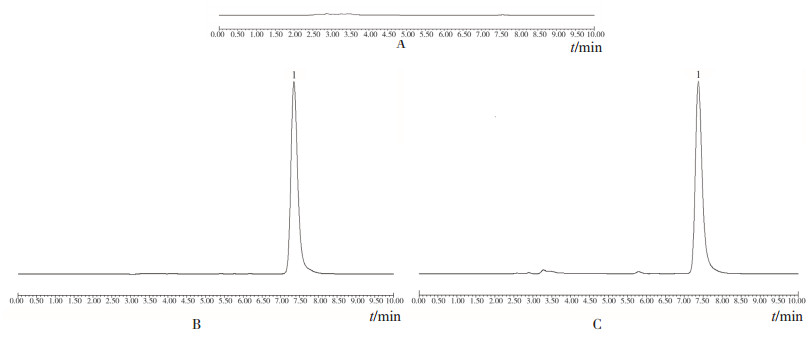
|
图 1 专属性试验色谱图 A.阴性对照溶液;B.对照品溶液;C.样品溶液;1.伊曲康唑。 |
分别精密量取对照品储备液3、4、5、5.5、6 mL,置10 mL量瓶中,用0.5% SDS的0.1 mol·L-1盐酸溶液稀释到刻度,摇匀。取上述溶液各20μL注入液相色谱仪,照上述色谱条件测定。以质量浓度(mg·mL-1)为横坐标,峰面积为纵坐标绘制标准曲线,得伊曲康唑的回归方程:Y=22659791.46X+43229.17;线性范围:0.02014~0.1208 mg·mL-1,r=0.9995。
2.2.4 回收率试验精密称取伊曲康唑对照品8、10、12 mg各3份,分别置有约50 mg空白辅料的100 mL量瓶中,加0.5% SDS的0.1 mol·L-1盐酸溶液适量,充分振摇后稀释到刻度,摇匀滤过即得相当于样品80%、100%、120%的溶液各3份,按上述色谱条件测定,以外标法计算回收率。具体结果见表 1。
|
|
表 1 加样回收率试验结果 |
取对照品溶液,连续进样6次,测定峰面积,计算伊曲康唑峰面积的RSD为0.1%,表明精密度符合要求。
取样品溶液,分别在0、2、4、6、8、10 h进样,测定伊曲康唑峰面积的RSD为1.9%,表明样品溶液在10 h内稳定。
2.3 溶出度测定方法的建立 2.3.1 溶解度测试称取过量的伊曲康唑对照品,分别加入0.1 mol·L-1盐酸溶液,0.2% SDS的0.1 mol·L-1盐酸溶液,0.5% SDS的0.1 mol·L-1盐酸溶液和0.5% SDS的醋酸盐缓冲液(pH3.7)(取水适量,加入冰醋酸25.8 mL,醋酸钠0.67 g,SDS 5.0 g,搅拌溶解后,稀释至1000 mL,调pH至3.7)中,置37℃水浴中振摇过夜,使成过饱和溶液。用0.45μm滤膜过滤后,取续滤液和对照品溶液各20μL注入液相色谱仪,照上述色谱条件测定,按外标法计算伊曲康唑在上述4种介质中溶解度分别为0.003、0.066、0.362和0.389 mg·mL-1。
2.3.2 滤膜吸附试验取伊曲康唑颗粒1袋,按照供试品溶液制备方法,45 min后分别取离心(3000 r·min-1,15 min)上清液、续滤液(0.45μm滤膜过滤,分别弃去2、4、6 mL初滤液)各20μL注入液相色谱仪,按照上述色谱条件测定, 测定伊曲康唑的峰面积分别为5853717、5842959、5834053、5826238,峰面积的RSD为0.2%,表明0.45μm滤膜对样品基本没有吸附,对溶出度测定基本无影响。
2.3.3 溶出介质中的溶出曲线考察根据溶解度测试结果,伊曲康唑在0.5% SDS的醋酸盐缓冲液(pH3.7)和0.5% SDS的0.1 mol·L-1盐酸溶液介质中符合漏槽条件;同时,为了考察颗粒剂在胶囊的溶出度介质中(0.1 mol·L-1盐酸溶液)的溶出行为,选用了0.1 mol·L-1盐酸溶液、0.5% SDS的0.1 mol·L-1盐酸溶液和0.5% SDS的醋酸盐缓冲液(pH3.7)1000 mL为介质,分别在5、10、15、30、45、60、90、120、180、240 min时取样5 mL(同时补充相同温度和体积的溶出介质),用0.45μm滤膜滤过,取续滤液作为供试品溶液,按照“2.1”节方法测定,计算累积溶出量,溶出曲线见图 2。

|
图 2 伊曲康唑颗粒在不同介质中的溶出曲线 |
由溶出曲线可知:伊曲康唑颗粒在0.1 mol·L-1盐酸溶液溶出量只能达到6%;在0.5% SDS的醋酸盐缓冲液(pH3.7)溶液中在180 min后才达到“平台期”, 溶出量达到85%以上;在0.5% SDS的0.1 mol·L-1盐酸溶液中45 min即达到“平台期”,溶出量达到85%以上。因此,选择0.5% SDS的0.1 mol·L-1盐酸溶液作为溶出介质。
2.3.4 转速和取样时间的选择以0.5% SDS的0.1 mol·L-1盐酸溶液1000 mL为溶出介质,转速为每分钟50、75、100 r·min-1,进行溶出试验,试验结果见图 3。

|
图 3 伊曲康唑颗粒在不同转速下的溶出曲线 |
由溶出曲线可以看出,转速越大,溶出速率越快,在转速为50、75、100 r·min-1时,45 min均可达到80%以上,但转速为50 r·min-1时,到60 min时才能达到平台期,75、100 r·min-1时,溶出曲线差异不大,因此选择较低的转速,即75 r·min-1,45 min取样,限度定为标示量的80%。
2.3.5 样品溶出度测定取上述4批样品,用上述方法进行溶出度测定,结果批号为613101029、614071001、615045093和615045094的伊曲康唑颗粒样品的溶出度分别为96.7%、88.3%、92.3%和94.9%,其RSD值分别为1.1%、1.0%、1.4%和2.5%,批间差异为3.9,显示伊曲康唑颗粒剂的生产工艺稳定。
3 工艺相关性讨论伊曲康唑颗粒在0.1 mol·L-1盐酸溶液中最终溶出量只能达到标示量的6%,在相同条件下,《中国药典》2015年版中伊曲康唑胶囊溶出度的限度是标示量的80%[10],两者之间的差异应该是由处方、剂型和工艺的不同造成的。胶囊剂采用固体分散技术[11]提高伊曲康唑的溶解度,而伊曲康唑颗粒的生产工艺为将亲水性聚合物(羟丙基甲基纤维素)和表面活性剂等原辅料混合均匀后,加入适量乙醇溶液制软材,制粒,干燥后进行颗粒筛分,这样的工艺特点可提高伊曲康唑的溶解速率,提高溶出度,保证其具有良好的生物利用率。
| [1] |
邱承培. 氟康唑与伊曲康唑治疗甲真菌病的疗效对比[J]. 临床合理用药, 2015, 8(6C): 60-61. |
| [2] |
李静华, 张志明. 伊曲康唑对灰指甲的治疗效果临床观察[J]. 中医临床研究, 2014, 6(32): 139-146. DOI:10.3969/j.issn.1674-7860.2014.32.084 |
| [3] |
董红环, 程显隆, 刘洋, 等. 雷奈酸锶干混悬剂溶出度方法的建立[J]. 药物分析杂志, 2015, 35(3): 523-547. |
| [4] |
雷琨, 徐长根, 李继, 等. 酚氨咖敏片溶出度方法的建立及国内产品质量的考察[J]. 西北药学杂志, 2013, 28(1): 57-61. |
| [5] |
李娟, 全正义, 熊哲. 酚氨咖敏片溶出度方法的建立及国内产品质量的考察[J]. 中国医院药学杂志, 2013, 33(3): 242-244. |
| [6] |
姚雪莲, 孙涛, 彭红, 等. HPLC法测定咳特灵胶囊中马来酸氯苯那敏的溶出度[J]. 中国实验方剂学杂志, 2012, 18(3): 51-53. |
| [7] |
李兴德, 田静, 周国勇. 两种伊曲康唑胶囊溶出度的比较[J]. 中国药业, 2011, 20(21): 18-19. DOI:10.3969/j.issn.1006-4931.2011.21.009 |
| [8] |
孙伟张, 曾仁杰, 于波涛, 等. 伊曲康唑固体分散体制备及体外溶出实验[J]. 中国医院药学杂志, 2004, 24(10): 617-619. DOI:10.3321/j.issn:1001-5213.2004.10.018 |
| [9] |
谢沐风. 如何科学、客观地制订溶出度试验质量标准[J]. 中国医药工业杂志, 2012, 43(3): A23-A32. |
| [10] |
中国药典: 二部[S]. 北京: 中国医药科技出版社, 2010: 275.
|
| [11] |
易涵, 尹亚妹, 赵秀丽, 等. 伊曲康唑共晶的制备与表征[J]. 沈阳药科大学学报, 2014, 31(3): 161-168. |
 2018, Vol. 32
2018, Vol. 32 
