无菌制剂是指法定药品标准中列有无菌检查项目的制剂[1-2]。无菌制剂作为高风险产品,生产过程质量控制具有复杂性和特殊性。保证无菌制剂质量,及时识别并控制药品生产的质量风险,避免发生药品安全问题,是无菌制剂检查中的重要任务。自2016年1月1日起,无菌药品GMP认证工作由各省、自治区、直辖市食品药品监督管理局负责[3]。为提升山东省无菌药品检查质量、分析无菌药品质量风险,本文对2016-2017年山东省承担的无菌制剂GMP认证检查情况进行统计分析,探讨无菌制剂生产企业存在的主要风险点,为企业有针对性地改进提升提供参考。
1 检查总体情况2016年1月1日至2017年12月31日山东省共完成药品GMP认证216家/次;其中非无菌制剂171家/次,4家/次未通过,通过率为97.7%;无菌制剂GMP认证45家/次,其中3家/次未通过,通过率为93.3%,显著低于其它认证剂型,说明无菌制剂检查更为严格,缺陷问题更为关键。
45家/次认证企业分布于山东省17个地市中的14个地市,认证范围包括大容量注射剂14家/次、小容量注射剂(非最终灭菌)13家/次、小容量注射剂(最终灭菌)9家/次、粉针剂(冻干)11家/次、粉针剂(无菌分装)6家/次、冲洗剂5家/次、眼用制剂5家/次(注:由于每家/次企业申报的认证范围可能涉及不止1种剂型,故按剂型分类统计家次数略多于认证企业家次数)。
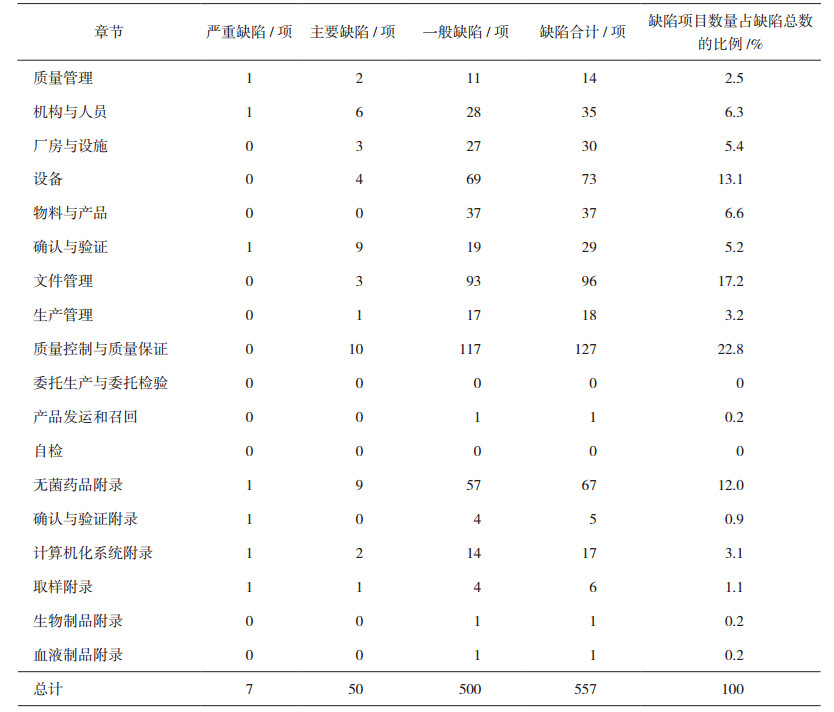
2 缺陷项目情况 2.1 缺陷项数量情况经对检查组提交的现场检查报告审核确认,45家/次现场检查合计发现缺陷557项,其中严重缺陷7项、主要缺陷50项、一般缺陷500项,缺陷项目平均每家次12.4项。
2.2 缺陷项分布和频次情况对缺陷项目涉及的GMP章节和附录进行统计分析,发现缺陷项目数量最多的章节依次是质量控制与质量保证(占22.8%)、文件管理(占17.2%)、设备(占13.1%)、无菌药品附录(占12.0%),缺陷分类统计情况见表 1。
|
|
表 1 缺陷分类统计 |
对严重缺陷和主要缺陷项目涉及的GMP章节和附录进行统计分析,发现缺陷项目数量最多的章节依次是确认与验证(包含确认与验证章节和确认与验证附录)、质量控制与质量保证、无菌药品附录、机构与人员,分别占严重缺陷和主要缺陷项目总数的19.3%、17.5%、17.5%、12.3%,四个章节占严重缺陷和主要缺陷的66.6%。
从表 1缺陷项目涉及条款来看,557项缺陷共涉及GMP正文条款123条,涉及6个附录、合计附录条款52条。
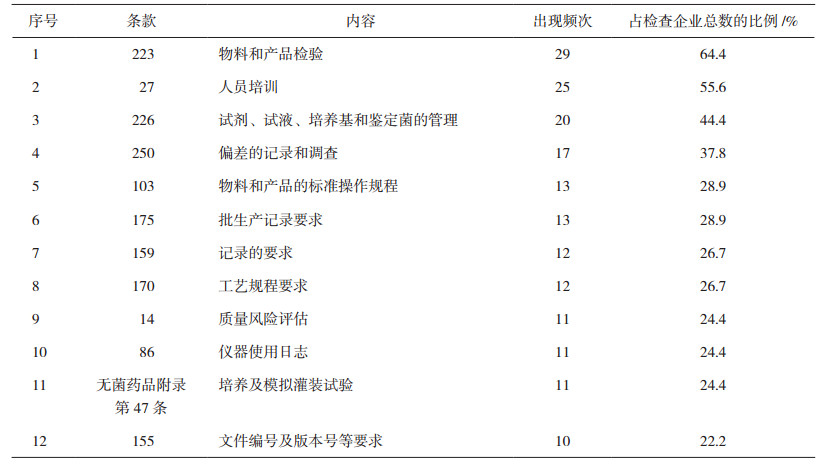
从缺陷项目出现频次看,557项缺陷中出现10次以上的条款共有12条,涉及缺陷184项,占总缺陷项的33.0%;出现5次以上的条款共有37条,涉及缺陷336项,占总缺陷项的60.3%,说明企业间的问题具有一定共性。高频次缺陷项目统计情况见表 2。
|
|
表 2 高频次缺陷项目统计 |
对缺陷项目分章节和条款进行统计分析得出,缺陷主要集中在质量控制与质量保证、确认与验证、无菌药品附录、机构与人员、文件管理、设备、物料与产品等方面。从缺陷发生频次和严重程度看,确认与验证、无菌药品附录、质量控制与质量保证、机构与人员4个方面存在较高的质量风险。
3.1 确认与验证方面确认与验证方面的缺陷共有34条,其中严重缺陷2条,主要缺陷9条,一般缺陷23条。缺陷项主要集中在确认与验证工作不全面、确认与验证数据收集分析不充分等。具体问题,如水浴灭菌柜设备确认未涵盖装载方式确认和热穿透确认;洁净区空调系统在生产结束后进行降频运行,但未对降频后洁净区环境监测数据进行汇总分析、评价。
风险分析:2010版GMP对企业确认和验证工作进行了较详细的规定,且2015年颁布执行的GMP附录《确认与验证》对药品生产质量管理过程中涉及的确认与验证活动也做出了进一步的指导[4]。
但从现场检查缺陷统计情况看,确认与验证方面的严重缺陷和主要缺陷所占比例最高,与法规的要求有一定差距;企业能按照法规要求制定验证总计划和确认与验证方案,但在确定确认与验证的范围方面存在不足,仍是药品生产企业实施GMP认证过程中的薄弱环节[5]。确认与验证工作涉及厂房与设施、设备、检验仪器、关键工艺、操作规程、清洁方法和检验方法等多个方面,任何一方面确认或验证工作做得不全面或数据分析不充分,都会对药品生产质量管理全过程受控产生影响。
3.2 无菌保证方面无菌药品附录章节出现了67项缺陷,涉及32个条款,占缺陷总数的12.0%,其中严重缺陷1条,主要缺陷9条,一般缺陷57条。无菌保证缺陷涉及到无菌操作、A级层流系统和洁净区环境的维护、洁净区环境消毒和监测、培养基模拟灌装试验等多个方面。具体问题,如①A级层流空气流型试验没有涵盖人员操作对灌装等关键区域气流的干扰影响;动态生产时C+A区沉降菌、浮游菌、人员手套微生物的监测周期均为2周,人员表面微生物不监测(员工手臂需进入FFU进行设备调试、排除故障等操作),不利于充分监测微生物。
风险分析:无菌制剂生产过程中,灭菌、无菌操作及除菌过滤等生产步骤是关键工艺控制点,无菌制剂尤其是采用100 ℃流通蒸汽灭菌的非最终灭菌小容量注射剂,其灭菌、无菌装配、无菌灌装等高风险操作受到重点关注。从缺陷项目统计分析看,无菌制剂企业基本建立了无菌保证管理体系,但个别企业在无菌操作、环境监测等细节管理方面仍存在风险点,特别是个别阶段性生产的无菌制剂生产企业,无菌保证方面的缺陷尤其突出。
3.3 质量控制与质量保证管理方面质量控制与质量保证章节中第223、226、250条出现频次最高,3个条款缺陷占本章节缺陷数的55.9%。主要涉及物料和产品的检验,试剂、试液、培养基和检定菌的管理,偏差管理和调查三部分内容。
风险分析点:1)物料和产品的检验方面出现缺陷较多,企业基本能按照GMP条款要求建立物料和产品检验相关的操作规程和记录,但在规范性方面还待加强,具体问题,如①培养箱观察记录、沉降菌检验记录中均未记录样品开始培养和结束培养的时间;②产品原始记录中,无菌检查项未记录取样支数、每种培养基及阳性对照样品中接种的样品支数等。
物料和产品检验记录是药品生产质量管理过程中产生的纸质记录,若管理不规范,容易引起数据可靠性方面的问题。近两年,国内外相关检查中在数据可靠性方面出现的问题较多,企业应引起高度重视[6-7]。物料和产品检验记录作为重要的过程数据,企业应进一步加强物料和产品检验记录规范化管理,针对检验记录管理过程中的薄弱环节,制定切实可行的纠正预防措施,确保符合数据管理方面的法规要求[8]。
风险分析点:2)偏差管理方面出现的缺陷也较多,企业基本能按照GMP条款要求建立偏差处理的操作规程和记录,存在的主要问题是偏差处理不及时或不到位、未制定有效的纠正预防措施或纠正预防措施效果不佳,具体问题,如净化空调机组控制系统中显示多次连续压差报警、在线悬浮粒子监测超标报警,但未及时启动偏差处理并制定纠正预防措施等。
偏差处理与纠正预防措施制定得是否得当、有效,是评价一个企业质量保证能力的重要评估指标,也是对于质量管理体系是否具有持续改进能力的重要评价因素[9]。企业应对偏差处理不及时或不到位的缺陷进行原因分析,找到偏差发生的根本原因,制定切实可行的纠正预防措施,并做好纠正预防措施执行效果的跟踪确认,防止类似偏差再次发生。
从现场检查情况来看,无菌制剂生产企业建立了相对完善的质量控制和质量保证体系,但因个别企业在记录、检定菌的规范管理等细节方面和偏差处理等条款的执行落实方面还存在不足,需要持续改进。
3.4 人员培训方面人员培训问题主要集中于第27条,缺陷主要体现在人员培训不到位或效果不佳。现场发现的具体问题,如① B级区灌装岗位操作人员动作幅度偏大;② B+A区灌装组件装配过程人员操作过程手部偶尔接触无菌服。
风险分析:在无菌药品生产过程中,人员在无菌生产洁净区的行为习惯对无菌药品最终质量的影响最大,风险最高[10]。分析现场检查缺陷产生的原因,认为不注重培训效果和实操考核是导致缺陷的深层原因。个别企业对人员培训重视程度不够,对于人员培训缺少针对性和实效性,流于形式。人是最大的污染源,无菌制剂生产企业应高度重视人员培训工作,特别是无菌生产洁净区操作人员的培训,保证最大限度消除人员的影响,从而降低无菌制剂生产过程的质量风险。
4 建议与展望通过对无菌制剂生产企业GMP认证检查情况的统计分析,可以看出不同无菌制剂生产企业之间生产质量管理水平差距明显,岗位人员素质参差不齐。通过对无菌制剂的生产质量风险分析,建议企业在以下几方面加强改进提升:
1)强化风险意识,做好确认与验证工作。确认与验证活动是确保制药企业按照可靠的标准运行的基础,是药品生产质量管理全过程受控的基础。企业应不断强化风险意识,针对关键生产工艺,同时结合产品和剂型的特点,进行充分的风险评估,以确定确认或验证的范围和程度,科学制定验证方案和分析评价验证数据,切实做好确认与验证工作,实现无菌药品生产质量管理全过程受控的目标[11]。
2)完善无菌保证管理体系,降低产品质量风险。无菌药品附录强化了无菌生产和无菌保证的理念,从洁净度监测、灭菌管理、无菌操作、无菌保证等方面提出具体要求,为保证无菌药品的安全和质量提供了法规依据和科学参考[12]。无菌制剂在生产过程中的风险集中于灭菌操作、无菌灌装等操作不规范。企业应结合自身产品工艺特点,开展经常性的风险评估,从洁净度监测、灭菌工艺、无菌操作、环境监测等生产和质量管理方面进行风险识别,评估无菌保证措施的有效性和适用性,不断完善无菌保证管理体系。
3)推动质量控制和质量保证体系的有效运行。企业有效实施药品GMP,质量控制与质量保证是保证药品质量的关键环节[13]。在对药品质量风险控制的过程中,质量控制的规范性和质量保证体系的有效性对无菌药品质量和检验结果的可追溯性有重要影响。企业应定期自查,及时发现在质量控制和质量保证管理方面存在的风险点,以制定针对性的纠正预防措施,持续推动自身质量控制和质量保证体系的有效运行。
4)重视人员管理,落实人员培训。对于无菌制剂生产企业,人员的无菌生产意识及操作的规范性对降低质量风险至关重要。无菌制剂企业要充分意识到员工素质的提高对企业发展的重要性,应结合岗位特点开展有针对性的培训,将理论培训与实操培训相结合,准确告诉员工在各自岗位应该做什么,如何做;并建立长效培训机制,扎实做好人员培训工作[14-15],避免流于形式。
总之,无菌制剂的生产质量管理需要特别关注无菌保障措施的有效性和适用性。无菌制剂企业更需要不断强化质量风险意识,满足不断更新的法规要求,开展经常性的风险评估工作,从人、机、料、法、环等各方面及时识别潜在的质量风险点,制定切实可行的解决方案,确保持续稳定地生产出符合预定用途和注册要求的药品。
| [1] |
中华人民共和国卫生部. 卫生部令第79号药品生产质量管理规范: 2010年修订[S]. 2011.
|
| [2] |
国家食品药品监督管理总局. 国家食品药品监督管理总局第16号公告《药品生产质量管理规范(2010年修订)》无菌药品等5个附录[S]. 2011.
|
| [3] |
国家食品药品监督管理总局. 国家食品药品监督管理总局关于未通过药品生产质量管理规范(2010年修订)认证企业停止生产和下放无菌药品认证有关事宜的公告[EB/OL]. [2015-12-30]. http://www.sda.gov.cn/WS01/CL0087/140080.htmll.
|
| [4] |
国家食品药品监督管理总局. 国家食品药品监督管理总局第54号令《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证2个附录[S]. 2015.
|
| [5] |
王璐, 赵红菊, 马辉, 等. 辽宁省药品GMP认证检查缺陷情况分析[J]. 中国药事, 2017(5): 520-523. |
| [6] |
韩莹, 胡敬峰. 美国FDA药品cGMP警告信统计分析[J]. 中国药事, 2017, 33(9): 969-975. |
| [7] |
国家食品药品监督管理总局食品药品审核查验中心. 2016年度药品检查报告[EB/OL]. [2017-06-01]. http://www.sda.gov.cn/WS01/CL0844/173310.html.
|
| [8] |
林伟强. GMP实施中数据完整性控制策略研究[J]. 中国药事, 2016, 30(9): 866-868. |
| [9] |
贾娜, 李妮, 赵红菊, 等. 辽宁省新修订药品GMP认证检查质量保证方面存在的缺陷及改进建议[J]. 中国药事, 2015, 29(7): 721-724. |
| [10] |
国家食品药品监督管理局药品认证管理中心. 药品GMP指南[M]. 北京: 中国医药科技出版社, 2011.
|
| [11] |
鲍程程, 王璐, 杨悦. 辽宁省无菌药品生产企业新版GMP认证检查缺陷分析与策略[J]. 中国医药工业杂志, 2018, 49(1): 124-129. |
| [12] |
刘树林. 无菌药品生产企业实施2010版GMP的策略研究[D]. 天津: 天津大学硕士学位论文, 2011.
|
| [13] |
李竹, 刘知音. 新版GMP认证现场检查中质量控制与质量保证所存缺陷的分析[J]. 机电信息, 2014(11): 11-13. |
| [14] |
胡士高, 罗京京, 窦颖辉, 等. 安徽省无菌药品生产企业新版GMP认证检查缺陷分析与对策研究[J]. 机电信息, 2014(20): 6-9. DOI:10.3969/j.issn.1671-0797.2014.20.002 |
| [15] |
韩莹, 柏建学, 许丹, 等. 2015年山东省药品GMP认证检查情况分析[J]. 药学研究, 2016, 35(7): 427-430. |
 2018, Vol. 32
2018, Vol. 32