当今肿瘤治疗手段与日俱增,除常规手术、放疗和化疗之外,肿瘤免疫疗法作为癌症治疗的“第四支柱”引起广泛关注,它将过去重复的症状控制转为一次性的治疗甚至治愈,给生物医学带来新的希望。其中,嵌合体抗原受体工程T(CAR-T)细胞治疗是近年来发展非常迅速的一种细胞治疗手段,即通过体外对T细胞修饰使其能靶向肿瘤抗原并产生相应免疫反应,在多项临床研究中取得了巨大的成功[1]。目前全球已有两款药物相继获得FDA的批准上市,分别是Novartis的Kymriah和Kite的Yescarta,极大地促进了CAR-T产品的研发和应用热潮。
虽然CAR-T疗法取得了一些不错的成果,但仍有不少问题亟待解决。从临床试验反馈得到的诸如疗效、安全性的问题,需要通过临床前的基础研究以及动物试验等进行改进和优化,再反馈回临床以制定优化的治疗方案[2-5]。但是,CAR-T细胞作为人源细胞产品,给予免疫功能正常的动物时会发生免疫应答,导致人源细胞被清除或者出现免疫排斥反应,从而无法获得对临床有充分预测意义的有效性和安全性信息。因此,需要根据研究目的选择适当的实验动物模型。目前,已用于CAR-T产品研究和正处于探索阶段的动物模型主要包括同源小鼠模型、转基因小鼠、移植瘤小鼠模型、免疫系统重建人源化小鼠以及灵长类动物模型[6-8]。
1 同源小鼠模型(Syngeneic Mouse)同源小鼠模型具有完整的免疫系统,可以负荷鼠源肿瘤,并用以考察CAR-T产品对机体的活性作用。以靶向CD19的CAR-T细胞为例,早期使用同源小鼠模型进行的药效学研究表明,CAR-T细胞回输后导致淋巴瘤消除的效果比使用抗CD19单克隆抗体更为显著,且未出现明显的细胞毒性。同时,同源小鼠模型的组织也可能表达低水平的靶抗原,鼠源CAR-T细胞可以靶向性地与其体内鼠肿瘤相关抗原(Tumor Associated Antigen,TAA)结合。因此,可以更好地用于检测靶向和脱靶毒性[9],但是仅限用于研究鼠源细胞制备的CAR-T产品。小鼠品系不同也可能影响毒性反应的考察,使用BALB/c小鼠进行研究发现,第一代CAR-T细胞(T细胞受体胞内信号结构域无共刺激分子表达)通过特异性抗原识别肿瘤细胞并对肿瘤细胞进行杀伤,但未见明显的副作用[10]。与之相比,第二代CAR-T细胞(T细胞受体胞内信号结构域含共刺激分子CD28表达)则会导致B细胞增生以及慢性毒性,并伴随骨髓来源的抑制性细胞(Myeloid- derived Suppressor Cells,MDSCs)增多,从而诱发免疫抑制作用,且用CAR-T细胞治疗后血清IFN-γ和TNF-α水平升高,提示治疗后可能诱发细胞因子释放综合症(Cytokine Release Syndrome,CRS)。在C3H或C7BL/6同源小鼠模型上进行同样的研究并未观察到这些毒性[11]。因此,使用同源小鼠模型开展非临床研究时,各种小鼠品系出现的毒性反应可能各不相同。同时,同源小鼠模型的免疫系统与人类的免疫系统不同,在很大程度上仍无法模拟CAR-T诱发的CRS,且与人源CAR-T细胞相比,鼠源CAR-T细胞在体内存活时间较短,易发生活化诱导的细胞死亡,难以很好地揭示人源CAR-T细胞体内生物学效应以及毒性反应[12]。
2 转基因小鼠(Transgenic Mouse)转基因小鼠为免疫系统正常鼠,表达人TAA。在研究针对不同TAA的CAR-T的同时可以保留宿主免疫系统,但研究对象细胞需要为鼠源细胞[13]。该模型适合用于CAR-T细胞的概念验证性研究,由于大多数TAA不仅在肿瘤上表达,在健康组织中也有较低水平的表达,因此,转基因小鼠是观察CAR-T毒性作用的重要模型。在一项临床试验中发现,CAR-T回输前,以环磷酰胺进行预处理,能明显增强CAR-T的抗肿瘤效果,上述情况在异种移植瘤小鼠模型中并未发现,但在该转基因小鼠模型中获得了证实[14]。然而,该转基因小鼠模型对临床的毒副作用仍无法实现充分预测,也无法提供人源CAR-T细胞的药效和安全性的直接证据。有临床研究发现,以癌胚抗原CEA(Carcino- embryonic Antigen)为靶点的CAR-T会诱导病人出现严重自身免疫,但在3项CEA转基因小鼠研究中,至少有2项没有观察到动物出现明显自身免疫反应[15],原因可能在于胰腺癌患者的结肠黏膜皱褶减少,使得肠道内的CAR-T细胞以及细菌菌落增多,进而导致免疫细胞功能亢进,而小鼠虽表达了高水平的人类CEA,病理条件下的免疫功能亢进却无法在转基因小鼠中复制,因此无法获得全面的对临床有预测价值的信息。此外,临床试验发现,给予高剂量抗HER2的CAR-T细胞后,患者发生死亡,而在HER2的4个转基因小鼠模型中,有3个并未观察到致死性反应[3]。由此可见,通过转基因方式移植人TAA并不能再现许多天然肿瘤的性质,而能够产生自发肿瘤的转基因模型小鼠可能会更好地模拟人类癌症的临床进展并进行肿瘤靶向以及脱靶毒性的预测。
3 移植瘤小鼠模型(Human Xenograft Mouse)当前肿瘤学研究主要依赖免疫缺陷小鼠的荷瘤模型,即在免疫缺陷小鼠中移植人源肿瘤,用来研究人源CAR-T细胞对人源肿瘤的作用,属于一种更加直接的概念验证性研究。
早在1966年,科学家们就构建了T淋巴细胞发育不全的裸鼠模型。随后,通过SCID缺陷小鼠与非肥胖糖尿病NOD小鼠回交,产生了NOD/SCID小鼠,该小鼠既有先天免疫缺陷,又有T和B淋巴细胞缺乏。各种肿瘤细胞可以植入,且较少发生排斥反应及移植物抗宿主病(GVHD),因此,NOD/SCID小鼠一度被认为是用于血液学肿瘤研究最理想的模型动物[16-17]。但人们逐渐发现,由于SCID小鼠的NK细胞对外源细胞的排斥作用,制约了人源肿瘤细胞的植入能力,使得该模型的使用受到限制。21世纪初,随着IL-2受体伽玛链(IL-2Rγ)缺陷小鼠的引入,使移植瘤小鼠模型的构建水平获得较大提升[18]。作为细胞因子IL-2、IL-4、IL-7、IL-9、IL-15、IL-21等信号传递所共同需要的受体成分,IL-2 Rγ的缺陷将直接导致T、B细胞发育受损,NK细胞缺失,由此构建出的NSG等几种重度联合免疫缺陷小鼠均克服了残存NK细胞对外源性细胞的限制性问题,使得它们成为当前肿瘤移植最为理想的模型小鼠。通过对荷载淋巴瘤的小鼠注射CAR-T细胞,可观察人源CAR-T细胞的抗肿瘤作用,对其有效性评估具有重要意义[19-20]。
移植瘤小鼠模型负荷肿瘤细胞后,还可在研发早期阶段用于测试和验证不同设计类型的CAR(例如引入不同的信号分子或者细胞因子)的药效以及靶向或脱靶效应。例如,有研究使用NSG小鼠来测试嵌合组合抗原的CAR细胞的靶向性,以减少其脱靶毒性,该CAR-T细胞需同时靶向前列腺特异膜抗原以及前列腺干细胞抗原,即T细胞只有在两者都被识别时才被激活,而只表达其中1种抗原的靶细胞则不会被CAR-T细胞清除[21]。另一项研究使用了针对CD19和CD20的双特异性CAR-T来减少CD19呈阴性的白血病中的抗原逃逸。与只针对CD19的CAR-T细胞相比,双特异性CAR-T细胞能够有效清除NSG中混合表达CD19和/或CD20的白血病细胞群[22]。此外,应用移植瘤小鼠模型可测试引入不同人源细胞因子的CAR-T的抗肿瘤效果,有研究发现包括IL-2、IL-7、IL-15和IL-21在内的多个细胞因子均能改善CAR-T细胞治疗产品的肿瘤杀伤能力,但诱导的机制以及肿瘤清除程度有所不同[23]。
移植瘤小鼠模型在免疫缺陷小鼠中移植人源肿瘤,也可以作为疾病动物模型对毒性指标进行观察,但其缺点是没有宿主免疫系统,不能完全模拟人体中出现的CRS带来的级联反应,也无法观察CAR-T细胞与体内其他免疫细胞或组织的相互作用,无法检测脱靶作用。非荷瘤免疫缺陷鼠由于缺乏免疫细胞,不会产生免疫排斥反应,可使CAR-T细胞在其体内存活较长时间,更适合对CAR-T细胞制剂的非靶点安全性风险以及成瘤性/致瘤性进行研究。
4 免疫系统重建人源化小鼠(HIS小鼠,Humanized Immune System Mice, HIS Mice)免疫系统重建人源化小鼠模型是通过向免疫缺陷鼠移植人源免疫细胞制备得来,在一定程度上具有人类天然或适应性免疫系统,在此基础上植入人源肿瘤细胞或肿瘤组织,可用于研究人类免疫系统环境下肿瘤的生长情况,评估CAR-T细胞抗肿瘤治疗效果及相关毒性作用机制[24-26]。它们对人源CAR-T细胞具有较好的耐受性,并弥补了同源小鼠模型以及移植瘤小鼠模型的缺陷。人源化小鼠模型的构建通常是在免疫缺陷鼠如NSG小鼠等进行CAR-T细胞治疗前移植人CD34+造血干细胞/祖细胞(Human CD34+ Hematopoietic Stem / Progenitor Cells, CD34+ HSPCs)。HSPCs可以再生少量髓系和部分淋巴系细胞[16, 27]。向免疫缺陷鼠移植人的骨髓、肝脏和胸腺的人源化BLT(Fetal Bone Marrow,Liver,Thymus)小鼠模型,其构建更加复杂,是目前最接近人免疫系统的动物模型[12]。
免疫人源化小鼠模型由于同时具有人的免疫系统并可以移植人源肿瘤组织,能够真实模拟人免疫系统与肿瘤相互作用的过程,在临床前CAR-T细胞产品抗肿瘤评价体系中具有其独特优势。在临床前药效学评价方面,有研究已经证明该小鼠模型能够反映出肿瘤的异质性,在做临床预测时,更接近真实的临床结果。患者中的肿瘤组织异质性强,通过该评价系统可以较好地观察靶点被消除后肿瘤是否复发,从而反映临床疗效。其次,在临床前安全性评价方面,人源化小鼠为CAR-T治疗的安全性评估提供了机会。CAR-T常见的副作用有细胞因子风暴、神经系统毒性和B细胞发育不全等。T细胞会攻击带有相同肿瘤抗原的正常细胞,诱发细胞因子风暴。尽管CAR-T采取了多种改进策略,但由于患者个体的差异等原因有些副作用仍无法避免。通过将肿瘤组织移植到小鼠模型体内,注射患者特异性的CAR-T细胞,监测CAR-T细胞的组织分布,研究CAR-T细胞在体内存活时间以及肿瘤生长情况、小鼠体重变化、细胞因子浓度等,评估CAR-T的治疗靶标是否特异,是否存在脱靶毒性,预测CAR-T实际临床应用时产生细胞因子风暴的可能性以及严重性,从而进行临床治疗方案的风险评估。
尽管HIS小鼠模型可以在动物体内较好地模拟人免疫系统,在评价CAR-T细胞安全性方面颇具前景。但该模型尚处于初期研究阶段,模型的统一和标准化尚存在难点。例如,人源化免疫系统在小鼠中并没有对宿主实现完全耐受,具有髓系细胞发育不全、T细胞欠缺等缺点[28];CD34+ HSPCs细胞的来源包括多种途径,如成人骨髓、外周血、脐带血和胎儿肝脏,而不同来源细胞产生的动物模型可能对CAR-T细胞评价的结果产生影响;由于安全性研究需要的动物数较多,而一份脐带血干细胞所能用于重建的小鼠非常有限,往往同一实验需要使用多个供体来源的CD34+ HSPCs细胞,重建后的小鼠个体嵌合程度也可能不同,上述因素都可导致实验系统个体差异程度增加;另外,人CD34+ HSPCs细胞在小鼠体内分化的骨髓和淋巴细胞与在人体内分化的同类细胞比较存在很大区别,由其建立的人免疫系统尚不完善,随时间推移,其自发病的发生率也比免疫缺陷小鼠更高。总之,目前人源化小鼠模型在CAR-T细胞上的研究应用仍以探索性为主,尚不能全面应用到非临床研究中。
5 灵长类模型(Primate)一直以来,几乎所有的CAR-T临床前研究都是在啮齿类动物身上进行。然而,小鼠TAA序列、免疫系统以及生理学功能与人类生理存在显著差异。灵长类动物的免疫系统与人类更相似,理论上可交叉识别人和猴特异性抗原的CAR-T细胞,可以模拟CRS和神经毒性等临床上发现的毒性反应。
灵长类动物最早曾被应用在以肿瘤相关抗原ROR1(Receptor Tyrosine Kinase Like Orphan Receptor 1)为靶点的CAR-T研究中,ROR1在人类和灵长类动物之间高度保守,且有相似的组织表达模式,因此,灵长类动物模型能为CAR-T产品的安全性提供较有价值的信息。研究者将经过改造过的猕猴自体T细胞移植到2只猕猴体内,这些CAR-T细胞迅速靶向含有大量ROR1+ B细胞的区域,比如淋巴结和骨髓,使ROR1+前体B细胞得以清除,即使在高剂量下,也仅观察到IFN-γ和IL-6的一过性升高,且给药3天后血清细胞因子水平恢复正常[29]。另一项有关L1细胞粘附分子的CAR-T产品也使用了灵长类动物模型,该TAA在人类和猕猴之间高度保守,研究使用的剂量为临床剂量的100倍,试验发现2只猕猴的耐受性良好,只有短暂的IFN-γ和IL-6血清细胞因子水平增加,此外也没有观察到毒性,这可能与CAR-T细胞在动物体内存续时间短,受体内免疫清除相关[30]。只有在另一项以CD20为靶点的CAR-T细胞临床前研究中,注射后CAR-T灵长类动物出现B细胞发育不良、神经毒性和CRS症状,血清IL-6和IL-8显著升高。上述毒性反应与临床中观察到的不良反应较为吻合,即患者在注射1周后出现肢体震颤和行为异常等在内的神经毒性,在服用抗癫痫药物后不良反应得到控制,这些临床中呈现的不良反应在灵长类动物模型中得以预测,可能与环磷酰胺预处理或不同CAR-T靶点的构造及特性相关[6]。
尽管灵长类动物模型显示的毒副作用可能与临床试验较为相似,可在小鼠模型验证后进一步提供有用的安全信息,并可做为临床前应用的最后一步检测,但当前的模型仍存在很多亟待解决的问题,其中一个重要局限性是在灵长类体内移植人源肿瘤较为困难,当灵长类TAA无法被CAR识别时,CAR-T细胞无法活化,在体内存续时间短;同时,人源细胞在猴体内可能会被免疫排斥,无法充分评价其药效或者无法长期评价其药效或者毒性反应;为降低免疫排斥,可预先或同时给予动物免疫抑制剂,但可对CAR-T的安全性研究结果产生干扰;此外,该模型价格高、研究样本小,在临床前应用中仍存在诸多挑战。
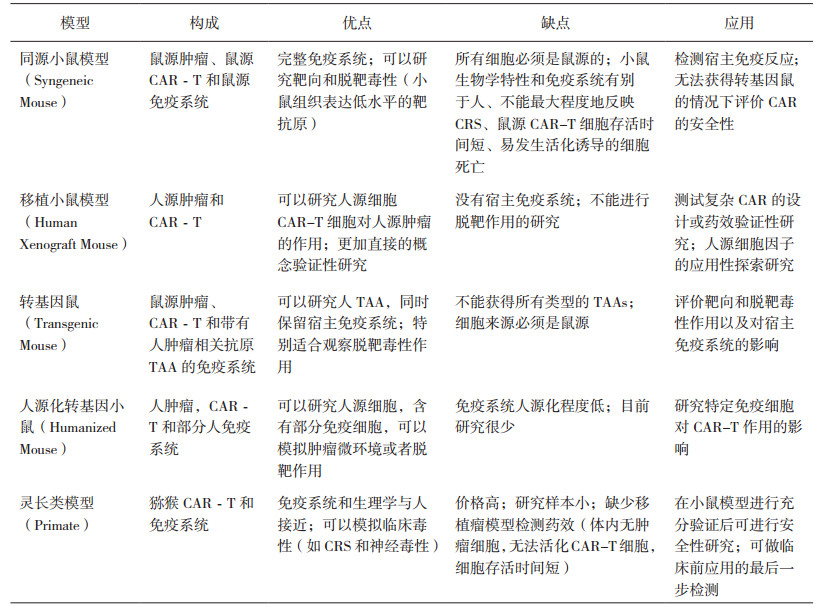
6 结语CAR-T细胞治疗作为近年来被认为癌症治疗领域最成功的方法之一,为肿瘤治疗带来巨大希望的同时,也给临床前评价研究带来前所未有的挑战。动物模型是生命科学研究中建立的能够模拟人体内反应的动物材料,在CAR-T细胞产品的有效性和安全性等研究中具有重要意义。由于生物体的复杂性和种属特异性,目前尚未有任何一种动物模型能完全模拟人类的免疫系统以及肿瘤微环境[31]。在对CAR-T细胞产品进行临床前研究时,需根据产品特性以及动物模型的优缺点,采用不同的模型进行不同目的和不同类型的研究。表 1总结了CAR-T细胞产品临床前研究中不同动物模型的特点和应用[6]。随着研究的不断深入以及各种新技术的应用,人们将建立更为完善的动物模型,从而为CAR-T细胞肿瘤免疫治疗提供更多更有价值的有效性和安全性信息。
|
|
表 1 CAR-T细胞临床前研究中不同动物模型的特点和应用 |
| [1] |
Maude S L, Frey N, Shaw P A, et al. Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia[J]. N Engl J Med, 2014, 371(16): 1507-1517. DOI:10.1056/NEJMoa1407222 |
| [2] |
Brentjens R, Yeh R, Bernal Y, et al. Treatment of Chronic Lymphocytic Leukemia with Genetically Targeted Autologous T Cells:Case Report of an Unforeseen Adverse Event in a Phase Ⅰ Clinical Trial[J]. Mol Ther, 2010, 18(4): 666-668. DOI:10.1038/mt.2010.31 |
| [3] |
Morgan R A, Yang J C, Kitano M, et al. Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced with a Chimeric Antigen Receptor Recognizing ERBB2[J]. Mol Ther, 2010, 18(4): 843-851. DOI:10.1038/mt.2010.24 |
| [4] |
Wegner A. Chimeric Antigen Receptor T Cells for the Treatment of Cancer and the Future of Preclinical Models for Predicting Their Toxicities[J]. Immunotherapy, 2017, 9(8): 669-680. DOI:10.2217/imt-2017-0028 |
| [5] |
Barrett D M, Grupp S A, June C H. Chimeric Antigen Receptor-and TCR-Modified T Cells Enter Main Street and Wall Street[J]. J Immunol, 2015, 195(3): 755-761. DOI:10.4049/jimmunol.1500751 |
| [6] |
Siegler E L, Wang P. Preclinical Models in Chimeric Antigen Receptor-Engineered T-Cell Therapy[J]. Hum Gene Ther, 2018, 29(5): 534-546. DOI:10.1089/hum.2017.243 |
| [7] |
Wegner A. Chimeric Antigen Receptor T Cells for the Treatment of Cancer and the Future of Preclinical Models for Predicting Their Toxicities[J]. Immunotherapy, 2017, 9(8): 669-680. DOI:10.2217/imt-2017-0028 |
| [8] |
Wu Y, Xu R, Jia K, et al. The Efficacy of Chimeric Antigen Receptor (CAR) Immunotherapy in Animal Models for Solid Tumors:A Systematic Review and Meta-analysis[J]. PLoS One, 2017, 12(11): e187902. |
| [9] |
Sanmamed M F, Chester C, Melero I, et al. Defining the Optimal Murine Models to Investigate Immune Checkpoint Blockers and Their Combination with Other Immunotherapies[J]. Ann Oncol, 2016, 27(7): 1190-1198. DOI:10.1093/annonc/mdw041 |
| [10] |
Cheadle E J, Hawkins R E, Batha H, et al. Natural Expression of the CD19 Antigen Impacts the Long-term Engraftment But Not Antitumor Activity of CD19-specific Engineered T Cells[J]. J Immunol, 2010, 184(4): 1885-1896. DOI:10.4049/jimmunol.0901440 |
| [11] |
Cheadle E J, Sheard V, Rothwell D G, et al. Differential Role of Th1 and Th2 Cytokines in Autotoxicity Driven by CD19-specific Second-generation Chimeric Antigen Receptor T Cells in a Mouse Model[J]. J Immunol, 2014, 192(8): 3654-3665. DOI:10.4049/jimmunol.1302148 |
| [12] |
Holzapfel B M, Wagner F, Thibaudeau L, et al. Concise Review:Humanized Models of Tumor Immunology in the 21st Century:Convergence of Cancer Research and Tissue Engineering[J]. Stem Cells, 2015, 33(6): 1696-1704. DOI:10.1002/stem.1978 |
| [13] |
Bhattacharya-Chatterjee M, Saha A, Foon K A, et al. Carcinoembryonic Antigen Transgenic mouse Models for Immunotherapy and Development of Cancer Vaccines[J]. Curr Protoc Immunol, 2008, 20: 20-28. |
| [14] |
Brentjens R J, Rivière I, Park J H, et al. Safety and Persistence of Adoptively Transferred Autologous CD19-targeted T Cells in Patients with Relapsed or Chemotherapy Refractory B-cell Leukemias[J]. Blood, 2011, 118(18): 4817-4828. DOI:10.1182/blood-2011-04-348540 |
| [15] |
Parkhurst M R, Yang J C, Langan R C, et al. T Cells Targeting Carcinoembryonic Antigen Can Mediate Regression of Metastatic Colorectal Cancer But Induce Severe Transient Colitis[J]. Mol Ther, 2011, 19(3): 620-626. DOI:10.1038/mt.2010.272 |
| [16] |
Hogan C J, Shpall E J, McNulty O, et al. Engraftment and Development of Human CD34(+)-enriched Cells from Umbilical Cord Blood in NOD/LtSz-scid/scid Mice[J]. Blood, 1997, 90(1): 85-96. |
| [17] |
Wang X, Qi Z, Wei H, et al. Characterization of Human B Cells in Umbilical Cord Blood-transplanted NOD/SCID Mice[J]. Transpl Immunol, 2012, 26(2-3): 156-162. DOI:10.1016/j.trim.2011.12.003 |
| [18] |
Walsh N C, Kenney L L, Jangalwe S, et al. Humanized Mouse Models of Clinical Disease[J]. Annu Rev Pathol, 2017, 12: 187-215. DOI:10.1146/annurev-pathol-052016-100332 |
| [19] |
王岩石, 田志刚. 免疫系统人源化小鼠的构建及其应用进展[J]. 中国免疫学杂志, 2016(3): 289-298. |
| [20] |
Tasian S K, Kenderian S S, Shen F, et al. Optimized Depletion of Chimeric Antigen Receptor T Cells in Murine Xenograft Models of Human Acute Myeloid Leukemia[J]. Blood, 2017, 129(17): 2395-2407. DOI:10.1182/blood-2016-08-736041 |
| [21] |
Kloss C C, Condomines M, Cartellieri M, et al. Combinatorial Antigen Recognition with Balanced Signaling Promotes Selective Tumor Eradication by Engineered T Cells[J]. Nat Biotechnol, 2013, 31(1): 71-75. DOI:10.1038/nbt.2459 |
| [22] |
Zah E, Lin M Y, Silva-Benedict A, et al. T Cells Expressing CD19/CD20 Bispecific Chimeric Antigen Receptors Prevent Antigen Escape by Malignant B Cells[J]. Cancer Immunol Res, 2016, 4(6): 498-508. DOI:10.1158/2326-6066.CIR-15-0231 |
| [23] |
Markley J C, Sadelain M. IL-7 and IL-21 are Superior to IL-2 and IL15 in Promoting Human T Cell-mediated Rejection of Systemic Lymphoma in Immunodeficient Mice[J]. Blood, 2010, 115(17): 3508-3519. DOI:10.1182/blood-2009-09-241398 |
| [24] |
连晶瑶, 丁苗慧, 秦国慧, 等. 免疫系统人源化小鼠模型的研究进展[J]. 中国比较医学杂志, 2017, 27(10): 113-119. |
| [25] |
李爽, 邹建玲, 鲁智豪, 等. 免疫系统人源化小鼠模型的建立、应用及挑战[J]. 中国医学前沿杂志:电子版, 2017, 9(10): 15-20. |
| [26] |
孙丽娜, 孙晨鸣, 赵勇. 免疫系统人源化小鼠模型的现状及应用[J]. 实验动物科学, 2012, 29(6): 52-55. |
| [27] |
陈冰, 刘昊川, 李龙云, 等. 人源化小鼠模型构建和应用的研究进展[J]. 吉林大学学报:医学版, 2018(3): 667-674. |
| [28] |
陈冰. 造血免疫系统人源化小鼠中人红细胞重建缺陷的机制研究[D]. 吉林大学, 2017.
|
| [29] |
Berger C, Sommermeyer D, Hudecek M, et al. Safety of Targeting ROR1 in Primates with Chimeric Antigen Receptor-modified T Cells[J]. Cancer Immunol Res, 2015, 3(2): 206-216. DOI:10.1158/2326-6066.CIR-14-0163 |
| [30] |
Künkele A, Taraseviciute A, Finn L S, et al. Preclinical Assessment of CD171-Directed CAR T-cell Adoptive Therapy for Childhood Neuroblastoma:CE7 Epitope Target Safety and Product Manufacturing Feasibility[J]. Clin Cancer Res, 2017, 23(2): 466-477. DOI:10.1158/1078-0432.CCR-16-0354 |
| [31] |
Kalaitsidou M, Kueberuwa G, Schutt A, et al. CAR T-cell Therapy:Toxicity and the Relevance of Preclinical Models[J]. Immunotherapy, 2015, 7(5): 487-497. DOI:10.2217/imt.14.123 |
 2018, Vol. 32
2018, Vol. 32