国务院《关于加快推进重要产品追溯体系建设的意见》[1]、国家食品药品监督管理总局《关于推动食品药品生产经营者完善追溯体系的意见》[2]、商务部等七部门《关于推进重要产品信息化追溯体系建设的指导意见》[3]等文件要求推进药品追溯体系建设,明确药品生产经营企业应承担药品追溯体系建设主体责任。但目前尚未出台具体实施细则。在此背景下,本研究分析了欧美药品追溯体系建设的做法和启示,研究设计了我国药品追溯方案和信息化架构,以供决策参考。
1 研究方法和思路本研究遵照相关法律法规和政策文件,借鉴欧美药品追溯经验,采用座谈会、走访重点单位、书面调研等方式广泛征集了药品生产经营企业、使用单位、监管部门、相关部委、相关协会、第三方技术机构等药品追溯体系方的需求和意见建议。综合各方需求,设计了我国药品追溯方案和信息化架构。
2 欧美药品追溯体系建设的做法和启示 2.1 明确追溯目的欧美在建设药品追溯体系时,首先确定建设目的。欧盟的建设目的是打击假药,美国的建设目的是保障药品供应链安全。
2.2 立法先行欧盟、美国都很重视药品追溯法律法规建设。欧盟2011年7月通过了《欧盟反伪造药品指令》(2011/62/EU)[4],明确要求为欧盟境内流通的每一份药品建立“可供验证其真实性”的安全档案,并要求建立统一的数据库,用于储存药品安全信息。美国在2013年11月27日由总统奥巴马签署颁布了《药物供应链安全法案》(DSCSA)[5],该法案要求其药品供应链上的企业(包括生产商、批发商/分销商、零售药房/配售点等)对药品进行一物一码序列化管理,记录交易相关信息。以上法案的颁布为欧美实施药品追溯奠定了法律基础。
2.3 根据建设目的设计追溯模式欧盟注重防止假药,因此其追溯模式为“一头一尾”模式,即:先由生产商/进口商对药品进行序列化,再由零售药房/配售点的药剂师在销售前验证药品的真实性,并在销售确认后把药品状态标记为“已售出”[6]。该模式的特点是不强制要求批发环节验证,而是由零售环节验证药品真假,从而达到打击假药的目的。
美国采用“全流程追溯”模式,但暂未规划建设统一的系统或平台。即:药品生产商在生产环节完成药品序列化工作,在出库环节把交易相关信息传递给一级批发商/分销商;一级批发商/分销商收到药品时,验证交易信息的准确性,在出库环节把交易相关信息传递给二级批发商/分销商;当药品到达二级批发商/分销商或零售药房时,都要执行与上面类似的操作。该模式的特点是在药品供应链的每一个环节都要进行交易信息验证,从而保障供应链安全。
2.4 明确追溯体系管理模式欧盟由经过授权的第三方组织管理药品追溯事宜,该第三方组织为2008年专门成立的药品验证系统指导委员会(EMVS)。在信息化方面,欧盟建立了欧洲统一的EMVS,该系统由欧洲中央枢纽、欧洲药品编码中心和各国国家药品验证系统构成。药品生产商和进口商把药品编码信息传递至欧洲药品编码中心,药品批发商/分销商和药房通过国家药品验证系统和欧洲中央枢纽连接欧洲药品编码中心进行验证,从而实现全欧盟药品追溯信息的互联互通。
美国DSCSA法案的主管政府部门是卫生和公共服务部(HHS)。美国FDA是HHS下属具体负责这个法案的机构,负责对企业提出追溯要求,提出具体的实施指南和规划时间表,发布相关标准。美国目前没有建立全国统一的追溯信息系统。
3 我国药品追溯方案设计 3.1 我国药品追溯体系建设目的由于目前相关法规和政策没有阐明我国追溯体系的建设目的,本研究根据调研和分析,将我国药品追溯体系建设目的定义为“保障药品供应链安全,促进购药安全”。
3.2 我国药品追溯方案总体概述药品生产经营企业和使用单位落实药品追溯主体责任,自建追溯系统或以第三方技术机构为支撑建立药品追溯体系,逐步实现药品从生产环节至零售环节追溯业务闭环。药品监管部门采集追溯数据,落实属地管理责任,借助大数据分析技术履行工作职责,提高工作效率。消费者通过信息查询服务,保障自身合法权益,行使社会监督权利。各药品追溯干系方通过药品追溯协同平台,实现追溯信息互联互通。
3.3 我国药品追溯业务流程设计为推动药品从生产环节至消费环节形成追溯业务闭环,本研究围绕建设目的设计我国药品追溯业务流程。综合考虑不同类型企业的需求,提出两个方案:
方案一,采用“入库环节来源验证加零售环节源头验证”模式。具体流程:药品生产企业在生产环节完成序列化工作,在出库环节将追溯相关信息传递给下游批发企业/物流企业;批发企业/物流企业收到药品时,需进行来源信息验证,并在出库环节将追溯相关信息传递给下游零售企业/使用单位;当药品到达终端零售企业/使用单位时,需验证来源信息,并在出库前验证源头信息。该模式的特点是强制要求在供应链各环节入库时进行来源信息验证,从而保障药品供应链安全;在终端环节出库前进行源头信息验证,从而促进购药安全。详见图 1。
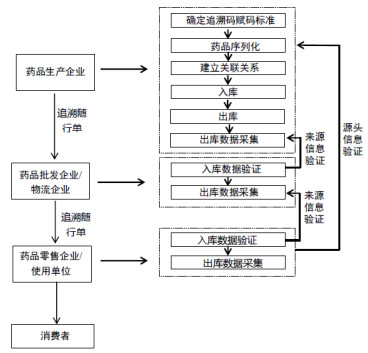
|
图 1 药品追溯业务流程图(方案一) |
方案二,采用“入库环节来源验证加零售环节售出标记”模式。方案二在生产环节和批发环节的流程与方案一相同,在零售环节有所区别,即:当药品到达零售企业/使用单位时,零售企业/使用单位需验证来源信息,并在销售后把每盒药品状态标记为“已售出”,且有义务在消费者提出要求时,配合消费者进行药品来源信息验证。该模式的特点是强制要求供应链各环节入库时进行来源信息验证和零售环节标记“已售出”,两项措施共同保障药品供应链安全;配合消费者进行源头信息验证,从而促进购药安全。详见图 2。
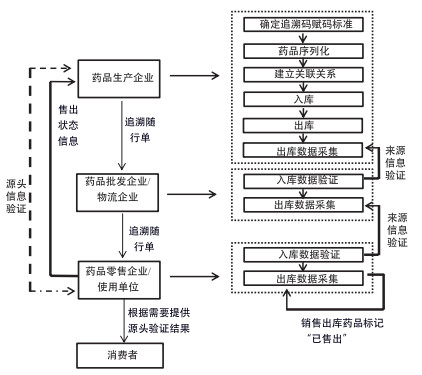
|
图 2 药品追溯业务流程图(方案二) |
两个方案的共同点是都可以保障药品供应链安全、促进购药安全,不同点是方案二覆盖供应链环节更完整,但零售环节的数据采集工作量和成本都比方案一高。因此,在企业座谈会上,生产企业普遍倾向于方案二,零售企业普遍倾向于方案一。
4 我国药品追溯信息化架构设计 4.1 我国药品追溯信息化架构概述为通过信息化手段实现以上追溯方案,本研究设计了我国药品追溯信息化架构:以多个企业自建或第三方技术机构建设的药品追溯业务系统为基础,以药品追溯信息安全体系和药品追溯信息标准体系为保障,以药品追溯协同平台为枢纽,实现药品追溯数据互联互通,支持追溯信息交换共享,支持社会公众信息查询;构建总局、省两级药品监控系统,支持药品监管工作。以上信息化架构概述:建设药品追溯业务系统、药品追溯协同平台、全国药品监控系统,即3个追溯信息系统;构建药品追溯信息安全体系和药品追溯信息标准体系,即2个保障体系;形成1个覆盖全国药品追溯干系方的药品追溯信息网络。见图 3。
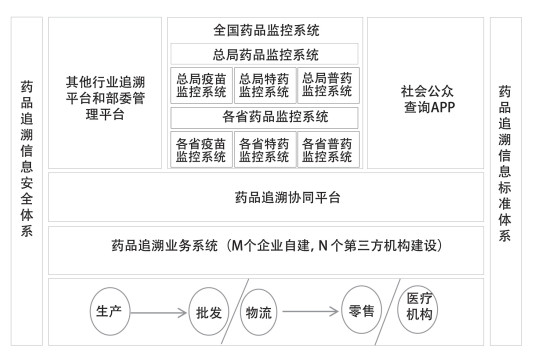
|
图 3 我国药品追溯体系信息化总体架构 |
药品追溯业务系统是满足药品生产经营企业和使用单位追溯业务需求的信息系统,由药品生产经营企业和使用单位自建或第三方技术机构建设。药品追溯业务系统主要功能包括药品追溯码管理、关联关系管理、入出库单管理、信息验证等。
4.3 药品追溯协同平台 4.3.1 药品追溯协同平台主要功能药品追溯协同平台是各个药品追溯业务系统实现信息互联互通的枢纽。其主要功能包括:1)主数据管理:管理机构、药品、人员、追溯设备设施等基础信息,支持与其他药品追溯业务系统同步基础信息。2)索引与查询服务:管理各机构追溯信息服务资源目录和药品生产企业编码资源目录,并提供索引和查询服务。例如,机构A可以通过协同平台查询机构B的信息服务资源地址并直接访问,从而实现信息互联互通。
4.3.2 药品追溯协同平台主要作用通过药品追溯协同平台的索引与查询功能,药品生产经营企业和使用单位可以完成追溯数据的层层传递,实现药品从生产至使用环节的追溯业务闭环;监管部门可以采集药品生产经营企业和使用单位报送的追溯数据,为大数据分析辅助监管决策奠定基础;其他药品追溯干系方可以实现信息资源交换和共享;此外,药品追溯协同平台还可用于辅助跨行业、跨部委的追溯信息交换。
4.4 全国药品监控系统 4.4.1 全国药品监控系统建设方案和主要功能通过与有关部门沟通和听取专家意见,本研究设计的全国药品监控系统由国家食品药品监管总局药品监控系统和省级药品监控系统构成。根据业务需求,两级药品监控系统可包括疫苗监控子系统、特殊药品监控子系统、普通药品监控子系统、统计分析子系统、智慧监管APP、数据交换子系统和药品监控数据中心。各级监管部门可根据职能,利用药品监控系统辅助开展监管工作,推动药品追溯业务属地管理。见图 4。

|
图 4 全国药品监控系统架构 |
根据总局和省局监管业务需要,建议两级药品监控数据中心分别采集和存储不同粒度的追溯业务数据。具体流程:企业自建或第三方技术机构建设的追溯业务系统存储最细粒度(码级)的追溯数据,同时将中等粒度(单据级)追溯业务数据报送至省级药品监控数据中心;省级药品监控数据中心将最粗粒度(批次级)追溯业务数据报送至总局药品监控数据中心。在实际工作中,总局和省级药品监控数据中心也可根据监管需求采集存储更细粒度数据。
5 结论本研究设计的我国药品追溯方案和信息化架构设计具有如下特点:
首先,厘清各追溯干系方职责,落实企业主体责任。本研究界定了药品追溯干系方定位和职责,落实药品生产经营企业承担追溯体系建设主体责任,支持企业自建或通过第三方机构建设药品追溯体系。监管部门不再直接参与追溯业务,而是由总局制定政策法规和指导意见,地方政府监督执行,推动属地管理。
其次,实现药品追溯闭环,保障药品供应链安全。本研究设计了两个追溯业务流程方案供决策参考,两个方案在零售标记和源头验证方面有所差别,但都能实现覆盖生产、批发、零售环节的追溯闭环,做到来源可溯、去向可查、责任可追,保障药品供应链安全。
第三,强化药品信息验证,促进购药安全。在设计的追溯流程中,重点强调了药品信息来源验证和源头验证。通过信息验证,可以避免假药被消费者购买,从而促进购药安全。
第四,设计药品追溯协同平台,实现各追溯业务系统间的信息交换。本课题设计了通过全国唯一的药品追溯协同平台提供全国各企业药品追溯业务系统地址统一存储和发布等信息服务的方案,可支持多个追溯业务系统间的数据互联互通。
第五,充分利用追溯数据,提升监管能力和水平。本研究设计了从药品生产经营企业经省级监管部门至总局的追溯数据纵向归集。监管部门可通过采集药品全流向追溯数据,实现对药品供应链全过程管理,通过分析利用追溯数据,可以辅助开展监管工作,提高监管效能。
| [1] |
国务院办公厅. 关于加快推进重要产品追溯体系建设的意见[EB/OL]. (2016-01-12)[2017-08-15]. http://www.gov.cn/zhengce/content/2016-01/12/content_10584.htm.
|
| [2] |
国家食品药品监督管理总局. 关于推动食品药品生产经营者完善追溯体系的意见[EB/OL]. (2016-09-27)[2017-08-15]. http://www.sfda.gov.cn/WS01/CL0852/164862.html.
|
| [3] |
商务部, 工业和信息化部, 公安部等七部委. 关于推进重要产品信息化追溯体系建设的指导意见[EB/OL]. (2017-02-16)[2017-08-15]. http://file.mofcom.gov.cn/article/gkml/201702/20170202521411.shtml.
|
| [4] |
European Union. 2011/62/EU[EB/OL]. (2011-06-08)[2017-08-15]. https://ec.europa.eu/health/sites/health/files/files/eudralex/vol-1/dir_2011_62/dir_2011_62_en.pdf.
|
| [5] |
FDA. Drug Supply Chain Security Act(DSCSA)[EB/OL]. (2013-11-27)[2017-08-15]. https://www.fda.gov/drugs/drugsafety/drugintegrityandsupplychainsecurity/drugsupplychainsecurityact/default.htm.
|
| [6] |
黄薇薇, 华佳. 国外药品追溯体系对我国的启示[J]. 中国药事, 2016, 30(12): 1232-1236. |
 2018, Vol. 32
2018, Vol. 32 