药品有效期是指药品在一定的贮存条件下,能够保持其质量的期限[1]。但在药品实际储存和使用过程中,某些制剂在使用前需要经过复配,还有一些多剂量包装制剂在开启后的整个使用过程中会被反复开启。药品经复配或开启后,原有的稳定性会受到一定影响,并需要在一定期限内使用。这个期限不同于药品有效期,而且通常短于药品有效期,有文献报道将其称为药品的“使用期限” [2-3]。2015年,国家食品药品监督管理总局(CFDA)发布的《化学药物(原料药和制剂)稳定性研究技术指导原则》中要求“对临用现配制剂,或是多剂量包装开启后有一定使用期限的制剂,应根据其具体的临床使用情况,进行配伍稳定性试验或开启后使用的稳定性试验” [4]。《中国药典》2015年版四部中收录的《原料药物和制剂稳定性试验指导原则》也指出“有些药物制剂还应考察临用时配制和使用过程中的稳定性” [5],其目的是完善药品说明书中使用期限的有关信息,保证药品在使用过程中的质量与安全。本研究对我院2017年所有在用药品的说明书进行了整理,对其中临用现配制剂和多剂量包装制剂说明书中药品使用期限的标注情况进行调查和分析,了解相关原则中有关要求的执行和落实情况;同时为药师、护师等卫生专业技术人员和公众在使用临用现配制剂和多剂量包装制剂时,对复配或开启后药品的使用期限管理提供参考和建议。
1 资料与方法通过我院信息系统筛选2017年所有在用药品,逐份审阅药品说明书,对其中临用现配制剂和多剂量包装制剂说明书中药品使用期限的标注率、使用期限在说明书的项目分布以及使用期限时长分布等信息进行调查和分析。药品剂型参照《中国药典》2015年版制剂通则中的分类。
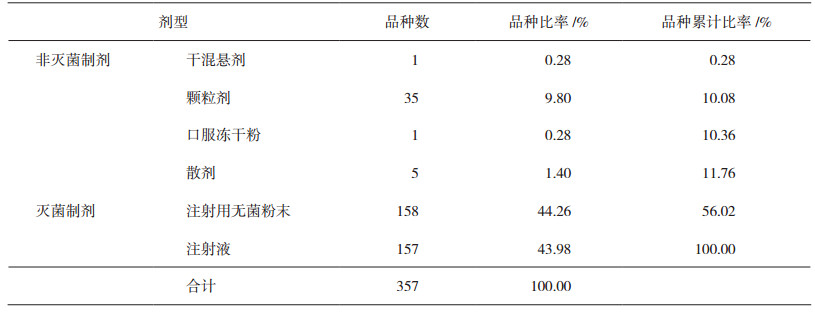
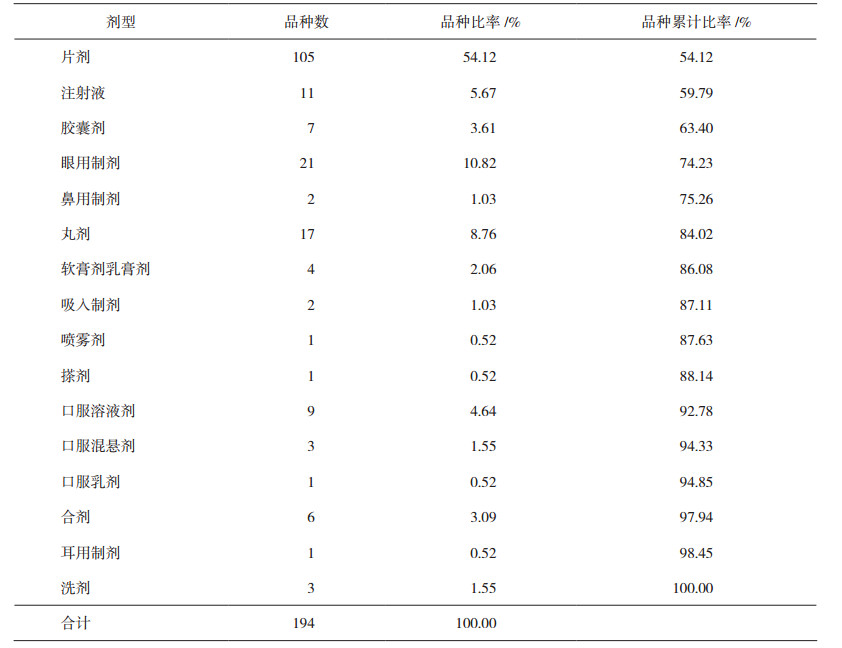
2 结果 2.1 品种与剂型分布2017年,我院在用药品共1047种。其中,临用现配制剂和多剂量包装制剂共551种:临用现配制剂357种,多剂量包装制剂共194种,具体情况见表 1、表 2。
|
|
表 1 临用现配制剂的品种数与剂型分布 |
|
|
表 2 多剂量包装制剂的品种数与剂型分布 |
在551种临用现配制剂和多剂量包装制剂中,说明书标注使用期限的药品共有135种,总标注率为24.50%。其中,临用现配制剂357种,标注的药品有109种,占30.53%;多剂量包装制剂194种,标注的药品有26种,占13.40%。具体情况见表 3。
|
|
表 3 临用现配和多剂量包装制剂说明书中药品使用期限的标注情况 |
在标注使用期限的药品说明书中,使用期限的相关信息分布在6个项目中,具体情况见表 4。
|
|
表 4 药品使用期限在说明书项目中的分布 |
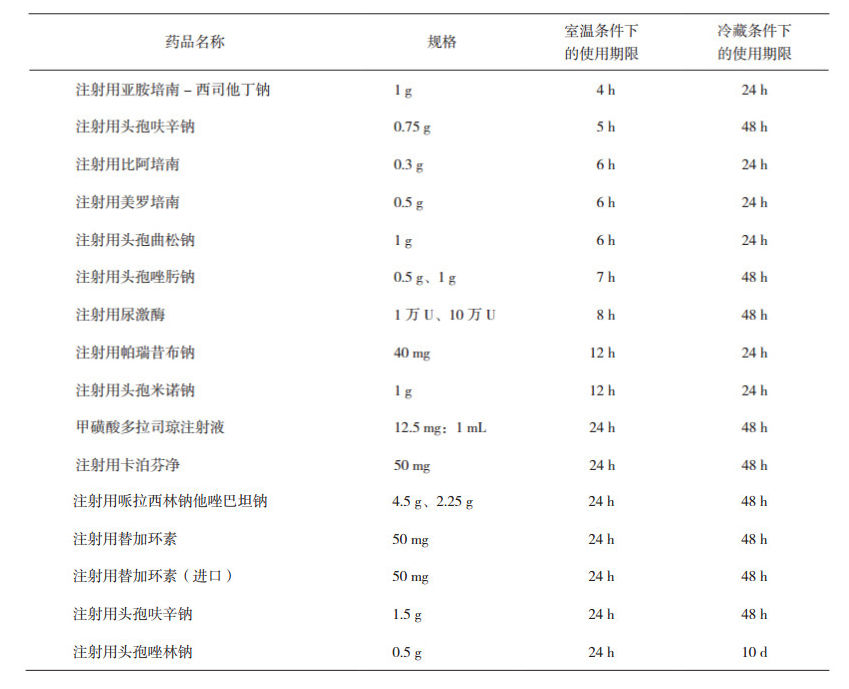
109种标注使用期限的临用现配制剂说明书中,88种标注了单一贮藏条件下(室温或冷藏)的使用期限(见表 5);19种标注了室温和冷藏2种贮藏条件下的使用期限(见表 6)。另外,阿莫西林钠克拉维酸钾针(1.2 g/支)分别标注了静脉注射和静脉滴注2种浓度下的使用期限(分别为20 min和4 h),注射用奥美拉唑(40 mg/支)分别标注了5%葡萄糖注射液和0.9%氯化钠注射液两种溶媒中的使用期限(分别为6 h和12 h)。
|
|
表 5 临用现配制剂使用期限时长分布情况(单一贮藏条件) |
|
|
表 6 临用现配制剂使用期限时长分布情况(室温和冷藏2种贮藏条件下) |
26种多剂量包装制剂使用期限的标注情况见表 7。
|
|
表 7 多剂量包装制剂使用期限(时长)标注情况 |
本文调查结果显示,2017年我院临用现配制剂和多剂量包装制剂说明书中使用期限的标注率较低。鉴于临用现配制剂在复配后,不同药物之间、药物和溶媒之间可能产生各种化学物理变化,且复配过程可能增加被微生物污染的风险;而多剂量包装制剂从首次开启到使用完毕,整个过程中药品会被反复开启和关闭,微生物污染、增殖以及物理化学降解等方面的风险也都会相应的增加[6]。原欧洲药品评价局专利药物委员会(EMEA/ CPMP)在1998年发布的《人用无菌药品首次开启后或复溶后的最大保存限期指南》(Maximum Shelf-Life for Sterile Products for Human Use after First Opening or Following Reconstitution, CPMP/QWP/159/96 corr)中指出,由于药品在打开、稀释、复溶、储存等情况下的条件难以预测,药品注册申请者(Applicant)应进行适当的研究,并在说明书、标签等中提供药品使用期限(Utilization Period)的有关信息[7]。对于多剂量包装药品,EMEA/ CPMP在2001年发布的《人用药品使用期间稳定性试验指南》(Note for Guidance on In-Use Stability Testing of Human Medicinal Products, CPMP/QWP/2934/99)中要求药品注册申请人应在多剂量药品的注册申请材料中包含基于使用期间稳定性数据的药品使用期限(InUse Shelf Life),如若不建立使用期限,则应当给出基于试验数据的正当理由[8]。所以,药品研发和生产企业对这些药品进行使用期间的稳定性研究,在说明书中标注使用期限的相关信息是非常必要的。我国有关原则中虽然对药品使用期间稳定性做出了要求,但没有规定具体的稳定性试验方法和考核方案,缺乏一定的指导性和操作性。目前已经有文献对药物使用期间稳定性试验的技术要求进行了探讨[6]。建议药品监督管理部门及其技术支持部门不断完善相关要求和标准,同时,药品生产企业应积极对照落实,逐步完善药品说明书中使用期限的相关信息。
3.2 药品使用期限的管理 3.2.1 临用现配制剂使用期限的管理从表 5、表 6可知,在109种标注了使用期限的临用现配制剂中,脂溶性维生素(Ⅱ)注射液等91种药品明确规定了使用期限的长短。对于这些药品,应严格按照说明书中的规定进行期限管理。另外,鸦胆子油乳注射液等18种药品虽然没有在说明书中规定具体的使用期限,但是强调药品应“即用即配”“需新鲜配制”或“溶解后立即使用”等。对于这些药品,建议应即用即配,尽早应用于患者。对于其他没有在说明书中标注使用期限的临用现配制剂,目前我国在《病区医院感染管理规范》中规定:“抽出的药液和配制好的静脉输注用无菌液体,放置时间不应超过2 h” [9]。因此,在病区配制的药品,除药品说明书另有规定外,放置时间不应超过2 h。另外,越来越多的医疗机构开展了静脉药物集中调配服务(Pharmacy Intravenous Admixture Services,PIVAS),与传统的病区药品配制相比,PIVAS有着更高洁净度和无菌操作保障[10-11],但对于PIVAS配制药品的使用期限目前国内还没有明确规定和要求,也没有相关方面的研究。建议卫生和药品行政管理部门能够尽快组织出台相关的管理标准。各医疗机构PIVAS也应重视临用现配制剂使用期限的管理问题,尽可能地优化配制流程、合理安排调配顺序、缩短配送时间。同时,应注重与护理人员的沟通和宣教,为其树立使用期限管理的概念,以保证集中调配的静脉药物能尽早的应用于患者[12-14]。
3.2.2 多剂量包装制剂使用期限的管理通过表 3、表 7可知,26种标注了使用期限的多剂量包装制剂中,眼用制剂和胰岛素类注射液有23种,占88.46%,而片剂、口服溶液剂和口服乳剂仅有3种,仅占11.54%。对于以上品种开启后,应严格按照说明书的贮藏要求和使用期限进行管理。另外,《中国药典》2015年版四部在制剂通则中对于眼用制剂、耳用制剂和鼻用制剂做出了“在启用后使用期最多不超过4周”的规定[5]。因此,对于这3种剂型,除说明书另有规定外,开启后的使用期限不应超过4周。对于其他说明书中没有标注使用期限信息的多剂量包装制剂,国内目前并没有关于其开启后使用期限管理的明确规定。有文献认为,对于非注射剂型多剂量包装制剂,在按规定贮藏和正规操作使用的情况下,开启后的使用期限可按照原有效期或者参照原有效期进行管理,但当药品出现变质现象,就应该放弃使用[3]。
3.3 药师对使用期限管理的责任与义务使用期限管理对保证药品安全、有效有着非常重要的意义,药师应在其中发挥重要作用。美国药典(USP)就将使用期限(Beyond-Use Date,BUD)定义为一个调剂术语[15],并要求药师在调剂药品时应根据生产企业和药典凡例提供的信息在标签上标注适宜的使用期限以限制病人对药品的使用。USP还在通则(General Information) < 1191>《调剂实践中的稳定性考虑》(Stability Considerations In Dispensing Practice)中系统地阐述了药师在调剂实践中药品稳定性方面的权利和责任、影响药品稳定性的因素以及常见剂型失效的辨别方法[16]。另外,EMEA/ CPMP在《人用无菌药品首次开启后或复溶后的最大保存限期指南》中也指出:混合或稀释后的药品如不能立即使用,使用者(User)应对药品的使用期限和贮存条件负责[7]。由此可以看出药师在使用期限管理中应肩负的责任。所以,药师应具备药物稳定性的基本知识,掌握常见剂型失效的辨别方法,并做好对医护人员和公众相关知识的指导和宣传,保证药品在使用过程中的安全性和有效性。
| [1] |
关于颁布执行《中华人民共和国药典》2000年版的通知[J]. 中国药品标准, 2000, (2): 5-6.
|
| [2] |
徐敢. 我国药品说明书中已启用药品使用期限标示缺项问题分析[J]. 中国药物警戒, 2017, 14(2): 95-98. |
| [3] |
徐敢, 张石革. 非注射剂型多剂量制剂启用后的使用期限和用药安全管理[J]. 药物不良反应杂志, 2016, 18(5): 352-355. |
| [4] |
国家食品药品监督管理总局. 化学药物(原料药和制剂)稳定性研究技术指导原则[EB/OL]. (2015-02-05)[2017-12-26]. http://www.sda.gov.cn/WS01/CL1616/114289.html.
|
| [5] |
国家药典委员会. 中国药典: 四部[S]. 2015: 通则.
|
| [6] |
陈海峰. 药物使用期间稳定性试验的技术要求探讨[J]. 中国新药杂志, 2010(3): 184-189. |
| [7] |
The European Agency for the Evaluation of Medicinal Products. Maximum Shelf-Life for Sterile Products for Human Use after First Opening or Following Reconstitution[EB/OL]. (2001-03-01)[2018-01-01]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000783.jsp&mid=WC0b01ac0580028eb1.
|
| [8] |
The European Agency for the Evaluation of Medicinal Products. Note for Guidance on In-Use Stability Testing of Human Medicinal Products[EB/OL]. (2001-03-01)[2018-01-01]. http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003475.pdf.
|
| [9] |
中华人民共和国国家卫生和计划生育委员会. 病区医院感染管理规范[EB/OL]. (2017-01-17)[2018-01-01]. http://www.moh.gov.cn/ewebeditor/uploadfile/2017/01/20170119150408703.pdf.
|
| [10] |
方阅, 寿佳慧, 方敏. 建立静脉药物配置中心的必要性[J]. 肠外与肠内营养, 2005, 12(5): 315-316. |
| [11] |
甄健存, 何绥平, 万杰. 静脉药物集中配制及其在安全用药中的意义[J]. 药物不良反应杂志, 2004, 6(5): 297-299. |
| [12] |
杜彦秋. 静配中心输液配送限速因素分析及改进措施[J]. 中国卫生标准管理, 2017(23): 10-12. DOI:10.3969/j.issn.1674-9316.2017.23.005 |
| [13] |
方水凉, 邱杏桃, 杨彩虹. 品管圈在缩短静配中心首批输液送到临床科室等候时间中的作用[J]. 中国卫生标准管理, 2017(23): 14-16. DOI:10.3969/j.issn.1674-9316.2017.23.007 |
| [14] |
陈迹, 米文杰, 杨海苓. 某院静脉用药调配中心利用质量管理工具干预成品输液使用效果分析[J]. 新疆医科大学学报, 2014(7): 910-912. |
| [15] |
US Food and Drug Administration. Questions and Answers on Current Good Manufacturing Practices, Good Guidance Practices, Level 2 Guidance-Laboratory Controls[EB/OL]. (2015-06-17)[2018-01-01]. http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm124785.htm#6.
|
| [16] |
United States Pharmacopeial Convention. USP40-NF35[S]. Rockille, United States Pharmacopeial Convention, Inc, 2015: 1662-1666.
|
 2018, Vol. 32
2018, Vol. 32