2. 锦州医科大学, 锦州 121000
2. Jinzhou Medical University, Jinzhou 121000, China
地高辛(Digoxin,DG)为洋地黄类强心苷,能有效地增强心肌收缩力,减慢心率,抑制心脏传导,临床上广泛用于治疗充血性心力衰竭、慢性心力衰竭、室上性心动过速、心房颤动和扑动等心脏疾病[1-2]。然而,地高辛的有效治疗范围窄,一般有效浓度范围仅为0.50~2.00 ng·mL-1[3]。且治疗剂量与中毒剂量在一定程度上相互重叠,容易发生中毒反应。地高辛在体内代谢缓慢,长期应用容易发生蓄积中毒[4]。地高辛中毒的发生与血药浓度密切相关,因此,可通过监测血药浓度来预防地高辛中毒的发生,这是目前被临床医生及患者普遍认可的有效方法[5]。地高辛血药浓度监测常用的方法有放射免疫测定法(RIA)[3]、微粒子酶联免疫测定法(MEIA)[6]、荧光偏振免疫测定法(FPIA)[7]、化学发光免疫测定法(CLIA)[8]、高效液相色谱法(HPLC)[9]、高效液相色谱-质谱联用分析法(HPLC-MS)[10]等。但上述检测方法或检测时间长,或易受代谢产物或本底荧光的干扰,或是所用仪器较复杂,设备昂贵,或是有放射性污染等缺点,因此,需要建立一种新的DG血药浓度检测方法。
近些年,将纳米材料应用于电化学传感器技术一直是传感器领域的研究热点,电化学传感器具有仪器简单、检测快速、选择性高且成本低廉等优点,在药品检测和食品质量检测方面显示出优异的性能[11-12]。石墨烯材料由于其高比表面积、优异的化学稳定性、机械和电学性能以及大规模生产化学改性石墨烯的可行性,而被研究作为有效的传感材料[13]。本研究利用简单的方法,通过在腺嘌呤存在下冷冻干燥氧化石墨烯溶液来制造腺嘌呤功能化的海绵状石墨烯(FSG),抑制了石墨烯片的重新堆叠,使石墨烯片3D互连且具有多孔结构。这种3D排列的结构使得暴露的边缘平面缺陷,并导致最佳的电荷转移/电极动力学,与未改性的石墨烯相比,FSG修饰的传感器可改善电化学响应,提高检测性能。
本试验首次探讨了FSG在丝网印刷电极中的潜在应用,研究了FSG修饰电极的电化学行为表征、pH的选择、干扰测定,并建立了DG检测的标准曲线,最后应用于临床采集血液样本中DG的血药浓度检测,并与FPIA法测定结果比较,探讨本方法在实际应用中的可行性。
1 试验方法 1.1 试剂DG标准品(批号:140420,北京万佳首化生物科技有限公司),腺嘌呤(批号:PCS3059,广州市齐云生物技术有限公司)。DG系列标准溶液采用伯瑞坦-罗宾森(Britton-Robinson,BR)缓冲液制备,地高辛检测试剂盒(批号:1642954,Newark USA SIEMENS公司),地高辛定标液(批号:1631575,Newark USA SIEMENS公司),地高辛质控试剂盒(批号:1512039,Newark USA SIEMENS公司),其他试剂均为分析纯。
1.2 仪器与方法冷冻干燥器(上海兰仪实业有限公司,FD- 1A-80),高压反应釜为聚四氟乙稀内衬(上海坦泽仪器设备有限公司,KH-50 mL),采用JEOL型JSM6335F场发射扫描电子显微镜(FE-SEM)进行产品表征,所有电化学测量均在电化学工作站(CHI650D)上完成,使用的三电极系统由工作电极、银参比电极和对电极组成。Viva-E全自动生化分析仪(荷兰Vital Scientific BV)。参比方法FPIA所测数据由Architect 1000 SR型荧光偏振免疫分析仪(美国雅培公司)检测。
1.3 功能化海绵状石墨烯(FSG)和功能化海绵状氧化石墨烯(FSGO)的制备本研究采用改良Hummer方法以天然石墨为原料制备海绵状氧化石墨烯(SGO)[14],制得的产品用冷冻干燥器于-53 ℃,10 Pa下干燥3天以除去水分。功能化的海绵状氧化石墨烯(FSGO)的制备方法:将0.1 g海绵状氧化石墨烯(SGO)分散在10 mL蒸馏水中,然后加入0.3 g腺嘌呤和0.1 g NaOH,搅拌24 h使其混合均匀。将产生的沉淀离心(10000 r·min-1,10 min),用水-乙醇混合物充分洗涤,最后在60 ℃下干燥,即得FSGO。功能化石墨烯(FSG)是以FSGO为原料经水热还原制备得到,将20 mg的FSGO粉末加入到30 mL蒸馏水中,超声(功率:240 W,频率:40 kHz)30 min后得到均匀分散液,然后转移到50 mL高压反应釜中,于170 ℃加热8 h,得到的产品用蒸馏水洗3次,放于60 ℃的烘箱中干燥,即得FSG样品[15]。所制备的SGO、FSG以及FSGO均采用扫描电镜进行形态表征。
1.4 电极的制备称取一定量的SGO、FSG和FSGO粉末,分别加到蒸馏水中并超声(功率:240 W,频率:40 kHz)30 min,得到浓度为0.5 mg·mL-1的分散液。将10 mL的SGO、FSG和FSGO溶液分别均匀涂布于丝网印刷电极(SPE)表面,得到3种修饰电极:SGO修饰电极、FSG修饰电极和FSGO修饰电极,在三电极系统中作为工作电极使用。
1.5 血液样品的采集收集我院2017年10月-2017年11月接受地高辛治疗患者的血样10例,男6例,女4例,年龄42~80岁,采集稳态谷浓度血样6 mL,离心分离取上层血浆,分成2份,分别采用FSG修饰电极和FPIA法进行测定。
1.6 分析方法的建立将制备的电极与银参比电极和对电极组成三电极系统,采用循环伏安扫描(CV)研究电极的电化学行为以及选择BR缓冲液的pH值,采用方波伏安扫描(SWV)建立工作电极的标准曲线以及检测电极性能。
2 结果与讨论 2.1 形态表征图 1为制备的SGO、FSGO和FSG的SEM图。图 1A表明制备的SGO层数较多,这可能是由于在SGO的表面形成了氧基团。加入腺嘌呤后,FSGO层数随着体积的增加而稍有剥落(图 1B),并形成薄片皱边。图 1C表明FSG的3D结构是由皱折的氧化石墨烯(GO)片材相互连接而形成的。

|
图 1 扫描电镜图 A. SGO;B. FSGO;C. FSG;标尺为1 μm。 |
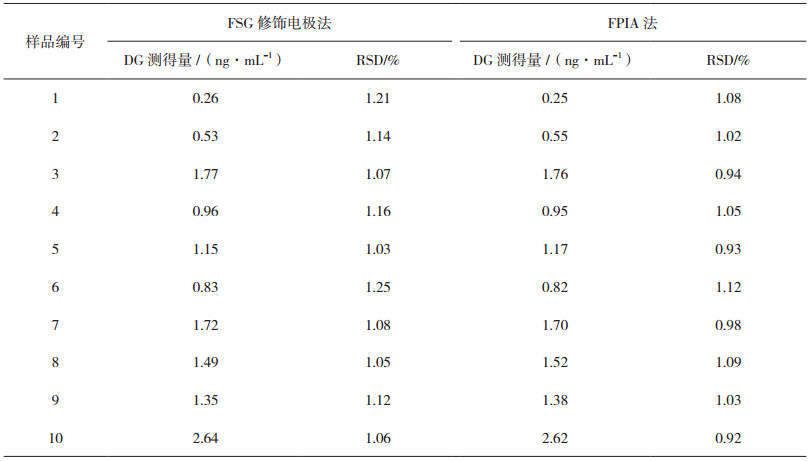
图 2为裸电极(b)、SGO修饰电极(c)、FSGO修饰电极(d)和FSG修饰电极(e)在10.0 μg·mL-1的DG溶液中的CV图,以及FSG修饰电极在空白溶液中的CV图(a)。由图 2a可知,在没有DG存在情况下,未产生阳极或阴极峰电流,因此,FSG修饰电极在所选择的电位范围内(0~1.2 V)没有产生响应。在10.0 μg·mL-1的DG溶液中,裸电极(b)在0.85 V下的阳极峰电流值为36.4 μA,该峰即为DG的氧化峰。SGO修饰电极(c)的阳极峰电流值相对于裸电极有所升高,电流值为43.2 μA。用FSGO修饰SPE后(d),阳极峰电流值有所升高,为49.5 μA。FSG修饰电极(e)的阳极峰电流值达到了最大,在0.76 V时为69.5 μA。由此可知,FSG修饰电极在DG溶液中的电化学响应优于SGO修饰电极和FSGO修饰电极,因此,本试验主要对FSG修饰电极的性能进行研究,并应用于实际样品中DG的检测。
|
图 2 CV图 a. FSG修饰电极在空白溶液中的CV图;b.裸电极在10.0 μg·mL-1 DG溶液中的CV图;c. SGO修饰电极在10.0 μg·mL-1 DG溶液中的CV图;d. FSGO修饰电极在10.0 μg·mL-1 DG溶液中的CV图;e. FSG修饰电极在10.0 μg·mL-1 DG溶液中的CV图。 |
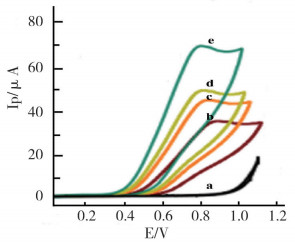
采用CV法研究缓冲液pH值对DG电化学氧化峰的影响。将FSG修饰电极依次浸入到pH 2.0~9.0的10.0 μg·mL-1的DG溶液中进行CV扫描,得到各个pH所对应的CV图,如图 3所示:随着pH逐渐升高,DG氧化峰电位值逐渐左移,且当pH≤7.0时,氧化峰电流值是逐渐增加的,pH为7.0时,氧化峰电流值达到最大。因此,pH 7.0时电极检测时的电化学性能最佳,是用于测定DG的最佳pH值。
|
图 3 FSG修饰电极在pH 2.0 ~ 9.0的10.0 μg·mL-1 DG溶液中的CV图(扫描速率为0.1 V·s-1) |
使用FSG修饰电极对不同浓度的DG溶液进行方波伏安扫描(SWV),结果如图 4所示。随着DG浓度的增加,峰电流值逐渐增大,且两者呈线性相关,其线性范围为0.01~100 ng·mL-1,线性方程:Ip(μA)= 0.256 C(ng·mL-1)+3.09,R2=0.999。计算其检测下限为5.76×10-3 ng·mL-1。重复性的测定结果为1.16%。FSG修饰电极在DG检测中表现出较好的分析性能,且检出限低。

|
图 4 FSG修饰电极在不同浓度的DG溶液(0.01~100 ng·mL-1)中的SWV图(扫描速率为0.1 V·s-1) |
对药物制剂中和其他可能干扰DG检测的离子进行了干扰测定,主要选择了几种常见的干扰物:聚维酮、微晶纤维素、淀粉、纤维素、山梨酸钾、硬脂酸、滑石粉、硬脂酸镁、胶体二氧化硅、交联羧甲基纤维素钠、Na+、K+、Zn2+、Mg2+、Ca2+。将这些干扰物质加入到浓度为1.0 ng·mL-1的DG溶液中,使用FSG修饰电极对DG进行电化学测定,结果表明:上述干扰物质对DG的电化学检测均未造成干扰。因此,所制备的FSG修饰电极可适用于生物液体和药物剂型中DG的常规分析。
2.6 重现性和稳定性对同时制备的8个FSG修饰电极的DG峰电流值进行测定,计算得电极之间的RSD为2.65%;对1.0 ng·mL-1的DG溶液连续测定8次,所得RSD为1.36%,表明该电极重现性较好。测定了电极制备第三周的峰电流值,其值为第一周的96.77%,说明该电极的检测性能较为稳定。
2.7 在实际样品中的应用为了检测FSG修饰电极在实际样品中测定DG的可行性,使用该电极对10份血浆样品进行了测定,并与FPIA法检测结果比较。结果如表 1所示,FSG修饰电极测得的DG较为准确,与FPIA法相比无显著性差异。
|
|
表 1 FSG修饰电极与FPIA法对血浆中DG测量结果的比较 |
使用FSG修饰电极对DG的电化学检测表现出了较宽的线性范围(0.01~100 ng·mL-1)和较低的检测限(5.76×10-3 ng·mL-1),且不受药物制剂和血浆中其他物质的干扰,对血浆中DG的定量检测结果与FPIA法相差无异。相比其他仪器分析,所制备的FSG修饰电极检测快速,携带方便,成本低廉,并能避免使用有机溶剂,较为经济环保。FSG修饰电极有潜力成为一种方便快捷的临床分析技术。
| [1] |
Eisen A, Ruff C T, Braunwald E, et al. Digoxin Use and Subsequent Clinical Outcomes in Patients with Atrial Fibrillation Without Heart Failure in the ENGAGE AFTIMI 48 Trial[J]. J Am Heart Assoc, 2017(6): e006035. |
| [2] |
Farr T, Petersen A, McKenna M. Effects of an Acute Oral Dose of Digoxin on Plasma K+ Regulation, Muscle Performance and Excitability During and Following Highintensity Cycling[J]. Journal of Science and Medicine in Sport, 2017, 20: e17. |
| [3] |
Ambrosy A P, Gheorghiade M. Targeting Digoxin Dosing to Serum Concentration:Is the Bullseye Too Small?[J]. European Journal of Heart Failure, 2016, 18(8): 1082-1084. DOI:10.1002/ejhf.589 |
| [4] |
Chung M H, Wang Y W, Chang Y L, et al. Risk of Cancer in Patients with Heart Failure Who Use Digoxin:a 10-year Follow-up Study and Cell-based Verification[J]. Oncotarget, 2017, 8(27): 44203-44206. |
| [5] |
Adams K F, Butler J, Patterson J H, et al. Dose Response Characterization of the Association of Serum Digoxin Concentration with Mortality Outcomes in the Digitalis Investigation Group Trial[J]. European Journal of Heart Failure, 2016, 18(8): 1072-1081. DOI:10.1002/ejhf.584 |
| [6] |
Durazo-Arvizu R A, Dawson-Hughes B, Kramer H, et al. The Reverse J-Shaped Association Between Serum Total 25-Hydroxyvitamin D Concentration and All-Cause Mortality:The Impact of Assay Standardization[J]. American Journal of Epidemiology, 2017, 185(8): 720-726. DOI:10.1093/aje/kww244 |
| [7] |
Sibl A, Hrudikova-Vyskocilova E, Kacirova I, et al. Pharmacokinetic Interaction Between Digoxin and Amiodarone[J]. Clinical Therapeutics, 2017, 39(8): e82. |
| [8] |
Wang Y, Li J, Wang X, et al. Diltiazem Augments the Influence of MDR1 Genotype Status on Cyclosporine Concentration in Chinese Patients with Renal Transplantation[J]. Acta Pharmacologica Sinica, 2015, 36(7): 855-862. DOI:10.1038/aps.2015.6 |
| [9] |
Sibl A, Hrudikova-Vyskocilova E, Kacirova I, et al. Pharmacokinetic Interaction Between Digoxin and Amiodarone[J]. Clinical Therapeutics, 2017, 39(8): e82. |
| [10] |
Li X, Wang Y, Zhou Q, et al. A Sensitive Method for Digoxin Determination Using Formate-adduct Ion Based on the Effect of Ionization Enhancement in Liquid Chromatograph-mass Spectrometer[J]. Journal of Chromatography B, 2015, 978: 138-144. |
| [11] |
Li Y, He J, Niu Y, et al. Ultrasensitive Electrochemical Biosensor Based on Reduced Graphene Oxide-tetraethylene Pentamine-BMIMPF6 Hybrids for the Detection of α2, 6-sialylated Glycans in Human Serum[J]. Biosensors & Bioelectronics, 2015, 74: 953-959. |
| [12] |
Karimi F, Shojaei A F, Tabatabaeian K, et al. CoFe2O4 Nanoparticle/Ionic Liquid Modified Carbon Paste Electrode as an Amplified Sensor for Epirubicin Analysis as an Anticancer Drug[J]. Journal of Molecular Liquids, 2017, 242: 685-689. DOI:10.1016/j.molliq.2017.07.067 |
| [13] |
Beitollahi H, Garkani Nejad F. Graphene Oxide/ZnO Nano Composite for Sensitive and Selective Electrochemical Sensing of Levodopa and Tyrosine Using Modified Graphite Screen Printed Electrode[J]. Electroanalysis, 2016, 28(9): 2237-2244. DOI:10.1002/elan.201600143 |
| [14] |
Park S, Ruoff R S. Chemical Methods for the Production of Graphenes[J]. Nature nanotechnology, 2009, 4(4): 217-224. DOI:10.1038/nnano.2009.58 |
| [15] |
El-Gendy D M, Ghany N A A, El Sherbini E E F, et al. Adenine-functionalized Spongy Graphene for Green and High-Performance Supercapacitors[J]. Scientific Reports, 2017(7): 43104. |
 2018, Vol. 32
2018, Vol. 32