2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
能力验证(Proficiency Testing)即利用实验室间比对[1],按照预先制定的准则评价参加者的能力,是实验室质量保证体系中的一个重要环节[2]。通过参加能力验证活动可以评价实验室的检测水平,满足监管机构和认证机构的要求,锻炼技术人员的操作能力,促进实验室认可和国内外的技术交流[3-5]。
核磁共振是根据处在某个静磁场中的物质原子核系统当受到相应频率的电磁波作用时,在它们的磁能级间产生共振跃迁的原理而采取的一种新技术[6-7]。核磁共振技术是原料药结构确认的重要手段之一,利用药物分子中原子的杂化方式及所处的环境的差异,因产生共振时吸收电磁波的频率不同,在图谱上出现的位置也不同,各种原子的这种差异被称为化学位移。利用化学位移、峰面积和积分值以及耦合常数等信息,可以推测其在化合物骨架上的位置[8-10]。其中13C、1H信号峰的测定以及化学位移的确定是核磁定性检测的重要指标。因此,利用标准物质考察核磁共振定性测定中信号峰数量和化学位移的精度可以基本反映仪器的工作状态、操作者的实验能力和实验室的检测水平。
本项目发放经过批准的国家药品标准物质,依据《中国药典》2015年版四部通则0441核磁共振波谱法作为标准进行测定[11]。参照《NIFDCPT-091药品中核磁共振检测定性能力测定作业指导书》,按照实验室日常检验程序和方法,对测试样品进行检验,在规定期限内反馈检验结果。本次药品中核磁共振检测定性能力测定以定性检测为主,以1H谱和13C谱的信号峰数量和化学位移值作为检测指标,要求实验室分别报告待测样品的1H谱和13C谱,同时对检测获得的数据按照结果报告单的格式进行填写。鉴于国内尚无核磁共振检测能力评价项目,本次研究通过组织国内药品中核磁共振检测定性能力检测[12],一方面可以评价参加实验室核磁共振定性检测水平,为药品的研发、质控提供技术保障;另一方面,在项目检查中发现问题,分析问题,解决问题,提高参加实验室的质量意识[13],达到共同提高,共同进步的目的。
1 仪器和试药核磁共振波谱仪;阿魏酸标准物质(GBW09518),氘代甲醇。
2 方法 2.1 测定样品准备为满足本次能力验证计划的顺利实施,在项目研究前期,按照标准物质研制技术规范开展了阿魏酸化学纯度标准物质的研制工作。阿魏酸通过提取分离获得粗品,粗品经80%乙醇重结晶,再经抽滤、室温干燥后,可获得化学纯度大于99.5%的阿魏酸标准物质候选物。
阿魏酸标准物质候选物经研磨过筛,二次混样,在温度(22±0.2)℃,相对湿度<50%的环境下分装,样品50 mg,分装在2 mL棕色安瓿瓶中,熔封隔绝空气。封装后的样品按照单盲样品分配表分配,样品通过EMS向每个参加实验室快递分发一份类白色粉末样品。
2.2 样品的均匀性检验按《一级标准物质研制技术规范》以及《能力验证样品均匀性和稳定性评价指南》中均匀性检验的规定[14-15],依照随机数表抽取15支阿魏酸纯度标准物质候选物,每支取样3次进行均匀性检验,检验方法采用高效液相色谱法。
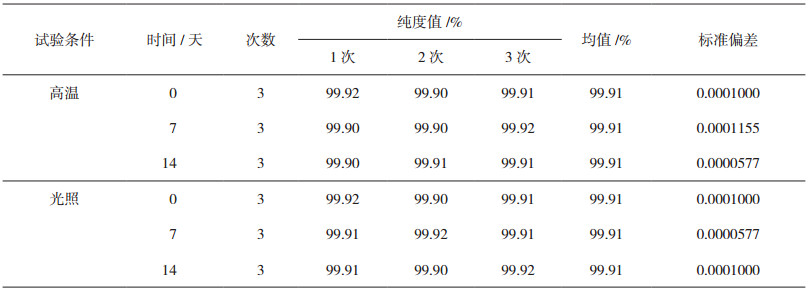
2.3 运输稳定性与长期稳定性检验考虑到阿魏酸纯度标准物质在运输及转移过程中对环境的要求,对包装后标准物质样品进行高温试验(60℃,14天)和光照试验[照度(4500±500)lx,14天],并分别于0、7、14天对经过高温和光照后的标准物质样品进行检测,以考察标准物质样品纯度变化情况。每个时间点随机抽样3瓶样品,每瓶进3针,采用高效液相色谱技术的面积归一化方法检测样品纯度。
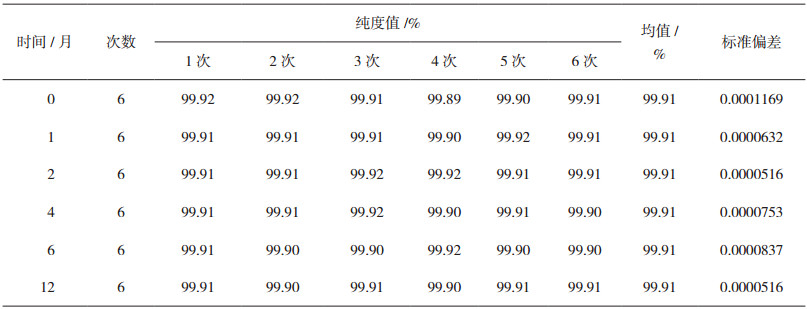
考虑到阿魏酸纯度标准物质样品在贮藏状态下的样品稳定性,将包装后标准物质样品放置在常温下长期保存,并分别于0、1、2、4、6、12个月对取样进行纯度检测。每个时间点随机抽取6瓶样品,采用高效液相色谱技术的面积归一化方法检测样品纯度。
2.4 检测要求项目组在网络平台发布能力验证计划,拟参加能力验证研究的实验室在网上申请参加能力验证计划,报名结束后,项目为参加实验室随机安排一个唯一性代码,发放1瓶检测样品,同时发放作业指导书、结果报告单和样品接收确认单,要求参加实验室按照作业指导书进行检测,在规定的期限内按要求上交测试原始数据和试验结果。
2.5 结果分析方法本次测定为药品中核磁共振检测定性能力验证,对待测物质进行核磁共振定性检测,以国家一级标准物质阿魏酸纯度标准物质(GBW 09518)的1H谱和13C谱的信号峰数量及1H谱(±0.02)和13C谱(±0.3)的化学位移值进行定性判别。本次能力验证计划采用专家评价的方式,以专家分析结果和结论为主要依据,从谱图信号峰数量和化学位移精度两个方面综合评价。按照各实验室报告提交的图谱数据进行(符合规定和不符合规定)评判。
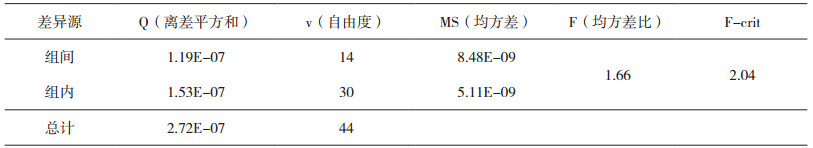
3 结果与数据分析 3.1 测试样品均匀性检测结果采用高效液相色谱技术的面积归一化方法检测样品纯度。采用单因子方差分析法对检验结果进行统计分析,均匀性检验结果如表 1所示。
|
|
表 1 方差分析结果 |
结果表明:在置信度95%时,样品的均匀性满足要求。
3.2 样品的运输稳定性与长期稳定性检验结果利用t检验法评价样品在高温和光照条件下的运输稳定性,检测结果如表 2所示。
|
|
表 2 经不同环境影响条件及不同时间下样品的运输稳定性试验数据 |
查t分布双侧分位数表知:t4 0.05=2.776,高温t4 0.05(0, 7)= 0.000,高温t4 0.05(0, 14)= 0.000;光照t4 0.05(0, 7)= 0.000,光照t4 0.05(0, 14)= 0.000。结果表明在此显著水平时,样品在高温、高湿条件下,放置7天、14天与第0天的纯度测定结果无显著性差异,即样品的运输稳定性良好。
长期稳定性考察是将包装后样品置于常温状态下,考察样品的稳定性。在12个月内设置了6个取样点。经长期稳定性试验后样品的检测结果如表 3所示。
|
|
表 3 长期稳定性试验检测数据 |
按照《标准物质/标准样品定值的一般原则和统计方法》规定[16],将表 3数据,以x代表时间,以y代表标准物质的特性量值(阿魏酸纯度标准物质的纯度值),拟合成一条直线,获得直线方程:y=-0.0000081x+0.9991。则有直线的标准偏差为1.78×10-9,相应的斜率的不确定度为4.29×10-6,在自由度为4和95%置信区间,t因子为2.776时,斜率不显著,因而表明样品在12个月的贮藏期内的长期稳定性良好。
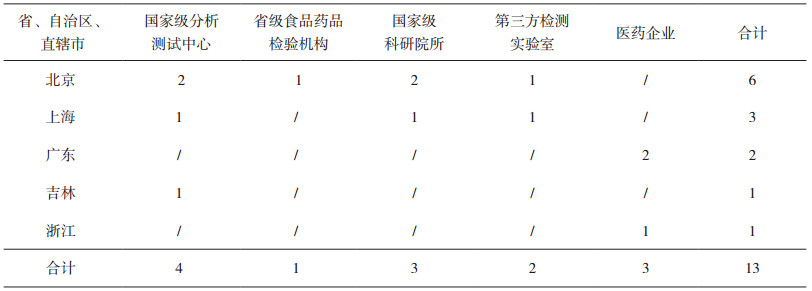
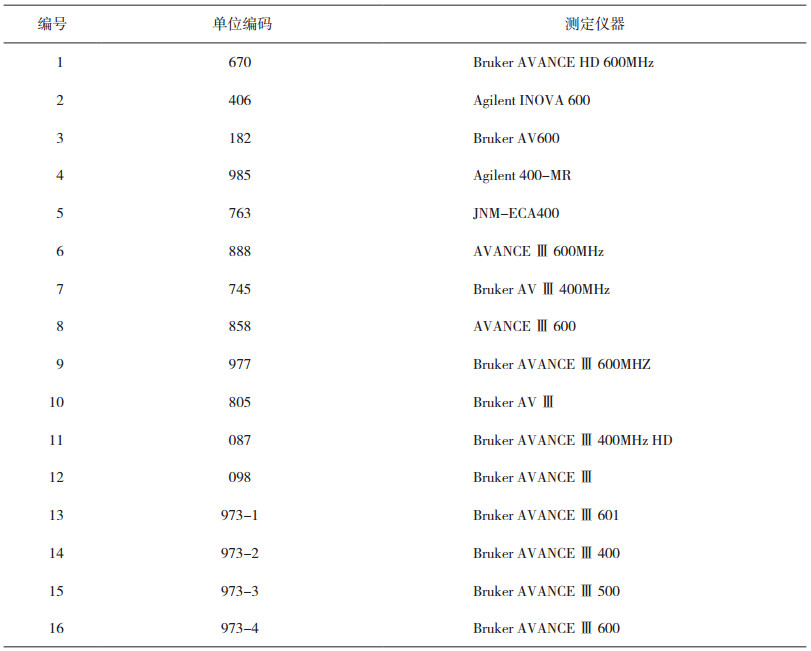
3.3 药品中核磁共振检测定性能力检测结果本计划共有13家实验室16台设备报名参加能力验证项目,本次能力验证共发放样品13份。13家实验室按要求反馈了16份结果报告单。参加本次能力验证的实验室分布于全国6个省、直辖市,主要包括国家级检测中心、国家食品药品检验机构、中国科学院、军事科学院、地方检验机构、药品生产企业、科研院所和检测实验室。实验室的分布情况见表 4,13家实验室16台设备包括德国布鲁克仪器13台、美国安捷伦仪器2台、日本电子仪器1台,覆盖核磁共振设备全部仪器生产厂家,其中Bruker出品的核磁共振仪占市场的主导地位。核磁共振谱仪涵盖400兆至600兆。参加实验室的仪器使用情况见表 5。
|
|
表 4 参加实验室分布情况 |
|
|
表 5 参加实验室的仪器使用情况 |
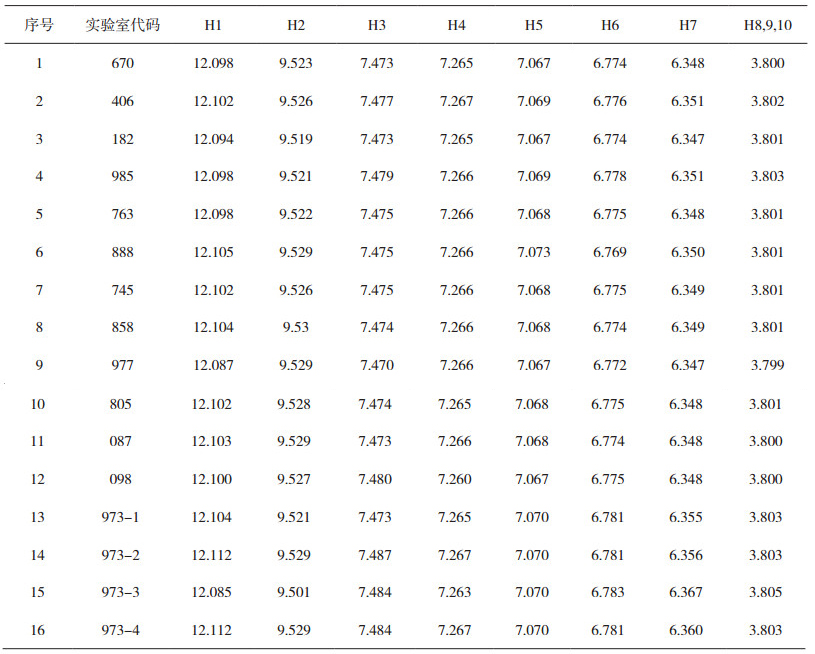
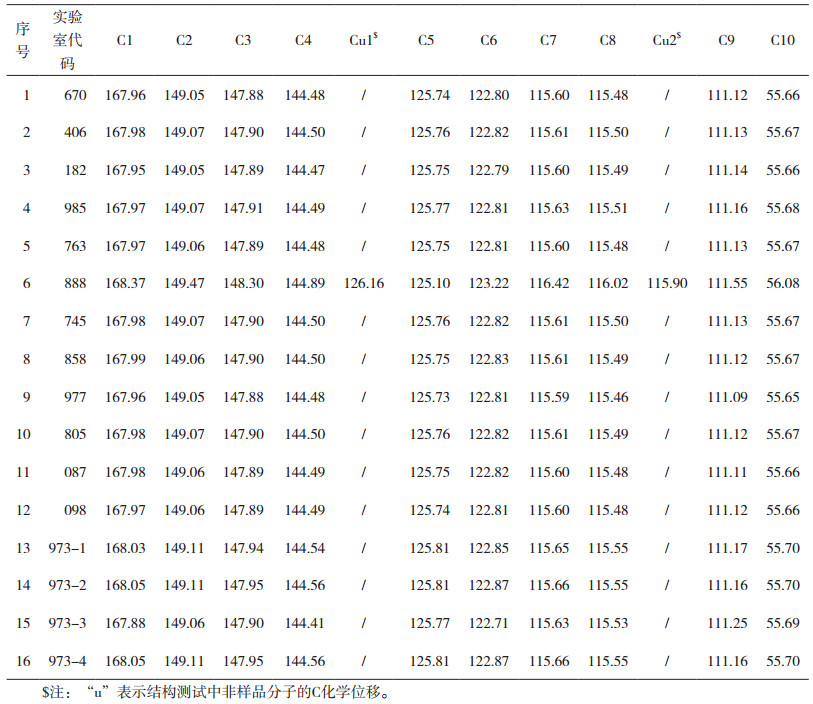
汇总各实验室报告的数据,见表 6、表 7,1H谱和13C谱的信号峰数量和化学位移全部符合评价原则,判为“合格”;有1项及超过1项不符合评价原则的为“不合格”。数据评定结果见表 8,13家实验室16台设备能力验证计划结果表明:12家实验室15台仪器的测定结果评定为合格, 1家实验室的1台仪器测定结果为不合格,合格率为93.75%。
|
|
表 6 1H谱数据汇总 |
|
|
表 7 13C谱数据汇总 |
|
|
表 8 数据评定结果 |
本次能力验证计划实施结果表明,大型仪器需要开展相关的能力验证活动,在13家实验室16台设备能力验证计划结果中,有12家实验室的15台设备的测试结果合格,表明绝大多数实验室仪器设备和操作人员的检测能力良好,能够开展相关的检测分析任务;结果为“不合格”的1家实验室1台设备,主要表现为该试验测定的C谱中多了2个不属于待测样品的C化学位移。对其进行分析发现,问题主要表现在以下几个方面:①实验室未按照作业指导书操作规程完成能力验证试验;②未出具仪器原始谱图;③该实验室提供的谱图中包含了非检测样品的化学位移结果,原因可能包括溶剂质量、容器洁净、称量过程引入的污染,也有可能第三方软件处理过程引入的问题。
此外,由于国内尚无核磁共振波谱仪的相关能力验证项目,参加实验室在检测过程中尚存在其他问题,如本次能力验证的结果报告中明确指出,需要扣除溶剂峰,但是在上交的数据结果中仍有4家4台设备没有按照操作规程执行。因此,在大型仪器的使用中,需要加强技术培训,规范操作,才能保障检测数据的准确性和可靠性。
| [1] |
唐凌天, 符斌. 实验室能力验证的发展[J]. 中国无机分析化学, 2013, 3(4): 11-15. |
| [2] |
ISO/IEC 17025: 2005 General Requirements for the Competence of Testing and Calibration Laboratories(检测和校准实验室能力的通用要求)[S]. 2005.
|
| [3] |
董喆, 张会亮, 黄湘鹭, 等. 保健食品中西布曲明含量检测的能力验证研究[J]. 中国药事, 2014, 28(12): 1331-1334. |
| [4] |
赵彤. 大米中总砷和镉测定能力验证[J]. 食品研究与开发, 2016, 36(21): 141-144. DOI:10.3969/j.issn.1005-6521.2016.21.032 |
| [5] |
陆明, 王林波, 沈漪, 等. 盐酸二甲双胍药品吸收系数测定的能力验证[J]. 中国医药工业杂志, 2014, 45(8): 758-762. |
| [6] |
祁慧雪. 核磁共振技术在化学物质定量分析中的应用[J]. 广东化工, 2012(6): 121-49. |
| [7] |
邓志威, 李璟, 许美凤, 等. 核磁共振技术在药物分析鉴定中的应用[J]. 分析测试学报, 2012, 31(9): 1081-1088. |
| [8] |
肖翠平, 程建波, 王进军, 等. 铁屎米酮类生物碱分子化学位移的理论研究[J]. 分子科学学报, 2011, 27(4): 283-286. |
| [9] |
邵思远, 杨桠楠, 张培成. 核磁共振在确定链状化合物相对构型中的应用[J]. 国际药学研究杂志, 2015, 42(6): 699-705. |
| [10] |
吴春丽, 李杰明, 魏会杰, 等. 阿托伐他汀内酯的波谱学数据与结构确证[J]. 波谱学杂志, 2014, 31(2): 268-277. |
| [11] |
中国药典: 四部[S]. 2015: 通则0441.
|
| [12] |
中国合格评定国家认可委员会. CNAS-RL02: 2016能力验证规则[S]. 2016.
|
| [13] |
戴妙妙, 马红青, 王婷婷, 等. 浅析实验室能力建设中的能力验证提供者认可[J]. 标准科学, 2017(1): 53-55. |
| [14] |
国家标准物质研究中心. JJG 1006-94一级标准物质技术规范[S]. 1994.
|
| [15] |
中国合格评定国家认可委员会. CNAS-GL03: 2006能力验证样品均匀性和稳定性评价指南[S]. 2006.
|
| [16] |
中国合格评定国家认可委员会. CNAS-GL29标准物质/标准样品定值的一般原则和统计方法[S]. 2015.
|
 2018, Vol. 32
2018, Vol. 32