作为第三代抗组胺药,地氯雷他定是氯雷他定在体内的活性代谢产物,其抗组胺作用比氯雷他定强,具有起效快、作用持久、无中枢系统镇静作用、无心脏毒性及药物相互作用少等优点[1],已广泛应用于治疗过敏性鼻炎、荨麻疹等症。据文献报道,地氯雷他定存在无定形和四种结晶型[2-4],分别为晶型Ⅰ、Ⅱ、Ⅲ和Ⅴ。目前制剂用地氯雷他定原料多为晶型Ⅰ和晶型Ⅱ的混合物,虽然制备纯度较高的晶型Ⅰ或晶型Ⅱ原料的方法较成熟,但是其一种晶型的纯品易发生转晶现象,而两种晶型按一定比例混合后稳定性较好,不易转晶,可保证制剂过程的稳定[5],常用的生产工艺得到的原料以晶型Ⅰ为主,晶型Ⅱ所占比例不超过15%。
粉末X射线衍射法(X-ray Powder Diffraction, XRPD)是药物晶型分析的常用方法,在多种晶型混合物的衍射图谱中,衍射线的位置(2θ)是由晶体的周期性决定的,而衍射线的强度是由一定结构的原子团与点阵共同决定的。不同物相的结构不同,也就是在周期性或原子团组成与结构上总有这样或那样的不同,因而它们的衍射谱总是有区别的,具有特征性,且由于其中各相的结构并不变化,它们各自的衍射谱也不会变化[6],因此该方法可用于多相混合物的定性、定量分析。欧洲药典、美国药典和中国药典2015年版均收载了该方法,常用的定量分析方法有外标法、内标法和标准加入法[7],通过选取1~3个特征衍射峰,建立混晶样品的标准曲线测定原料药中晶型的比例[8]。本文将参照文献报道的方法,以内标法和标准加入法相结合的方法测定地氯雷他定中晶型Ⅰ和晶型Ⅱ的比例。
1 材料与方法 1.1 仪器Rigaku D/Max 2200型粉末X射线衍射仪(日本理学公司)。
1.2 试药地氯雷他定原料(批号:DS03327,DS03328,DS03329)为国外企业的产品;地氯雷他定晶型Ⅰ对照品(批号:DS/RS/1/1301,纯度>99.0%)和晶型Ⅱ对照品(批号:DS/RS/2/1312,纯度>99.0%)由企业提供。
1.3 试验条件阳极靶Cu,配Ni滤光片,射线管电压40 kV,电流40 mA,接收狭缝0.15 mm,发散狭缝1°,防散射狭缝1°,扫描范围2θ=5°至35°,扫描速度每分钟0.5°,扫描间隔0.02°。分别取测定标准曲线用混合对照品,混合样品及混合对照品500 mg,过100目筛,取50 mg,置载样玻璃片凹槽中,用玻璃片正压法制片。
1.4 样品的制备测定标准曲线用混合对照品,由地氯雷他定晶型Ⅰ对照品和晶型Ⅱ对照品以重量比60:40,70:30,80:20,90:10,95:5混合制成,每份约500 mg。混合样品由450 mg样品和50 mg晶型Ⅱ对照品混合制成。测定用混合对照品由晶型Ⅰ对照品450 mg和晶型Ⅱ对照品50 mg混合制成。所有样品和对照品称取后置西林瓶中,经涡旋振荡5分钟使混合均匀。
1.5 选择特征衍射峰在地氯雷他定的粉末X射线衍射图谱中,晶型Ⅰ在2θ=13.2°、18.7°、20.2°、21.1°、25.3°、26.3°和29.4°有强特征峰;晶型Ⅱ在2θ=13.1°、18.7°、20.2°、22.4°、27.4°和29.0°有强特征峰。根据欧洲药典的规定,2θ误差范围为±0.2°,为避免两种晶型的特征峰相互干扰,晶型Ⅰ可选择的特征峰在2θ=21.1°,25.3°,26.3°和29.4°,晶型Ⅱ可选择的特征峰在2θ=22.4°和27.4°;而晶型Ⅰ在2θ=27.6°有衍射峰,晶型Ⅱ在2θ=21.2°、25.3°和26.3°有衍射峰,因此,为尽量减少弱衍射峰对计算结果的影响,选取2θ=29.4°为晶型Ⅰ的特征峰,2θ=22.4°为晶型Ⅱ的特征峰,以特征峰的面积进行计算。
1.6 试验方法由于地氯雷他定原料中以晶型Ⅰ为主,晶型Ⅱ比例小于15.0%,为降低系统误差,且不引入外源性内标物,因此用晶型Ⅱ为内标,以晶型Ⅰ和晶型Ⅱ的特征峰面积比对重量比线性回归,得到线性方程。测定混合样品与混合对照品后,以混合样品图谱中晶型Ⅱ的特征峰(2θ=22.4°)面积减去混合对照品中晶型Ⅱ的特征峰面积,所得结果为样品中晶型Ⅱ的特征峰面积;以样品中晶型Ⅰ和晶型Ⅱ的特征峰面积比计算晶型Ⅰ和晶型Ⅱ的重量比,因为样品主要由晶型Ⅰ和晶型Ⅱ组成,即100%,从而可以计算晶型Ⅰ和晶型Ⅱ的比例。
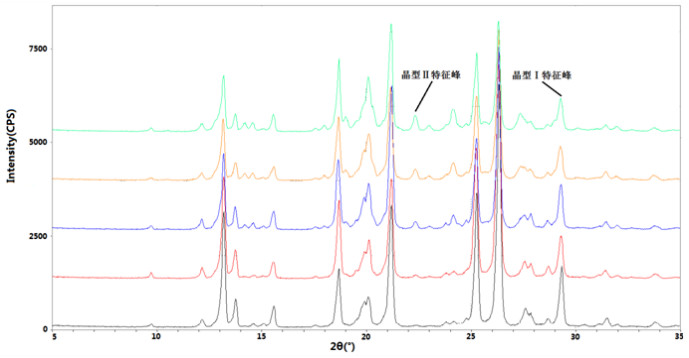
2 结果与讨论 2.1 专属性粉末X射线衍射法能够鉴别特定物质的不同晶型,地氯雷他定样品的衍射图谱中可见晶型Ⅰ和晶型Ⅱ的特征衍射峰(图 1),该方法专属性较好。

|
图 1 地氯雷他定各晶型对照品及样品的XRPD图谱 |
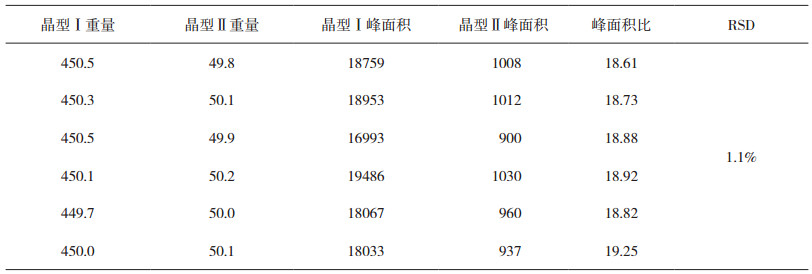
取晶型Ⅰ和晶型Ⅱ对照品,分别以重量比9:1混合制成6份各约500 mg的混合对照品,测定XRPD图谱,以图谱中晶型Ⅰ的特征峰(2θ=29.4°)与晶型Ⅱ的特征峰(2θ=22.4°)面积比计算重复性,RSD为1.1%(表 1)。
|
|
表 1 重复性试验结果 |
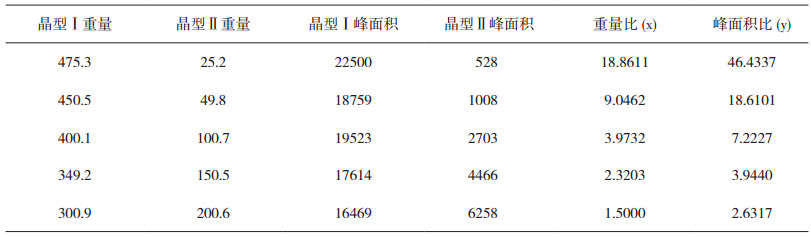
以5份晶型Ⅰ和晶型Ⅱ的混合对照品XRPD图谱中晶型Ⅰ的特征峰与晶型Ⅱ的特征峰面积比对重量比进行线性回归(表 2、图 2),得到线性方程:y=2.3205x-1.5641(r=0.9986)。
|
|
表 2 线性和范围测定结果 |
|
图 2 测定标准曲线用混合对照品XRPD图谱 注:晶型Ⅰ和晶型Ⅱ重量比从上至下分别为60 : 40、70 : 30、80 : 20、90 : 10、95 : 5。 |
采用加样回收试验,取地氯雷他定样品450 mg与晶型Ⅱ对照品50 mg混合均匀,分别制成6份混合样品,测定回收率为93.7%,RSD为1.4%。
2.5 检测限将晶型Ⅰ和晶型Ⅱ的对照品以不同比例混合,以晶型Ⅰ的特征峰强度计,当信噪比为3:1时,测定检测限为8.5 mg·g-1。
2.6 定量限将晶型Ⅰ和晶型Ⅱ的对照品以不同比例混合,以晶型Ⅰ的特征峰(2θ=29.4°)强度计,当信噪比为10:1时,测定定量限为25.9 mg·g-1。
2.7 样品测定按照“1.4”节方法制备混合样品与混合对照品,每批样品制备6份,各测定1次,混合对照品制备1份,重复测定6次,样品中晶型Ⅱ的特征峰面积,以混合样品中晶型Ⅱ的特征峰面积减去混合对照品中晶型Ⅱ的特征峰面积平均值计,通过线性方程计算3批样品中晶型Ⅰ的含量(表 3)。
|
|
表 3 地氯雷他定样品中晶型Ⅰ和晶型Ⅱ的比例 |
在标准曲线测定时,将晶型Ⅰ和晶型Ⅱ对照品混合后,晶型Ⅰ的特征峰与晶型Ⅱ在2θ=28.7°的衍射峰较接近,随着晶型Ⅱ对照品的重量比增大,2θ=28.7°衍射峰的峰面积增大,可能影响到晶型Ⅰ特征峰的寻峰和峰面积结果(图 2),由于样品中晶型Ⅱ的比例不到10.0%,该衍射峰的峰面积很小(图 1),对样品中晶型Ⅰ特征峰的寻峰和峰面积结果影响不大。在样品的衍射图谱中,晶型Ⅱ的特征峰面积较小,因此直接用其面积值进行计算易导致较大误差,采用标准加入法可减少系统误差对结果的影响。XRPD法定量分析受仪器精度和检测灵敏度影响较大,随着衍射仪的技术更新,可得到更好的灵敏度和重复性。对于其他化学药物的晶型分析,尤其是2种以上晶型的混合物的定量分析,有待进一步研究。
| [1] |
徐道华. 第三代抗组胺药地氯雷他定[J]. 中国新药杂志, 2005, 14(12): 1486-1488. DOI:10.3321/j.issn:1003-3734.2005.12.034 |
| [2] |
Murpani D, Rafeeq M, Raheja P, et al. Process for the Preparation of Desloratadine: US Patent, US2007/0244144A1[P]. 2007-10-18[2017-10-25]. http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=HITOFF&u=%2Fnetahtml%2FPTO%2Fsearch-adv.html&r=1&f=G&l=50&d=PG01&p=1&S1=20070060756.
|
| [3] |
Kumar RVSK, Kale SA, Choudhari RB, et al. Novel Crystalline Forms of Desloratadine and Processes for Their Preparation: US Patent, US 2007/0135472 A1[P]. 2007-6-14[2017-10-25]. http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=HITOFF&u=%2Fnetahtml%2FPTO%2Fsearch-adv.html&r=1&f=G&l=50&d=PG01&p=1&S1=20070135472.
|
| [4] |
Bhatt PM, Desiraju GR. FormⅠof Desloratadine, a Tricyclic Antihistamine[J]. ActaCryst, 2006, C62: 362-363. DOI:10.1107/S0108270106012571 |
| [5] |
Khunt MD, Madduri SR. Process for the Preparation of Desloratadine Polymorph Mixtures: US Patent, US 2008/0287481 A1[P]. 2008-11-20[2017-10-25]. http://appft.uspto.gov/netacgi/nph-Parser?Sect1=PTO2&Sect2=HITOFF&u=%2Fnetahtml%2FPTO%2Fsearch-adv.html&r=1&f=G&l=50&d=PG01&p=1&S1=20080287481.
|
| [6] |
马礼敦. 高等结构分析[M]. 第一版. 上海: 复旦大学出版社, 2002: 369-378.
|
| [7] |
European Pharmacopeia 8. 0[M]. Strasbourg EDQM, 2015: 301-303.
|
| [8] |
国家药典委员会. 中国药典: 四部[S]. 2015: 371-374.
|
 2018, Vol. 32
2018, Vol. 32