前列腺特异抗原(PSA)是具有组织特异性的类似血管舒缓素的丝氨酸蛋白分解酶,为辅助诊断前列腺癌和动态观察前列腺癌治疗经过的首选肿瘤标志物[1-3]。由于在乳腺及其相关肿瘤中也有不同程度的表达,成为近年来乳腺癌的辅助诊断与预知的一种新的肿瘤标记物[4-5]。除前列腺癌外,前列腺肥大及其他泌尿器官组织的炎症等良性疾病也能引起其浓度出现轻度上升,在血液中主要以结合型PSA及游离型PSA(f-PSA)存在,临床通常以患者血液中f-PSA与总PSA的比值(F/T)来鉴别诊断良性疾病和前列腺癌[6-7]。目前,用于f-PSA定量检测的主要技术是化学发光、酶联免疫,以化学发光为主流方法。虽然大多是传统检测试剂,生产厂家众多,但产品质量参差不齐,为了加强对f-PSA检测试剂盒的监督管理,规范市场秩序,保障产品使用安全有效,对上市试剂盒进行了抽验,并分别使用产品标准和行业标准作为判断依据对试剂盒的质量进行评价。
1 仪器与材料 1.1 主要仪器酶标仪(Spectra MAX M2,美国Molecular Devices公司);全自动化学发光免疫分析仪(Liaison XL型,Dia Sorin S.p.A公司;Maglumi 2000型,深圳市新产业生物医学工程股份有限公司;ARCHITECT i2000型,Abbott Ireland Diagnostics Division公司;IMMULTE 2000 xpi型,Siemens Healthcare Diagnostics Products Limited公司;DXI 800型,Beckman Coulter公司;IS12000型,四川迈克生物科技股份有限公司;AIA-2000 ST型,Tosoh公司;CL-2000型,深圳迈瑞生物医疗电子股份有限公司;ChemLiteTM1200型,博奥生物集团有限公司;CIA 1200型,江苏泽成生物技术有限公司;卓越C1800型,上海科华生物工程股份有限公司;IDS-ISYS型,北京利德曼生化股份有限公司)。半自动化学发光仪(LUMO型,郑州安图生物股份有限公司;PETECK96-Ⅰ型,博奥赛斯<天津>生物科技有限公司;ECLIA-ⅡM型,郑州人福博赛生物技术有限公司;JETLIA-962型,北京源德生物技术有限公司;BHP 9507型,北京倍爱康生物技术有限公司;BHP9504型,北京华科泰生物技术有限公司;CHEMCLIN 100型,北京科美生物技术有限公司)。光激化学发光检测仪(LiCA HT,博阳生物科技 < 上海>有限公司)。洗板机(DEM- 3,北京拓普分析仪器有限责任公司)。
1.2 主要材料参考品:f-PSA国家标准品,批号:150544- 200702,浓度:170 ng/支,由中国食品药品检定研究院提供;企业参考品(包括试剂盒校准品和质控品)均由各企业提供。
本次共抽取f-PSA检测试剂盒29批次:其中效期内产品(距离生产日期3个月内)22批次(国产15批次,进口7批次),近效期产品7批次(均为国产,距离失效期1~3个月);国产产品22批次(均抽自生产商),进口产品7批次(均抽自代理公司);化学发光产品26批次,酶联免疫产品3批次。
2 方法和结果 2.1 检验规则以各抽样企业f-PSA产品标准对各抽样试剂盒进行检测,项目包括准确度、检测限、线性、重复性。对于准确度检验,有21批次产品标准规定使用国家标准品进行,1批次规定使用企业参考品进行;对于线性、检测限、重复性检验,22批次均规定使用企业参考品进行。具体实验操作步骤严格按照各抽验产品说明书进行各规定样品的检测。单次检测合格即判为该指标合格;单次不合格,则更换操作者并重新配样,重复检测2次仍不合格即判定该指标不合格。上述要求项目任意项判定不合格,本次抽验综合结论为不合格;产品在正常检验过程中不能正常使用,本次抽验综合结论为不合格,由于产品标准问题无法给出检验结论,可视为不能正常使用。
同时以f-PSA行业标准进行效期内上述项目的检验[8]。按照行业标准的要求,对于准确度检验,配备系列校准品的试剂盒,使用国家标准品为对照品,以系列校准品的效价比进行评价,未配备系列校准品的试剂盒则以国家标准品的实测值与理论值之比进行评价;对于检测限检验,使用各企业试剂盒稀释液,计算其反应量均值(x)和标准差(SD),以(x +2SD)对应的最低检测限浓度进行评价;对于线性,配备系列校准品的试剂盒,使用校准品的剂量-反应曲线的线性评价,未配备系列校准品的试剂盒,使用国家标准品配制到试剂盒声称的区间浓度,以建立的相应曲线的线性评价;对于重复性检验,使用国家标准品配制的高、低浓度样品为重复性质控品,以变异系数进行评价。检验结果进行国产、进口该同类产品性能的比较。
2.2 样品配制按照各产品标准规定的样品类型及浓度配制准确度、线性、检测限及重复性样本;涉及国家参考品,取0.5 mL纯水加入到f-PSA国家标准品中,溶解后成340 μg·L-1,使用试剂盒稀释液配制到各产品标准要求的浓度,或者以试剂盒稀释液统一配制到行业标准各项目要求的浓度;对于准确度及重复性样本,高值选择接近线性范围高点的浓度,低值选择不高于2 μg·L-1。
2.3 检验结果 2.3.1 企业产品标准22批次效期内产品中有20批次试剂盒的准确度、线性、检测限、重复性均满足要求,合格率为90.9%,批内精密度变异系数在1.2%~7.9%范围内。2批次不合格试剂中,1批由于无法根据其标准规定的检测限判断方法得出检验结论;另外1批由于标准规定的特定批国家标准品已换批多年,因而无法进行准确度检测;根据判定原则,上述2个试剂盒综合判为不合格。7个近效期试剂盒,有6批合格,1批涉及产品标准问题(无法获得标准规定的特定批次国家标准品),综合判为不合格,合格率为85.7%。经卡方检验,近效期与效期内产品无统计学差异(P=0.6943>0.05)。
2.3.2 行业标准准确度:本研究结果显示,以校准品的平均效价评价,无论试剂盒配备校准品还是未配备系列校准品,15批次效期内国产试剂均满足行业标准的要求,合格率100%。7批次进口试剂盒中有1批次对国家标准品高值的实测值与理论值之比为0.81,无法满足行业标准0.85~1.15的要求,根据判定原则,该批试剂盒综合判为不合格,合格率85.7%;经卡方检验,准确度差别无显著意义(P=0.1341>0.05);以每个校准品的效价均符合0.900~1.100要求评价,15批次效期内国产试剂盒中有6批次不符合行业标准规定,见图 1b (各抽验企业名称均以字母表示),合格率60%;7批次进口试剂盒中2批次不符合行业标准规定,合格率71.4%;经卡方检验,准确度差别无显著意义(P=0.6037>0.05),见图 1。
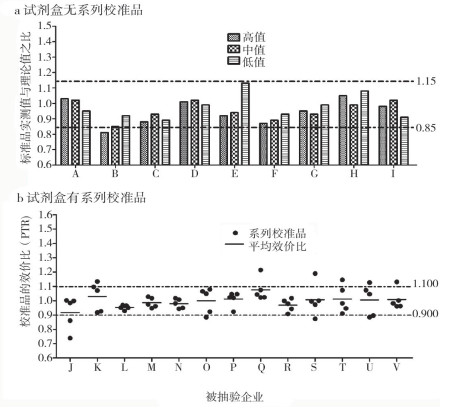
|
图 1 准确度比较 |
检测限:所有被抽验企业的最低检测限均远低于0.2 μg·L-1,满足行业标准的要求,经单因素方差分析,国产、进口试剂盒无显著差异(P=0.6692>0.05),见图 2。

|
图 2 最低检测限比较 |
线性:各抽检企业试剂盒的线性区间下限均不高于0.5 μg·L-1,上限均不低于10 μg·L-1,反应曲线的相关系数(r)均不低于0.9900,满足行业标准的要求(见图 3);自动化仪器具有更宽的区间,最低下限可达0.005 μg·L-1,最高上限可达60 μg·L-1,手工操作及酶联免疫试剂盒线性范围较低。
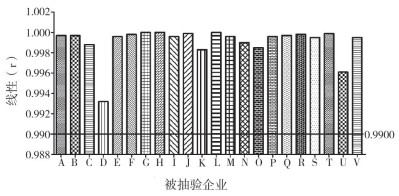
|
图 3 线性比较 |
重复性:以高、低2个浓度检测,所有被检试剂盒变异系数均在10%以内,以界值附近的低值质控品的测定值比较,经单因素方差分析,国产、进口试剂盒无显著差异(P=0.6145>0.05)(见图 4);高值质控品的浓度值设定因不同的线性区间有所不同,无法进行平行比较。
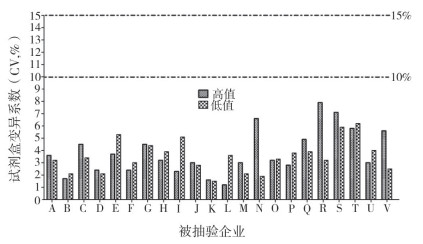
|
图 4 重复性比较 |
按照国家食品药品监督管理总局网站的数据库信息统计[9],进口与国产试剂盒注册证为37个。根据抽验方案要求,计划抽验28批次效期内产品(指定国产20批,进口试剂8批),实际到样率78.6%(22/28),抽验结果可以作为有效的监督抽验参考数据。但原计划抽验20批近效期产品仅到样7批次,到样率35%(7/20),进行统计时误差较大,不能反映该试剂实际质量问题,降低了作为风险监测评估的意义。因而,除了加强抽验前的培训,尚需在抽样工作过程中加强和基层的及时沟通和交流,确保抽到符合方案要求的样品。
4.2 试剂盒的溯源与校准目前,所用f-PSA第三代国家标准品溯源至WHO国际标物(NIBSC 96/668)[10],在本次检验中发现的测定准确度问题均来自试剂盒校准品的定值。一方面,许多进口试剂在研发时与我国的国家标准品不是一条溯源链,例如溯源至HYBRITECH的贝克曼定值系统,则无法通过溯源至WHO的国家标准品。目前,贝克曼试剂在市场上普遍使用HYBRITECH的校准体系,该试剂的检测结果与溯源至WHO的检测结果存在一定的偏差(高于WHO溯源的20%~25%)[11-12],因此,使用该试剂的试验室应根据所使用试剂的特点,建立自己的百分比参考范围。另一方面,缺乏线性区间全范围的校准,例如许多试剂在中值区间有比较理想的信号值,但在高、低浓度区段校准品定值偏差较大,如以国家标准品测定某一进口试剂的线性高值则无法达到要求;而部分国产试剂校准品的平均效价尽管可以满足要求,但独立评价每个校准品时,最低下限和最高上限校准品的效价比均存在较大偏差。
4.3 产品标准问题根据管理规定,监督抽验为标准符合性检验[13],但在审阅资料时也暴露出产品标准本身的问题,表现在:1)标准内容出现明显的编写错误,例如“应不小于”,写成了“应不大于”,出现了明显的逻辑错误;2)标准的制定可操作性差,例如某些产品标准中,涉及对早期已换批的国家标准品的检测,而在本检测中却无法获得所规定的标准品,事实上,作为企业本身的出厂检验也无法做到,这同时也暴露出生产质量管理体系方面的问题,即无法进行的出厂检验,照样放行;3)标准制定与实际不符,例如准确度规定“将国家参考品稀释成系列梯度,在0.005~20 ng·mL-1(Hybritech校准)/或0.005~16 ng·mL-1(WHO校准)范围内,回收率应在80%~120%之间”,但国家参考品是溯源至WHO校准的,如果使用Hybritech校准,则测定值无法满足标准要求。另外,有企业试剂盒标准的制定脱离本身性能,例如说明书描述使用三次方样条函数拟合,而在标准中却声称使用四参数拟合并评定线性指标;4)标准要求太低,在监督检测中了解到,个别企业在注册时通不过国家标准品,当时的法规并无强制要求,因而使用企业自己的质控品进行准确度检测,而质控品是一种低级别的参考物质,量值上与标准品偏差较大,这类企业在注册时很顺利地拿到注册证,上市后又缺少监管,存在极大的风险;另外是标准指标太低,例如某进口试剂的线性相关系数的标准规定为“不小于0.95”,大大低于行业标准0.99的要求。上述情况要么影响监督抽验的判断,要么虽通过了企业标准而无法通过行业标准,因此,生产企业有必要定期对自己的产品标准或技术要求进行自查并及时纠正标准本身存在的问题。
4.4 总体质量评价与风险监测通过本次抽验可以看出,即使个别试剂存在区间上、下限浓度附近测定值偏差较大的问题,但总体质量较好,不会有太大的风险,因为该项目不作为单一诊断,而是联合总前列腺特异性抗原、抗原前体、抗原密度、影像学等作为对良性前列腺增生与前列腺癌的鉴别[14-15],因此,使用单位在开展该项目时,建议使用同一生产商的试剂,在兼顾敏感性和特异性基础上建立自己的百分比参考值,尤其在总PSA较低水平时[16-18]。通过国产、进口同类产品质量分析,国产该试剂在质量上与进口试剂相比无明显差别,试剂的稳定性良好,只是在自动化操作方面尚存差距。另外,由于受系统局限,有的产品高值信号无法达到既定要求,因此无论手工操作还是自动化,均不适合离开本身系统性能而放宽线性区间。近效期产品由于到样率较低,作为风险监测评估的意义不大,不在此讨论。
4.5 呼吁标准的统一监督抽验的目的在于评价该试剂盒的质量,为试剂盒质量的提高和技术监管提供技术资料。由于行业标准为推荐标准,该标准于2015年7月实施,许多企业可能并未真正执行,也无法起到规范作用。各企业为顺利通过注册检验,产品标准中常常选择更有利于通过性能检测的浓度或样品类型,例如中间浓度或质控品,而不是选择风险较高的样品或国家标准品,不能真实地反映试剂的质量。尽管使用企业产品标准进行的检验基本不存在问题,但很难确保企业会自行改进,因而存在无法预知的风险,同时也大大降低了监督抽验的意义。因此,建议今后的注册检验中,统一采用国家标准品,并以行业标准为最低标准,以促进企业改进产品质量。监管部门除了加强行业标准的宣贯力度外,对于本检验中存在潜在风险及未到样的产品,希望通过计划追踪,进一步加强市场监督。
| [1] |
Stephan C, Ralla B, Jung K. Prostate-specific Antigen and Other Serum and Urine Markers in Prostate Cancer[J]. Biochim Biophys Acta, 2014, 1846: 99-112. |
| [2] |
Saini S. PSA and Beyond:Alternative Prostate Cancer Biomarkers[J]. Cell Oncol(Dordr), 2016, 39(2): 97-106. DOI:10.1007/s13402-016-0268-6 |
| [3] |
Tilki D, Kim SI, Hu B, et al. Ultrasensitive Prostate Specific Antigen and Its Role After Radical Prostatectomy:A Systematic Review[J]. J Urol, 2015, 193(5): 1525-1531. DOI:10.1016/j.juro.2014.10.087 |
| [4] |
Jahir ET, Devi R, Borthakur BB. Study of Serum Total PSA and Free PSA as An Oncological Marker in Breast Tumour[J]. J Clin Diagn Res, 2017, 11(3): 13-16. |
| [5] |
Mashkoor FC, Al-Asadi JN, Al-Naama LM. Serum Level of Prostate-specific Antigen(PSA)in Women with Breast Cancer[J]. Cancer Epidemiol, 2013, 37(5): 613-618. DOI:10.1016/j.canep.2013.06.009 |
| [6] |
Yilmaz H, Ciftci S, Yavuz U, et al. Percentage of Free Prostate-specific Antigen(PSA)is a Useful Method in Deciding to Perform Prostate Biopsy with Higher Core Numbers in Patients with Low PSA Cut-off Values[J]. Kaohsiung J Med Sci, 2015, 31: 315-319. DOI:10.1016/j.kjms.2015.02.006 |
| [7] |
Milkovic B, Dzamic Z, Pejcic T, et al. Evaluation Freeto-total Prostate Specific Antigen(F/T PSA), Prostate Specific Antigen Density(PSAD)and(F/T)/PSAD Sensitivity on Reduction of Unnecessary Prostate Biopsies for Patients with PSA in Gray Zone[J]. Ann Ital Chir, 2014, 85(5): 448-453. |
| [8] |
国家食品药品监督管理总局. YY/T 1249-2014, 游离前列腺特异性抗原检测试剂盒[S]. 2014.
|
| [9] |
国家食品药品监督管理总局. 数据库[EB/OL]. (2016-12-01)[2017-02-01]. http://app2.sfda.gov.cn/datasearchp/gzcxSearch.do?searchcx=%E5%99%A8%E6%A2%B0%E6%9F%A5%E8%AF%A2&optionType=V2&formRender=cx.
|
| [10] |
中国食品药品检定研究院. 游离前列腺特异抗原(f-PSA)免疫测定用国家标准品[EB/OL]. (2012-06-15)[2017-10-01]. http://211.160.15.105/sell/uploadft/147351993009565619564248454730.pdf.
|
| [11] |
Fillée C, Tombal B, Philippe M. Prostate Cancer Screening:Clinical Impact of WHO Calibration of Beckman Coulter Access Prostate-specific Antigen Assays[J]. Clin Chem Lab Med, 2010, 48(2): 285-288. |
| [12] |
Foj L, Filella X, Alcover J, et al. Variability of Assay Methods for Total and Free PSA after WHO Standardization[J]. Tumour Biol, 2014, 35(3): 1867-1873. DOI:10.1007/s13277-013-1249-2 |
| [13] |
食品药品监管总局. 食品药品监管总局关于印发医疗器械质量监督抽查检验管理规定的通知[EB/OL]. (2013-10-11)[2017-12-20]. http://www.sda.gov.cn/WS01/CL0845/93336.html.
|
| [14] |
Salman JW, Schoots IG, Carlsson SV, et al. Prostate Specific Antigen as a Tumor Marker in Prostate Cancer:Biochemical and Clinical Aspects[J]. Adv Exp Med Biol, 2015, 867: 93-114. DOI:10.1007/978-94-017-7215-0 |
| [15] |
Furuya K, Kawahara T, Narahara M, et al. Measurement of Serum Isoform[-2] proPSA Derivatives Shows Superior Accuracy to Magnetic Resonance Imaging in the Diagnosis of Prostate Cancer in Patients with a Total Prostate-specific Antigen Level of 2-10 ng/ml[J]. Scand J Urol, 2017, 51(4): 251-257. DOI:10.1080/21681805.2017.1298155 |
| [16] |
张鹏, 王子明, 种铁, 等. 无前列腺疾病男性fPSA百分比正常参考值范围分析[J]. 四川大学学报(医学版), 2007, 38(5): 871-873. |
| [17] |
Erol B, Gulpinar MT, Bozdogan G, et al. The Cutoff Level of Free/total Prostate Specific Antigen(f/t PSA) Ratios in the Diagnosis of Prostate Cancer:a Validation Study on a Turkish Patient Population in Different Age Categories[J]. Kaohsiung J Med Sci, 2014, 30(11): 545-550. DOI:10.1016/j.kjms.2014.03.008 |
| [18] |
Caliskan S. Diagnostic Efficacy of Free Prostate-specific Antigen/total Prostate-specific Antigen Ratio for the Diagnosis of Prostate Cancer in Low Concentration(≤ 4 ng/ml)and Intermediate Levels of Total Prostate-specific Antigen(4.01-10.0 ng/ml)[J]. J Cancer Res Ther, 2017, 13(2): 279-283. DOI:10.4103/0973-1482.183177 |
 2018, Vol. 32
2018, Vol. 32 
