对于无菌注射液、注射用无菌制剂和滴眼剂,在《中国药典》中有专门章节描述可见异物的检查方法和可见异物的可接受标准。但对于非无菌原料药各国药典均没有明确要求,这在企业执行和依法检查时增加了不少障碍。因为要完全杜绝不溶性异物,在理论上是不可能的;但要承认不溶性异物的存在,又与异物混入产生混淆。本文将讨论可见异物的来源、检测方法、结构确认,以及可接受的标准。
1 可见异物的定义首先明确一点,可见异物和异物混入是完全不同的,可见异物是指在非无菌原料的生产、检验过程中,由于不可控的因素导致空气中悬浮的颗粒、活性炭过滤器脱落的炭粒,或设备管路内表面的脱落物进入原料药成品。
根据欧盟原料药委员会APIC的解释[1],可见异物分为两类:一类是指不可避免的,且对人体无害的微粒,这些无害物质或机械性微粒数量微小,它们不会影响药品的疗效和质量,如微小的碳粒或者离心机滤袋的纤维毛等;第二类是应当避免的典型性颗粒,这类是工艺中不期望或不应当出现的。当出现时应引发偏差调查,如脱落的头发、设备的零部件等。
可见异物有不同的名称,如中国药典称为可见异物,美国药典称为颗粒性物质(Particulate Matters),而APIC称为不溶性物质和外来颗粒(Insoluble Matter and Foreign Particles)等。
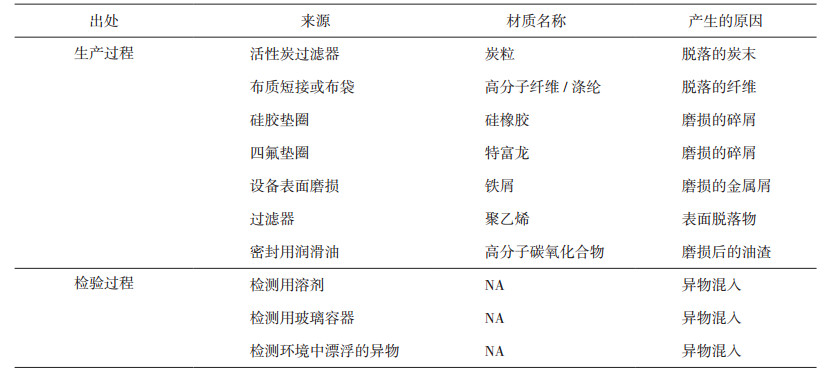
2 可见异物的来源、检测方法和结构确认 2.1 可见异物的来源对于可见异物的检测主要通过肉眼来判断,而肉眼看见的异物尺寸一般在50μm以上[2],其来源分为两个方面:一是生产过程引入,二是检验过程引入,见表 1。
|
|
表 1 可见异物的来源[3] |
粉末清洁度:取10~15 g样品置层流工作台白色背景下,铺开,用洁净的玻璃板压平,观察5秒;翻动样品压平后再观察5秒,如此操作3次。
滤液检查:取10~50 g样品,在层流工作台下装入预先清洁好的锥形瓶内,用预先过滤的试剂溶解,用手摇动锥形瓶,在黑色/白色背景下观察10秒。
滤膜检查:取上述溶液用0.8 μm过滤膜过滤,肉眼观察滤膜表面的颗粒性异物。
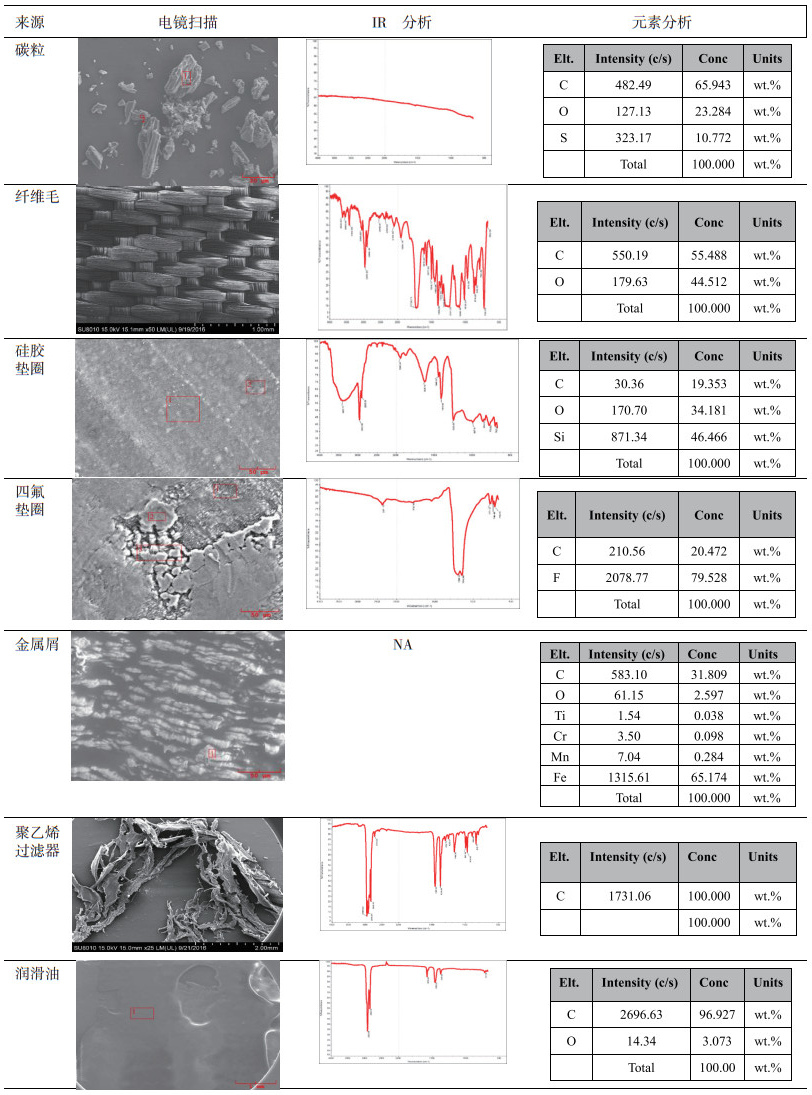
2.3 结构确认取滤膜过滤收集的可见异物,以表 1中物质作为参照物,同步进行冷场电镜扫描(CFSEM)、元素分析和IR分析。富集后可见异物的照片见图 1,可见异物富集后IR、元素分析和电镜扫描的照片见表 2。

|
图 1 对收集异物的电镜扫描(×1000) |
|
|
表 2 各参照物的电镜扫描、IR分析和元素分析汇总 |
对照显示,原料药中可见异物主要来自炭粉、布袋的纤维毛、垫圈的脱落物等[4]。
3 各国药典对可见异物的要求目前,各国药政机构或药典对非无菌原料药中可见异物的要求是非常有限的,指南的缺失导致对可见异物的判断存在不确定性,甚至产生不切实际的期望,不考虑异物的大小和数量,要求在原料药中完全杜绝可见异物。现将各国药典对注射液和注射用无菌制剂的要求归纳如下。
3.1 《中国药典》2015年版规定《中国药典》2015年版规定[5],供试品中不得检出金属屑、玻璃屑、长度超过2 mm的纤维、最大粒径超过2 mm的块状物;同时装量50 mL及以下注射液每支(瓶)中可见异物不得超过3个;装量50 mL以上注射液中可见异物不得超过5个;冻干产品每支(瓶)中可见异物不得超过3个;非冻干产品每支(瓶)中可见异物不得超过3个。
3.2 USP38规定USP38规定[6],对于注射剂容量100 mL以上的,每毫升液体中≧10 μm的不溶性颗粒不得超过25个,每毫升液体中≧25 μm的不溶性颗粒不得超过3个。
3.3 EP9.0规定EP9.0只规定[7]了用显微镜检测注射剂中颗粒性异物的方法,但对于肉眼可见异物,只提供了检测的方法,没有给出具体的限度。
基于上述分析,各国药典允许无菌制剂中可见异物的存在,但对于非无菌原料药都没有明确要求。鉴于原料药的生产特点,非无菌原料药中可见异物是不可避免的。
4 可见异物的推荐标准既然可见异物是对人体无害的物质,那么借鉴换产清洗残留10 ppm作为允许存在的限度,通过纤维、硅胶、特富龙等材质的密度和颗粒的大小,进而推算出可见异物允许存在的数量[1],见表 3。
|
|
表 3 非无菌原料药中可见异物的推荐标准 |
可见异物是在工艺中引入,且不可避免的,因此,应建立合理的检测方法和可接受标准。然而,尽管可见异物在工艺中不可避免,但通过结构鉴定发现其来源后,还是可以通过定期更换离心机滤袋、垫圈、过滤器等方式,减少因设备部件磨损或老化而产生的碎屑,进而尽可能减少可见异物的存在。因此,可见异物的多少体现了企业设备的可靠性、操作的规范性和GMP的符合性。
| [1] |
APIC. APIC Guidance on Insoluble Matter and Foreign Particles in APIs: Version 01[S]. 2015.
|
| [2] |
陈运动, 朱琳娇. 可见异物检查方法判断标准[J]. 医药导报, 2008, 27(5): 601-601. |
| [3] |
IPEC. Technically Unavoidable Particle Profile (TUPP) Guide[S]. 2015: 6-7.
|
| [4] |
丁锐, 纪宏, 庞青云, 等. 药品中可见异物结果考察与分析[J]. 药品评价, 2010, 7(20): 19-22. DOI:10.3969/j.issn.1672-2809.2010.20.005 |
| [5] |
0904可见异物检查法[S]//中国药典: 四部, 2015: 116-118.
|
| [6] |
788 Particulate Matter in Injections[S]//USP38: Volume 1, 2014: 550-553.
|
| [7] |
2. 9. 19. Particulate Contamination: Sub-Visible Particles[S]//Eur Ph 9. 0, 2016.
|
 2018, Vol. 32
2018, Vol. 32