CTD(Common Technical Document)是包含药品质量可控性、安全性和有效性方面内容的通用技术文档,由人用药品注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)发布,制定了药品注册申报资料的统一格式及内容要求。电子通用技术文档(Electronic Common Technical Document,eCTD)是对CTD的一种电子化呈现方式,它通过可扩展标记语言(Extensible Markup Language,XML)技术将按CTD要求的格式和内容编制的药品申报资料以电子化形式进行组织,并应用于药品注册申报和审评的一种注册文件技术格式。ICH M2 EWP(Expert Working Group)制定的eCTD指南提出了申报人向审评机构进行电子提交的标准结构和格式,采用XML对元数据和文档结构进行描述,同时对电子提交物的创造、查阅、生命周期管理及归档等方面做出了规范。ICH在2003年发布第一版eCTD指南,经过几年的修改完善,当前在国际通行的是2008年7月发布的V3.2.2版本[1]。
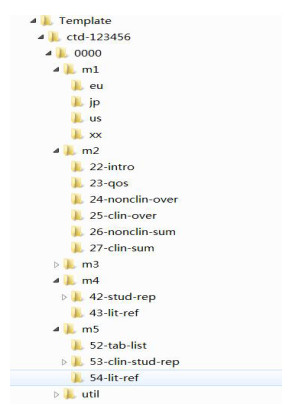
eCTD包括目录结构(Directory Structure)、内容文件(Content Flies)以及基于XML的eCTD实例(XML eCTD Instance)。ICH在官网提供了eCTD空白文件夹结构模板(见图 1),申报人可以在此基础上结合eCTD指南要求进行完善,制作药品注册申报资料,并提交至药品监管机构的eCTD信息化系统[2]。模块(Module,M)1至模块5的内容和格式参考CTD[3],util文件夹包含文档类型定义(Document Type Definition,DTD)和样式表(Stylesheet)的信息,分别置于dtd和style文件夹。DTD是用来规范XML的结构,stylesheet是对eCTD信息规范的说明,便于eCTD的使用、保存以及帮助技术人员了解eCTD。
|
图 1 eCTD空白文件结构模板 |
eCTD即是电子化的CTD注册申报方式,相对于传统的纸质资料提交,eCTD方式更方便、更环保。eCTD使申报资料的编制、申报、受理审评、归档存储和产品生命周期管理更加便捷,它可反复使用,能有效降低申请资料提交和评审的重复率,一方面降低了企业申报成本,另一方面提高了监管机构的审评效率:1)eCTD对申报资料的格式和内容做出了统一要求,保证了资料格式的一致性,对于申请人来说,一个产品如在多个国家进行注册申报,M2-M5的资料可以共享,有利于国际化申报,同时也利于各个国家和地区的药品监管部门的审评意见交流;2)1个eCTD申报可以涵盖同一品种不同剂型、不同规格的药品,简化了申报资料的编制工作;3)eCTD支持产品生命周期管理,能够展示提交的文档与复杂的申请生命周期的关系,如产品在上市后发生变更,仅需提交eCTD中发生变更的部分文件,无需重新提交整个文件;4)采用eCTD提交的申报资料,申请人需要严格按照eCTD行业指南和技术规范进行编制,药品监管部门在正式接收申报资料前,会通过eCTD信息化系统验证资料的规范性和完整性,确保申报资料符合监管要求,提高申报资料的质量,避免因申报资料的质量问题浪费审评资源;5)审评人员无需查看纸质申报资料,可借助eCTD信息化系统查阅、调取和检索相关资料,为审评工作提供多种便利条件。例如,通过书签和设定好的超级链接,使得审评人员可以简单快速地在庞大的注册资料中定位到相应的数据及资料;不仅可以调阅当前审评产品的历史资料,在不同产品审评时也可以横向比较,并可通过添加书签、备注等方式实时记录审评意见,也可通过eCTD信息化系统对同一申报材料进行分工,由多人审评;6)通过对申报资料进行电子化申报和管理,有利于企业减少资料打印、运输和存储成本,而药品监管部门也减少了物理存储空间及人力管理成本。
2 eCTD在国际范围的实施情况2000年ICH发布了CTD指南,要求在ICH成员国内,药品注册申报资料必须使用统一标准。2003年发布第一版eCTD指南,推行申报资料的电子提交及审评,现已更新至V3.2.2版本。截至目前,已在美国、欧盟、日本、加拿大和澳大利亚等40多个国家/地区实施。
美国食品药品管理局(Food and Drug Administration,FDA)于2003年开始使用CTD,2008年将eCTD作为唯一的申报资料电子提交方式。2017年5月5日起,FDA强制要求新药、仿制药、生物制品上市申请和主控文档实施eCTD申报;2018年5月5日起,强制要求新药临床试验申请实施eCTD申报[4]。FDA在2014年底统计的数据[5]显示,超过80%的新药上市申报资料是以eCTD提交的,在主控文档的可引用列表中超过50%的主控文档以eCTD的形式存在。
欧洲药品管理局(european medicines agency,EMA)在2004年开始试行CTD,从2008年7月起仅接收电子申报资料[6];2010年起,集中审评程序的申请强制要求使用eCTD。2015年3月13日,EMA出台了电子提交的时间表,推进药品注册的电子化,要求在2015年第三季度,非集中审批程序的申请必须以eCTD提交;在2017年第一季度,互认程序的申请必须以eCTD提交;在2018年第一季度,所有的注册程序都必须以eCTD提交[5]。
日本厚生省(Ministry of Health, Labour and Welfare)从2001年开始要求使用CTD,2004年开始使用eCTD,但推广较慢[7]。
加拿大卫生部(Health Canada)在2017年4月24日发布通知,要求从2018年1月1日起,人用药品申请类型以及所有追加信息、后续的申请/事务(药品申请文件指南中第1.3节)必须以eCTD形式提交[8]。
除上述国家外,不少国家和地区正采取全面或部分实现eCTD递交,如瑞士、沙特阿拉伯、南非、澳大利亚、新西兰和泰国等国家[9]。
3 我国实施eCTD情况以及面临的挑战 3.1 实施情况国家食品药品监督管理总局(China Food and Drug Administration,CFDA)在2010年9月发布通知,按《药品注册管理办法》附件2中化学药品注册分类3、4、5和6的生产注册申请的药学部分申报资料,可参照CFDA在ICH通用技术文档基础上制定的《化学药品CTD格式申报资料撰写要求》格式整理提交,同时提交电子版[10]。2011年6月,CFDA印发《化学药药学资料CTD格式电子文档标准(试行)》和《药品注册申报资料的体例与整理规范》,要求各省、自治区、直辖市食品药品监督管理局(药品监督管理局)以及总后勤部卫生部药品监督管理局遵照执行[11]。2017年3月,CFDA提出2017年药品注册管理工作将继续按照国务院《关于改革药品医疗器械审评审批制度改革的意见》的要求,继续以提高药品质量为核心,以提高审评效率和水平为重点,以鼓励创新为导向大力推进药品审评审批制度改革工作,重点做好改革受理模式,加快推进eCTD信息化系统建设,逐步实现化学仿制药的网上集中申报等几项工作[12]。国家食品药品监督管理总局药品审评中心正加快推进eCTD体系建设,目前已完成国际eCTD指导原则及技术规范研究和eCTD系统建设情况调研,制定了我国CTD格式内容要求及指导原则,现已将《药品电子通用技术文档结构》和《化学仿制药电子通用技术文档申报指导原则》再次公开征求意见[13]。
3.2 挑战1)一旦国家出台相关规定,将eCTD作为药品注册申报的唯一方式,不再需要提交纸质版资料存档,电子版申报资料即具备合法性。eCTD信息化系统应建设配套的安全体系,例如对各申报人进行唯一的身份认证,对申报人在提交和修改申报资料、审评人员在审评资料时的每一步操作留痕,防篡改、防抵赖等,以确保各申报人通过eCTD提交申报资料的安全和真实,不被他人修改和窃取。
2)目前通行的向eCTD信息化系统提交申报资料方式有两种——在线提交和光盘提交。在线提交方式要求eCTD信息化系统对每个申报人进行强行身份认证,对提交材料进行安全验证。大容量的电子文档在线提交,对于我国目前的网络基础条件而言,提交的难度较大。此外,电子申报资料文件较大,对系统存储要求高。
3)现有eCTD信息化系统中信息流的传递是单向的,从药品注册申请人传递到药品监管机构,而药品监管机构传递给药品注册申请人的信息流(例如对注册资料的疑问、注册资料补充等)需要通过其他途径(例如电话、传真、电邮等)来完成。从发展趋势来看,信息的传递也应双向发展,在进行eCTD信息化系统设计时应注重信息流的双向传递,即药品监管机构的意见回复、发补要求等也应该通过电子通道来完成。
4)CFDA在2016年8月发布公告,要求将直接接触药品的包装材料和容器、药用辅料由单独审批改为在审批药品注册申请时一并审评审批[14]。从系统设计开发角度看,如何将eCTD信息化系统中原辅料相关数据与药品注册数据信息进行关联,是一个难点。
5)中药制剂作为我国的特色,在国内制剂市场占有很大比重,目前我国从化药仿制药开始试行eCTD,今后势必将推广到中药制剂的注册申报。为了能更好地把中药制剂推广到国外,适应全球通行的eCTD申报方式,对制药企业来说,应该严格按照CTD对申报资料内容的要求,提高申报材料的质量;而监管部门,需要尽早对中药制剂注册eCTD申报做好政策研究。
6)以eCTD形式提交的药品注册申报资料要求较高,制作难度大,我国刚开始试行,熟悉此项工作的专业人员数量较少,如何制作出能够顺利通过eCTD信息化系统验证的申报资料需要大量培训及实践。另一方面,对于药品监管机构的审评人员来说,熟练利用eCTD信息化系统来进行药品注册申报资料的审评也离不开大量的培训和实践。
4 结语eCTD作为一种先进的、格式化的药品注册事务申请标准,可以极大地减少申请者与审评者的工作量,并显著提高医药企业和药品监管机构之间的数据交换效率,加快药品注册审批速度,已经被越来越多国家的药品监管部门所接受,这给药品注册,尤其是新药开发工作带来了巨大的促进和变革。我国如何顺利实施eCTD,对于医药行业和药品监管部门来说既是机遇也是挑战。
| [1] |
eCTD Specification and Related Files[EB/OL]. (2017-08)[2017-12-10]. http://estri.ich.org/eCTD/index.htm.
|
| [2] |
陈秋羽, 朱永宏, 赵利斌, 等. 欧盟药品注册申请中电子文档递交的应用与实践[J]. 药物评价研究, 2014, 37(5): 401-403. |
| [3] |
夏莉, 曾苏. 浅谈我国仿制药的通用技术文件格式注册文件[J]. 中国药学杂志, 2016, 51(4): 329-334. |
| [4] |
Electronic Common Technical Document (eCTD)[EB/OL]. (2017-10-06)[2017-12-10]. https://www.fda.gov/drugs/developmentapprovalprocess/formssubmissionrequirements/electronicsubmissions/ucm153574.htm.
|
| [5] |
Zhu X L, Bin L, Yang D S, et al. Implementation Strategy for eCTD Electronic Submission in China Based on Experiences from ICH Countries[J]. Chin. Pharm. Sci, 2016, 25(7): 552-558. |
| [6] |
EMEA Implementation of Electronic-only Submissions and eCTD Submissions in the Centralised Procedure: Statement of Intent[EB/OL]. (2008-01-22)[2017-12-10]. http://www.ema.europa.eu/docs/en_GB/document_library/Regulatory_and_procedural_guideline/2009/10/WC500004091.pdf.
|
| [7] |
eCTD提出状况(2017. 9. 30现在)[EB/OL]. (2017-10-05)[2017-12-10]. http://www.pmda.go.jp/files/000220412.pdf.
|
| [8] |
Notice-Mandatory use of the Electronic Common Technical Document (eCTD) format[EB/OL]. (2017-04-24)[2017-12-10]. http://www.hc-sc.gc.ca/dhp-mps/prodpharma/activit/announce-annonce/ectd-mandatorynotice-avis-obligatoire-eng.php.
|
| [9] |
刘晓丹, 陆峰, 何伍. eCTD格式申报资料模式的探讨与展望[J]. 中国医药工业杂志, 2017, 48(5): 769-773. |
| [10] |
关于按CTD格式撰写化学药品注册申报资料有关事项的通知[EB/OL]. (2010-09-25)[2017-12-10]. http://www.sfda.gov.cn/WS01/CL0844/54391.html.
|
| [11] |
关于印发化学药药学资料CTD格式电子文档标准(试行)和药品注册申报资料的体例与整理规范的通知[EB/OL]. (2011-06-27)[2017-12-10]. http://www.sfda.gov.cn/WS01/CL0844/63576.html.
|
| [12] |
深化改革、鼓励创新, 全国药品注册管理工作会议在京召开[EB/OL]. (2017-03-23)[2017-12-10]. http://www.cfda.gov.cn/WS01/CL0050/171031.html.
|
| [13] |
关于再次征求《药品电子通用技术文档结构》和《化学仿制药电子通用技术文档申报指导原则》意见的通知[EB/OL]. (2017-10-17)[2017-12-10]. http://www.cde.org.cn/news.do?method=largeInfo&id=314045.
|
| [14] |
总局关于药包材药用辅料与药品关联审评审批有关事项的公告[EB/OL]. (2016-08-10)[2017-12-10]. http://www.cfda.gov.cn/WS01/CL0087/162540.html.
|
 2018, Vol. 32
2018, Vol. 32 