2. 湖南省常德市食品药品检验所, 常德 415000
2. Changde Institute for Food and Drug Control, Changde 415000, China
青阳参为萝藦科鹅绒藤属植物青阳参Cynanchum otophyllum Schneid.的干燥根,主产于云南、湖南、广西、贵州、四川和西藏等省区[1],具有强筋健骨、健脾和胃、祛风解痉的功效,用于腰肌劳损、筋骨疼痛、食欲不振、癫痫、小儿惊风。在云南白族、彝族、纳西族、傈僳族等少数民族中作药材使用。白族药名为嘟巴优,纳西族药名为“白药根”“大白药根”,彝族药名为“期夺齐” [2]。青阳参药材标准收录于《云南省中药材标准》2005年版[3]和《湖南省中药材标准》2009年版中[4]。现行标准中均缺乏含量测定项目。
青阳参中化学成分复杂,前期本课题组报道了苯乙酮类成分的含量测定[5-7]。C21甾体苷类化合物也是青阳参典型的特征性成分,是其主要活性成分[8-16]。但由于该类成分结构复杂,缺乏商品性的对照物质供应。有文献报道测定了青阳参中7个C21甾体苷的含量[17]和青阳参苷乙的含量[18]。另有文献报道测定青阳参中的苷元含量[19]或者将苷类水解后测定其苷元含量[20-21]。
青阳参苷甲是青阳参苷元在3位接2个加拿大麻糖,末端接1个夹竹桃糖组成的典型甾体苷类成分(结构式见图 1)。其结构特殊,专属性较好,具有较好的抗肝炎作用,特别是迁延性肝炎和慢性肝炎,并且具有药效高、毒性低等优点[22],是该药材的药效物质基础之一,可作为其质控指标。
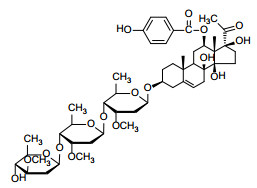
|
图 1 青阳参苷甲结构式 |
本课题组建立青阳参中青阳参苷甲对照品的制备方法,并以青阳参苷甲指标性成分建立了HPLC法对16批青阳参药材测定了青阳参苷甲的含量,同时测定了同属药材白前、白薇和徐长卿的含量作为参照。
1 仪器、试药及样品 1.1 仪器2695型液相色谱仪(沃特世公司),2998型二极管阵列检测器(沃特世公司),QUINTIX313-1CN型万分之一电子天平(Sartorius公司),M S E 1 2 5 S型十万分之一电子天平(Sartorius公司),KQ-300DV型超声波清洗器(江苏昆山市超声仪器有限公司),500MHz-FT核磁共振仪(BRUKER公司),6320型ESI质谱仪(安捷伦公司),全自动纯化系统(沃特世公司),Milli-Q超纯水仪(密理博公司),235型旋转蒸发仪(BUCHI公司),IN10MX型傅里叶变换显微红外光谱仪(Thermo公司),UV-2600型紫外分光光度计(岛津公司)。XSelect C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;沃特世公司)。
1.2 试药Sephadex LH-20型葡聚糖凝胶(Pharmacia公司),柱层析用硅胶(200~300目,青岛海洋化工厂);乙腈为HPLC级(Fisher公司),乙醇、三氯甲烷、甲醇、乙酸乙酯均为分析纯(国药集团化学试剂有限公司),水为Milli-Q纯化水。
1.3 样品药材来自产地采集,编号1~16样品经中国食品药品检定研究院民族药室郑健研究员鉴定为萝藦科鹅绒藤属植物青阳参Cynanchum otophyllum Schneid的干燥根;编号17~18样品鉴定为柳叶白前C. stauntonii (Decne.) Schltr. ex H. Lévl.的干燥根及根茎;编号19~20样品鉴定为白薇C. atratum Bunge.的干燥根及根茎;编号21~22样品鉴定为徐长卿C. paniculatum (Bunge) Kitag.的干燥根及根茎。
2 方法与结果 2.1 青阳参苷甲的分离与结构鉴定取药材粉末(产地丽江)10.0 kg,加乙醇回流提取3次,每次80 L,得浸膏450 g。将浸膏(400 g)采用硅胶柱,以氯仿-甲醇(1:0~1:1)梯度洗脱,得6个流分(Fr.1~Fr.6),Fr.5(20 g)经葡聚糖凝胶柱,氯仿-甲醇(1:1)洗脱,得5个亚流分(Fr.5-1~Fr.5-5)。Fr.5-3(5 g)经制备HPLC(色谱柱:Waters XBridge OBD 30 mm× 250 mm,10 μm;流动相:60%甲醇;流速:10 mL·min-1;检测波长:258 nm)分离纯化得化合物1(1.5 g,tR = 25.8 min),采用MS、1H-NMR和13C-NMR法鉴定化合物结构。
化合物1:白色无定型粉末(甲醇);ESI-MS m/z 933 [M+H]+;1H-NMR (CDCl3,500 MHz) δ:5.32 (1H,br s,H-6),5.25 (1H,dd,J = 9.5、2.0 Hz,H-1''),5.15 (1H,dd,J = 9.5、2.0 Hz,H-1'''),4.86 (1H,dd,J = 8.5、4.5 Hz,H-12),4.75 (1H,dd,J = 9.5、2.0 Hz,H-1''''), 4.51 (1H,m,H-3),2.11 (3H,s,CH3-21),1.55 (3H,s,CH3-18),1.11 (3H,s,CH3-19);13C-NMR (CDCl3,125 MHz) δ:38.7 (C-1),27.6(C-2),77.9 (C-3),38.7 (C-4),139.4 (C-5),118.7 (C-6),34.7 (C-7),74.4 (C-8),44.5 (C-9),37.1 (C-10),24.4 (C-11),73.2 (C-12),58.5 (C-13),89.1 (C-14),33.6 (C-15),32.0 (C-16),92.4 (C-17),10.5 (C-18),18.3 (C-19),208.2 (C-20),29.7 (C-21),163.2 (C-1'),127.4 (C-2'),131.6 (C-3'),121.5 (C-4'),150.7 (C-5'),122.7 (C-6'),131.7 (C-7'),96.1 (C-1''),37.1 (C-2''),77.5 (C-3''),82.5 (C-4''),68.6 (C-5''),18.4(C-6''),58.5 (C-7''),100.4 (C-1'''),37.2 (C-2'''),77.5 (C-3'''),83.1 (C-4'''),68.6 (C-5'''),18.3 (C-6'''),58.7 (C-7'''),102.1 (C-1''''),37.1 (C-2''''),81.1 (C-3''''),76.2 (C-4''''),72.6 (C-5''''),18.2 (C-6''''),57.1 (C-7'''')。以上数据与文献[15]报道的数据基本一致,故鉴定化合物1为青阳参苷甲。
2.2 含量测定 2.2.1 色谱条件与系统适用性试验色谱柱:Waters XSelect C18柱(4.6 mm× 2 5 0 m m,5 μ m);流动相:乙腈-水溶液(43:57);流速:1.0 mL·min-1;检测波长:223 nm;柱温:30 ℃;进样量:10 μL。理论板数按青阳参苷甲理论板数为10356,分离度为2.58,色谱图见图 2。
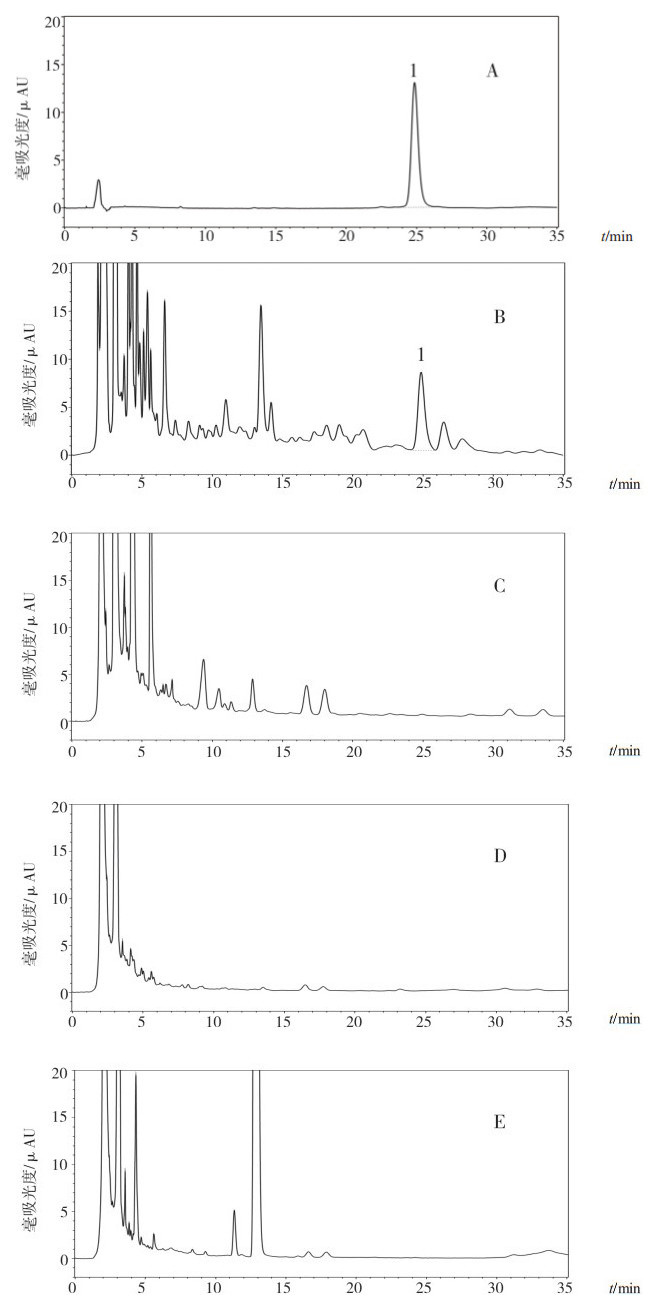
|
图 2 对照品和青阳参及同属药材含量测定色谱图 A.对照品;B.青阳参;C.白薇;D.白前;E.徐长卿;1.青阳参苷甲。 |
取青阳参苷甲对照品适量,精密称定,加甲醇溶解制成1124 μg·mL-1的溶液作为对照品储备溶液;再用甲醇稀释制成56.20 μg·mL-1的溶液,用0.45 μm的微孔滤膜过滤,取续滤液作为对照品溶液。
2.2.3 供试品溶液的制备取药材粉末(过4号筛)0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇10 mL,称定重量,超声(功率300 W,频率40 kHz)处理30 min,放至室温,再称定重量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.2.4 线性关系考察精密吸取对照品储备溶液适量,加甲醇配制成5.62、11.24、22.48、56.20、112.4、224.8 μg·mL-1的对照品系列溶液,按“2.2.1”节下的色谱条件测定,以对照品质量浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标绘制标准曲线,并进行线性回归,得回归方程:
Y= 85117265X-3291,r= 0.9998
结果表明青阳参苷甲质量浓度在5.62~224.8 μg·mL-1范围内与峰面积呈良好的线性关系。
2.2.5 检测下限与定量下限测定取“2.2.2”节下对照品溶液用甲醇逐级稀释后进样测定,测得青阳参苷甲的检测下限(S/N=3时)为0.15 μg·mL-1,定量下限(S/N=10)为0.56 μg·mL-1。
2.2.6 精密度试验精密吸取对照品溶液10 μL,按“2.2.1”节下的色谱条件,连续进样6次,测定峰面积,计算峰面积的平均值为1256782,RSD为0.93%,表明仪器精密度良好。
2.2.7 重复性试验取样品(编号1)粉末,约0.5 g,共6份,精密称定,按“2.2.3”节下方法制备供试品溶液,按“2.2.1”节下的色谱条件测定,结果青阳参苷甲平均含量为0.043%,RSD为1.26%,表明本试验重复性良好。
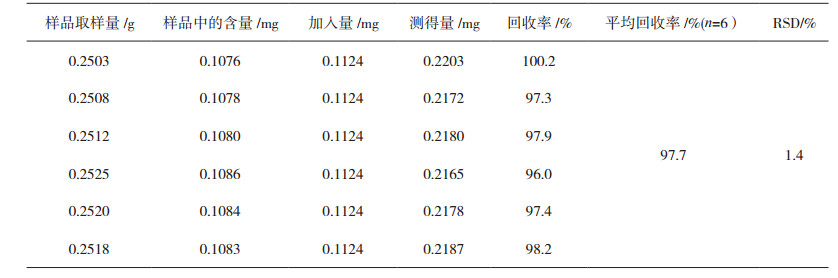
2.2.8 加样回收率试验取已知含量的同一批样品(编号1),6份,每份0.25 g,分别置具塞锥形瓶中,依次精密加入浓度为112.4 μg·mL-1的青阳参苷甲对照品溶液1.0 mL及甲醇9 mL,称量,按“2.2.3”节下方法自“超声(功率300 W,频率40 kHz)处理30 min”起操作,制备供试溶液。按“2.2.1”节下的色谱条件测定,计算回收率,结果见表 1。
|
|
表 1 青阳参苷甲加样回收试验结果 |
精密吸取同一供试品溶液(样品编号1),分别于配制后0、2、4、8、12和24 h,按“2.2.1”节下色谱条件测定峰面积,青阳参苷甲峰面积平均值为986849,RSD为0.35%,结果表明供试品溶液在24 h内稳定。
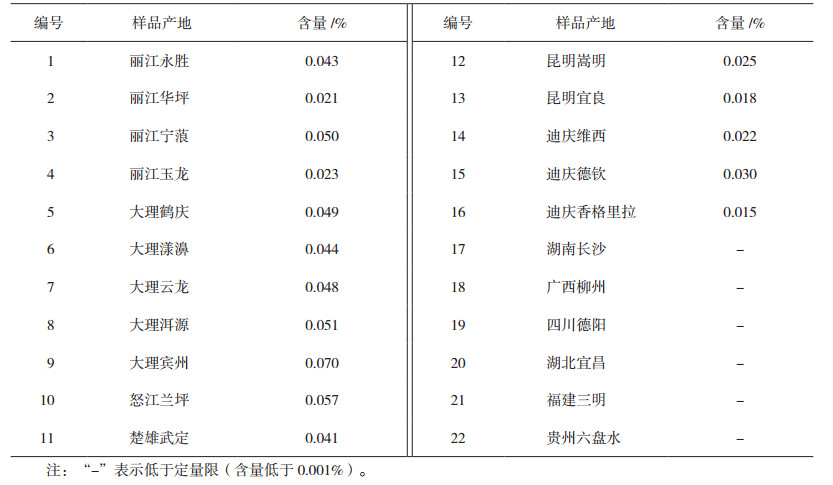
2.2.10 样品含量测定对收集的各地样品,按“2.2.3”节下方法制备供试品溶液,按“2.2.1”节下的色谱条件测定,用外标法计算含量,结果见表 2。
|
|
表 2 样品含量测定结果(n = 2) |
经二极管阵列检测器在线检测,青阳参苷甲在258 nm处有最大吸收(见图 3),故以258 nm作为检测波长测定青阳参苷甲的含量。

|
图 3 青阳参苷甲紫外光谱图 |
针对青阳参苷甲的结构以及理化性质,分别对提取溶剂、提取方法以及提取时间进行了考察,筛选出合理的提取方法。
在试验过程中分别考察了以甲醇、70%甲醇、50%甲醇作提取溶剂,样品含量测定结果一致,因此选取甲醇为提取溶剂。又以甲醇为提取溶剂,考察了超声20、30、40 min提取情况,结果表明,超声20 min提取已经完全。故最终选择甲醇作为提取溶剂超声20 min作为前处理条件。
3.3 含量指标限度的确定从表3可知,16批青阳参药材中均检出青阳参苷甲,但同属3种药材白前、白薇和徐长卿中均未检出青阳参苷甲,采用此成分为含量测定指标具有较强的专属性。含量测定结果表明,16批样品中青阳参苷甲含量范围为0.015%~0.070%,其中有14批在0.020%以上。因此,青阳参药材的质量标准提升草案中青阳参苷甲的含量限度拟确定为0.020%。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 第63卷. 北京: 科学出版社, 1977: 377-378.
|
| [2] |
云南省食品药品监督管理局. 云南省中药材标准第4册[S]. 2005: 61-62.
|
| [3] |
卫生部药品生物制品检定所. 中国民族药志第一卷[M]. 1984: 312-316.
|
| [4] |
湖南省食品药品监督管理局. 湖南省中药材标准[S]. 长沙: 湖南科学技术出版社, 2009: 227.
|
| [5] |
昝珂, 黄莉莉, 刘杰, 等. HPLC法同时测定民族药材青阳参中6个酚类成分的含量[J]. 药物分析杂志, 2017, 37(8): 1447-1452. |
| [6] |
昝珂, 郑健, 过立农, 等. HPLC法测定民族药材青阳参中对羟基苯乙酮的含量[J]. 中国药事, 2015, 29(12): 1310-1314. |
| [7] |
昝珂, 张欣, 刘杰, 等. HPLC法测定民族药材青阳参中首乌二苯酮的含量[J]. 中国药事, 2016, 30(5): 472-476. |
| [8] |
昝珂, 过立农, 郑健, 等. 民族药材青阳参的化学成分研究[J]. 中国中药杂志, 2016, 41(1): 101-105. |
| [9] |
中华人民共和国卫生部药品标准中药成方制剂第十二册[S]. 1997: 84.
|
| [10] |
艾俊丽, 田猛, 杨庆雄. 青阳参C21甾体苷类化学成分研究进展[J]. 贵州师范大学学报:自然科学版, 2012, 30(4): 106-115. |
| [11] |
黎丽云, 殷志琦, 张庆文, 等. 云南民间药青阳参的研究进展[J]. 海峡药学, 2011, 23(4): 1-5. |
| [12] |
周进康, 吕娟, 周鹏, 等. 青阳参化学成分和药理活性的研究进展[J]. 贵州师范大学学报, 2010, 26(12): 23-26. |
| [13] |
李祥, 张敉, 向诚, 等. 青阳参中C21甾体成分研究[J]. 中国中药杂志, 2014, 39(8): 1450-1456. |
| [14] |
殷敏敏, 殷志琦, 张健, 等. 青阳参乙酸乙酯萃取部位的化学成分[J]. 中国药科大学学报, 2013, 44(3): 213-218. DOI:10.11665/j.issn.1000-5048.20130305 |
| [15] |
Mu Q Z, Lu J R, Zhou Q L. Two New Antiepilepsy Compounds-otophyllosides A and B[J]. Scientia Sinica (series B), 1986, 29(3): 295-301. |
| [16] |
杨庆雄. 人工栽培青阳参化学成分及抗抑郁活性研究[J]. 贵州科学, 2007, 25(supp): 421-426. |
| [17] |
杨金铧, 殷敏敏, 张健, 等. HPLC波长切换法测定青阳参中7个C21甾体苷的含量[J]. 中国药科大学学报, 2014, 45(2): 200-204. DOI:10.11665/j.issn.1000-5048.20140212 |
| [18] |
昝珂, 张睿, 郑健, 等. HPLC法测定民族药材青阳参中青阳参苷乙的含量[J]. 中国药事, 2016, 30(10): 45-49. |
| [19] |
李魏林, 何珺, 李洪庆, 等. HPLC测定青阳参中的青阳参苷元[J]. 华西药学杂志, 2009, 24(6): 663-664. |
| [20] |
张琳, 李晓誉, 许世芳, 等. 双波长HPLC测定青阳参中青阳参苷元和告达亭的含量[J]. 中国现代应用药学, 2014, 31(3): 317-319. |
| [21] |
刘云怀, 黄云先, 木书林, 等. 青阳参质量标准的改进研究[J]. 中国卫生标准管理, 2015, 25(6): 130-134. |
| [22] |
中国科学院昆明植物研究所. 青阳参苷甲、苷乙在制药中的应用: 中国专利: 1148958[P]. 1997-05-07.
|
 2018, Vol. 32
2018, Vol. 32