1998年,日本政府启动了药品质量再评价工程,以厚生劳动省(MHLW)为主导、由医药品医疗器械管理局(PMDA)组织,国立医药品食品卫生研究所(NIHS)负责具体实施。其主要目的是提高已上市化学固体口服制剂质量,使不同厂家生产的同一种药品与原研药(在日本上市)的临床疗效一致[1-3]。在此之前,日本曾实施了3次药效学再评价工作[4]。结合近20年的仿制药质量再评价成果;对已通过评价的品种进行市场抽查检验;定期召开质量信息研讨会,综合上述3个方面的工作,形成了日本蓝皮书。
1 蓝皮书的背景 1.1 药品质量再评价概要药品质量再评价的实施时间为1998年5月-2012年6月,主要针对1995年3月前审批的处方药,通过“在严格的溶出度试验条件下,在各种介质中均具有较高的相对稳定的溶出”这一严格要求,来提高药品批间稳定性及体内外相关性。对已经完成质量再评价、溶出项目符合要求的品种及正在进行再评价的品种,在1998年开始编辑出版的《医疗用医药品品质情报集(橙皮书)》中收载并予以公布[5]。
1.2 仿制药质量信息研讨会的启动2008年,为进一步确保仿制药的可靠性,推进药品质量再评价工作更加深入系统地开展,NIHS组织了“仿制药质量信息研讨会”。研讨会由仿制药药学、临床等多个专业的专家参加,在从学术观点上讨论仿制药质量相关信息,同时,也开展必要的试验和评估。对通过质量再评价的品种开展市场抽查检验(即质量保证对策检验),结合检验发现的问题,PMDA和NIHS定期组织召开仿制药质量研讨会,目前,已经召开了18次,研讨会的全部内容及时发布在NIHS网站。
1.3 蓝皮书的发布及规划结合仿制药的审批、质量再评价、市场抽验,对每个品种的最新质量信息进行整理汇总,以蓝皮书的形式予以发布。2017年4月1日,日本厚生省网站正式推出了仿制药质量信息蓝皮书。该蓝皮书旨在进一步提高仿制药质量的可信性,以仿制药质量信息研讨会为基础,将仿制药质量相关的学术评价、监管指导等活动相互联动,建立了完整的质量保证机制。仿制药质量信息研讨会以存在质量风险的品种及在市场流通中被广泛使用的品种为中心,制定了以优先度为序列的系统性质量保证方针,NIHS、国立感染证研究所及地方研究所对上市后的仿制药品开展抽样检验。以检验结果为基础,汇总各有效成分的质量抽查检验结果及相关质量信息,编辑成资料集(蓝皮书)后动态发布。
2 蓝皮书收载的内容日本蓝皮书[6]记载了5项内容的最新信息:①品种基本信息,包括有效成分、品种名称、适应证/用法、用量、添加剂、解离常数、溶解度、稳定性、膜透过性、基于生物药剂学分类系统(biopharma celctics classrfication,BCS)和生物等效性豁免选择(biowaiver option)、药效分类和规格;②生物等效性试验结果;③溶出试验结果;④仿制药的市场抽验结果;⑤附件,包括分析方法、相关信息和参考文献。
仿制药质量信息研讨会专门设立了工作小组,负责蓝皮书的编辑、校阅、研究和对外发布等工作。2017年3月31日,蓝皮书开始在HINS主页上发布,共发布了4种有效成分、76个品规的仿制药信息。
本文以熊去氧胆酸为例,介绍蓝皮书收录品种的详细信息。
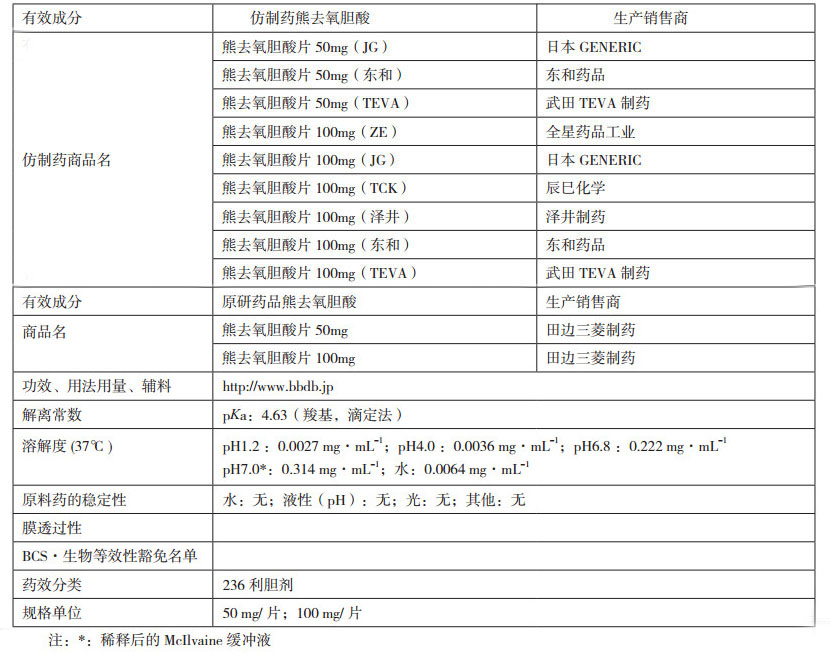
2.1 熊去氧胆酸上市品种的基本信息熊去氧胆酸上市收录品种的基本信息及相应的监测数据见表 1、表 2。
|
|
表 1 熊去氧胆酸片品种概况 |
|
|
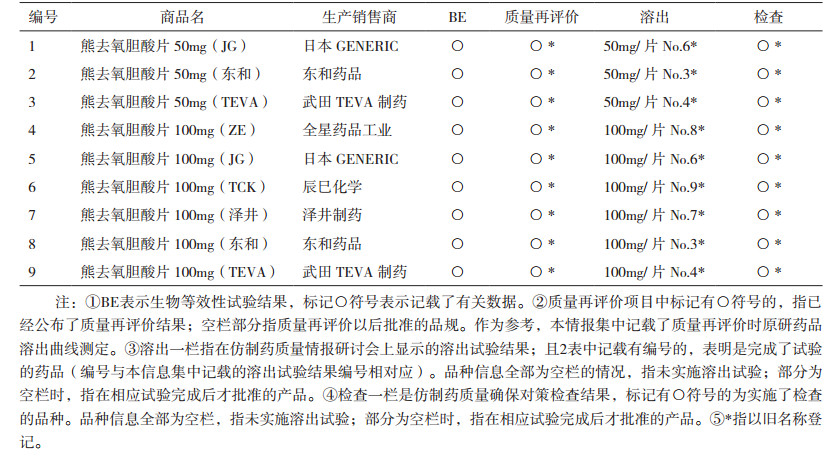
表 2 熊去氧胆酸片收载数据一览表 |
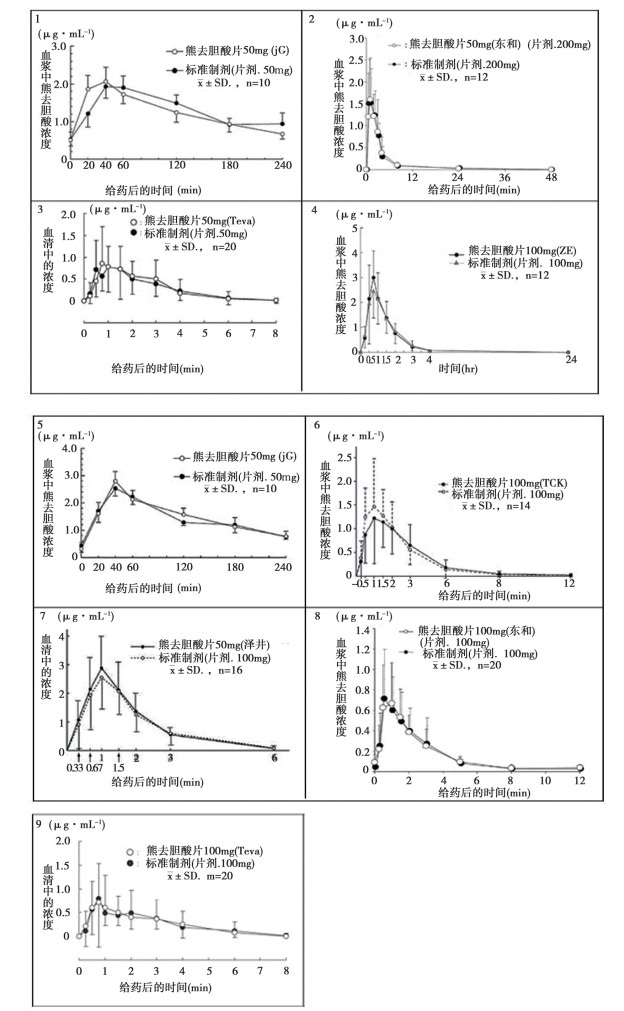
各个厂家熊去氧胆酸片的生物等效性试验结果见图 1。
|
图 1 各个厂家熊去氧胆酸生物等效性试验结果 注:1.日本GENERIC(50mg);2.东和药品(50mg);3.武田TEVA制药(50mg);4.全星药品工业(50mg); 5.日本GENERIC(100mg);6.辰巳化学(100mg);7.泽井制药(100mg); 8.东和药品(100mg);9.武田TEVA制药(100mg) |
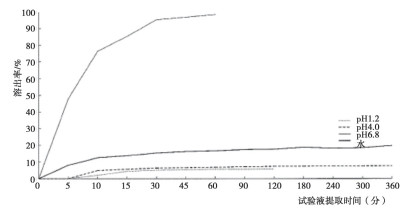
|
图 2 熊去氧胆酸原研品每片50mg的溶出曲线 注:1.有效成分:熊去氧胆酸;2.剂型:水剂;3.含量:50mg;4.试验用溶液:pH2,pH4,pH6.8,水;5.离心转速50rpm·min-1;6.表面活性剂:未使用。 |
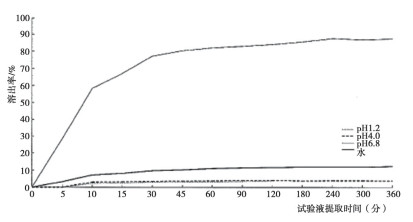
|
图 3 熊去氧胆酸原研品每片100mg的溶出曲线 注:1.有效成分:熊去氧胆酸;2.剂型:片剂;3.含量:100 mg;4.试验用溶液:pH1.2,pH4.0,pH6.8,水;5.离心转速50 rpm·min-1;6.表面活性剂:未使用。 |
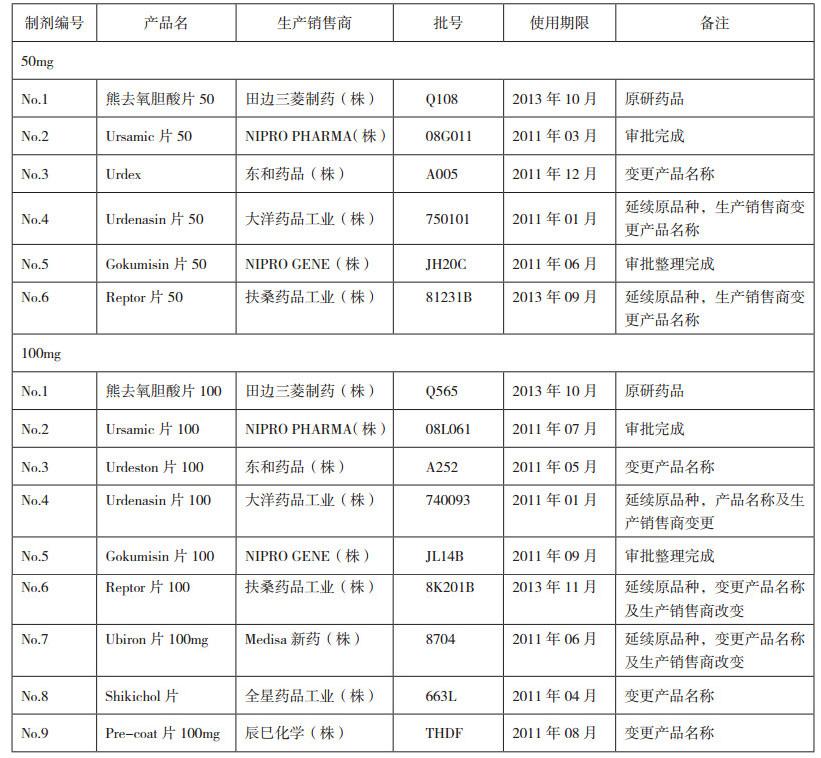
汇总了熊去氧胆酸2个规格、多个厂家的抽检情况,具体情况见表 3。50 mg熊去氧胆酸抽验品种溶出试验结果见图 4;100 mg熊去氧胆酸抽验品种溶出试验结果见图 5。
|
|
表 3 抽检的样品信息 |
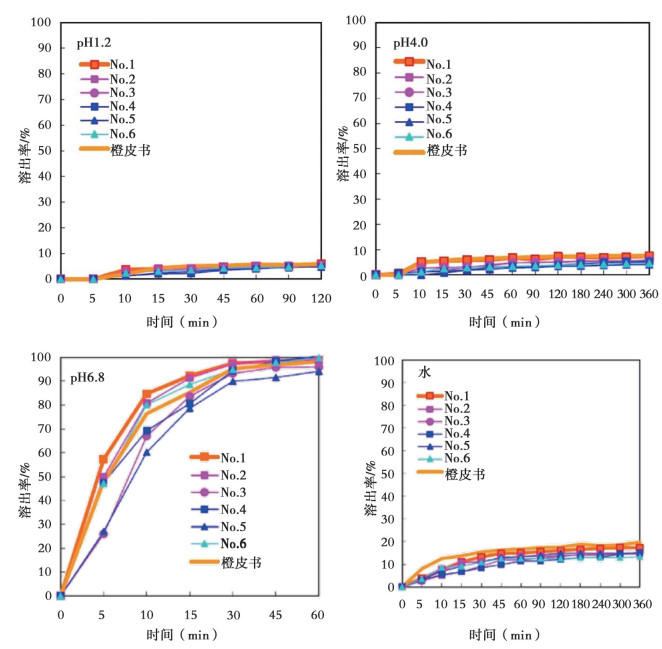
|
图 4 50mg熊去氧胆酸多家企业的溶出曲线 注:1. pH1.2;2. pH4.0;3. pH6.8;4.水。 |

|
图 5 100mg熊去氧胆酸多家企业的溶出曲线 注:1. pH1.2;2. pH4.0;3. pH6.8;4.水。 |
图 4和图 5中:No.1为原研药品的溶出曲线,橙皮书溶出曲线指质量再评价时的标准制剂溶出曲线。另外,溶出试验中把第2种介质作为溶出介质,以每分钟50转速度进行试验时,熊去氧胆酸片的溶出结果:50 mg片为30 min后80%以上、100 mg片为45 min后70%以上,所有制剂均符合要求。对于50 mg片,原研药品的溶出行为全部与橙皮书的溶出行为类似。在pH 1.2、pH 4.0及水作为溶出介质时,原研药品和橙皮书中收载的仿制药的平均溶出率在规定时间内均未达到50%;由于全部仿制药的平均溶出率在±9%的范围内,结论为各仿制药的溶出行为类似。在pH 6.8时,原研药品与橙皮书中收载的平均溶出率均在15 min内达到85%以上,结论为各仿制药的溶出行为类似。在pH 1.2、pH 4.0及水作为溶出介质时,所有仿制药的溶出行为与原研药或橙皮书收载的仿制药溶出行为类似。
对于100 mg片,原研药品和橙皮书收载的溶出行为在pH 6.8时有少许差异,仿制药的溶出行为位于两者之间,结论为溶出行为类似;且在其他溶剂中的溶出行为也类似。
2.4 市场抽验结果2008年,熊去氧胆酸的市场抽验结果全部合格。
2.5 附件附件包括3部分内容:①分析方法(溶出度试验);②相关信息;③参考文献。
以上为蓝皮书收载仿制药质量评价品种的信息以及查询方法,详见日本厚生省蓝皮书网址。
3 日本蓝皮书对我国仿制药一致性评价工作的启示仿制药质量再评价工作在日本开展了近20年,淘汰了约10%的不合格药品[7]。作为仿制药质量再评价的跟踪和实施,市场抽验及药品质量信息研讨会有效保证了口服固体仿制药药品质量的一致性和有效性,日本蓝皮书是对该项工作成果的集中系统整理,对我国开展仿制药一致性评价工作具有积极的启示。
3.1 构建中国上市后药品评价技术框架体系我国的仿制药质量和疗效一致性评价工作刚刚开始,既涉及政策问题,又涉及技术问题,在起初阶段必须设计好一致性评价的技术体系。日本的相关技术体系中包括了参比制剂的确定、评价方法、评价品种以及评价后的质量跟踪、橙皮书及蓝皮书中评价结果的汇总等。我国可以借鉴该体系的思路,逐步建立相关的技术指导原则和仿制药质量评价技术标准体系。随着研究的不断深入,可以参考日本“仿制药质量信息研讨会”的机制,结合国内特有情况,构建上市后药品信息监测机制和评价方式,建立健全我国已上市药品评价的长效机制。
3.2 建立仿制药口服固体制剂溶出曲线数据库日本在开展仿制药质量再评价过程中,逐步建立了仿制药溶出曲线数据库,作为评价后对具体品种质量监管的一种手段。我国也可以考虑在进行一致性评价时,组织各药品检验机构对生产企业报送的一致性评价资料进行复核,根据复核结果,逐步建立我国的口服固体制剂溶出曲线数据库。一方面为质量监管所用;另一方面,也可作为企业内控自身产品质量稳定的手段,激发企业对药品研发的认知和投入,提升我国制药行业的整体水平。
3.3 建立中国的橙皮书目前,我国拥有约18万个药品批准文号,以往法规体系允许以国内上市药品或批准的质量标准作为参比制剂,导致仿制药的质量良莠不齐。我国已上市药品质量评价工作尚处于起步阶段,存在的问题比较多[8-10],很难通过一次评价解决所有的问题。建议开展仿制药一致性评价,同时建立通用名品种信息数据库,收载同品种(以化学通用名计)的国内整体上市信息及质量概况,作为中国橙皮书的一个模块;同时,在橙皮书中明确界定仿制药研发使用的参比药品,使仿制药开发更趋科学合理。
4 结语仿制药质量和疗效一致性评价工作是我国药品科学监管的必然选择,也是一项长期、复杂和艰巨的任务。本文通过对日本多年仿制药质量再评价成果蓝皮书的介绍,剖析日本质量再评价工程体系设计的思路,希望能为我国的该项工作提供参考。
| [1] |
厚生省医薬安全局審査管理課签发. 医薬審第487号後発医薬品の生物学的同等性試験ガイドラインについて[S]. 平成9年.
|
| [2] |
日本厚生省医薬安全局審査管理課長签发. 医薬審第595号医療用医薬品の品質に係る再評価の実施手順等について[S]. 平成10年.
|
| [3] |
日本厚生省医薬安全局局長签发. 医薬審第634号医療用医薬品の品質に係る再評価の実施等について[S]平成10年.
|
| [4] |
宋春黎, 牛剑钊, 张启明, 等. 日本药品再评价制度介绍[J]. 中国药学杂志, 2014, 49(12): 1087-1090. |
| [5] |
牛剑钊, 刘佳, 李茂忠, 等. 日本仿制药品质一致性再评价介绍及对我国的启示[J]. 中国药事, 2013(4): 429-431. |
| [6] |
日本厚生省蓝皮书. [EB/OL]. [2017-03-10]. http://www.nihs.go.jp/drug/ecqaged/bluebook/list.html.
|
| [7] |
Chikako Y. Trends in the Quality Evaluation of Generic Products and Bioequivalence Guidelines[J]. Bull Natl Inst Health Sci, 2012, 130: 1-12. |
| [8] |
程鲁格. 药品呼唤上市后再评价[J]. 药物警戒, 2005, 2(4): 220-225. |
| [9] |
郭志鑫, 黄志禄, 姜典财, 等. 中日美药品上市后质量评价体系的比较[J]. 中国药事, 2009(7): 718-720. |
| [10] |
李曼, 王忠, 张象麟. 对我国药品上市后再评价工作现状的认识及探讨[J]. 中国药物警戒, 2011(4): 225-228. |
 2018, Vol. 32
2018, Vol. 32