甘草为豆科植物甘草、胀果甘草或者光果甘草的干燥根及根茎,具有补脾益气、清热解毒、调和诸药的功效[1],现代研究发现甘草中含有大量的甘草皂苷、黄酮、多糖成分,药理试验发现甘草中的黄酮成分具有抗炎、抗变态反应的作用,其总皂苷具有调节淋巴细胞数量和活性、抗衰老、美白的功效[2-5]。
酪氨酸酶是体内存在的一种氧化酶,其活性是黑色素形成的关键,也是影响皮肤颜色深浅的内在重要因素,它参与黑色素形成的多个环节,主要包括催化酪氨酸转化为多巴,再催化多巴形成多巴醌,继续催化后形成黑色素[6-8]。甘草皂苷具有美白作用,但是皂苷分子量大,不易被人体吸收,因此采用体外生物转化的作用实现皂苷的体外水解。本试验采用3种不同方法进行体外生物转化,并进行抑制酪氨酸酶活性试验。
1 试验材料与仪器KQ-500B型超声仪(昆山市超声仪器有限公司);AB-135S型十万分之一电子分析天平(瑞士酶特勒-托利多公司);DZKW-D-4型水浴锅(上海仪器仪表有限公司);UV-1100型紫外-可见分光光度计(上海天美科学仪器有限公司)。
甘草苷对照品(批号:111451-201507),甘草酸铵对照品(批号:111739-201501),对照品均来自中国食品药品检定研究院;L-多巴(批号:B21710),酪氨酸酶(蘑菇,活力500 U·mg-1,批号:D900202),维生素C(批号:B21293),均购自上海源叶生物科技有限公司;10000 U·mL-1β-葡糖苷酶(来源于黑曲霉,批号:S24786,购自上海源叶生物科技有限公司);蜗牛酶(批号:S10083,购自上海源叶生物科技有限公司);高活性干酵母菌粉(安琪酵母股份有限公司);乙腈(色谱纯),磷酸氢二钠,柠檬酸;娃哈哈纯净水;蒸馏水。
2 试验方法与结果 2.1 试验方法 2.1.1 甘草总皂苷制备称取甘草药材100 g,加水10倍量,煎煮两次,每次1 h;过滤;合并滤液。浓缩至相对密度为1.05~1.10;加无水乙醇至70%,放置12 h;高速离心(5000 r·min-1)5 min;上清液回收乙醇至无醇味。然后采用D101(预先处理好)进行分离,上样完成后,依次采用去离子水、30%乙醇、70%乙醇过量洗脱;收集70%乙醇洗脱部位,减压回收乙醇至无醇味;再采用正丁醇饱和水溶液对洗脱部位进行萃取,收集正丁醇液;冷冻干燥,经测定,甘草总皂苷含量达到51.8%。
2.1.2 生物转化试验蜗牛酶转化试验:取“2.1.1”节下的甘草总皂苷粉末200 mg,加pH 7.1的磷酸氢二钠-柠檬酸缓冲溶液,40℃恒温培养箱内放置30 min,再加入30 mg蜗牛酶,继续培养6 h,时时振荡,取出。采用0.45 μm滤膜过滤制备供试样品1。
酵母菌转化试验:取“2.1.1”节下的甘草总皂苷粉末200 mg置于锥形瓶中,加pH7.1的磷酸氢二钠-柠檬酸缓冲溶液50 mL,再加入体积分数1.5%的干性酵母菌粉,置40℃恒温培养箱中,保温发酵6 h,并时时振摇,发酵结束后用蒸馏水补足失重,置85℃水浴10 min灭菌,4500 r·min-1离心5 min;滤液蒸干,采用10 mL去离子水溶解,制备供试样品2。
黑曲霉转化试验:精密称取甘草总皂苷粉末200 mg置于锥形瓶中,加入适量pH 7.1的磷酸氢二钠-柠檬酸缓冲溶液,再加入1000 U活力的黑曲霉β-葡萄糖苷酶液,并补加缓冲溶液至反应体积为20 mL,置50℃恒温水浴锅中,保温酶解6 h,并时时振摇,滤液蒸干,采用10 mL去离子水溶解,制备供试样品3。
2.1.3 生物转化试验测定 2.1.3.1 HPLC测定方法色谱柱:kromasiol-C18硅胶色谱柱;柱温:30℃;检测波长:237 nm;流动相:以乙腈为流动相A,以0.05%磷酸溶液为流动相B,按表 1中的规定进行梯度洗脱。
|
|
表 1 流动相梯度表 |
混合对照品溶液制备:取甘草苷对照品、甘草苷铵对照品适量,精密称定,加70%乙醇分别制成每1 mL含甘草苷20 μg、甘草苷铵0.2 mg的溶液。
2.1.3.2 标准曲线绘制精密吸取混合对照品溶液1、2、5、10、15、20 μL,依次注入高效液相色谱仪,按“2.1.3.1”节下色谱条件进行测定,分别以甘草苷D、甘草酸铵对照品的进样量(μg)为横坐标(X),对应峰面积为纵坐标(Y)进行线性回归(结果见表 3、表 4、图 1、图 2)。
|
|
表 2 反应溶液组成 |
|
|
表 3 甘草苷标准曲线数据 |
|
|
表 4 甘草酸铵标准曲线数据 |
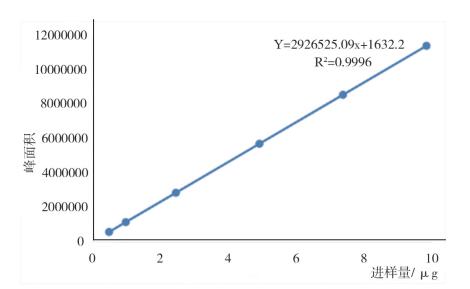
|
图 1 甘草苷标准曲线 |

|
图 2 甘草酸铵标准曲线 |
分别取混合对照溶液、供试样品1、供试样品2、供试样品3各10 μL,注入高效液相色谱仪,分别测定转化结果。
2.1.4 抑制酪氨酸酶试验 2.1.4.1 试剂制备pH 6.8的PBS缓冲溶液:A液,每1 L蒸馏水中含NaH2PO4·2H2O 7.80 g;B液,每1 L蒸馏水中含Na2HPO4·12H2O 17.80 g;将A液、B液灭菌后冷藏保存,临用时取等体积混合,调pH值为6.8,即得。
酪氨酸酶溶液:精密称取酪氨酸酶11.30 mg,置25 mL棕色容量瓶中,用pH 6.8的PBS缓冲溶液定容至刻度,制备得226 U·mL-1的酪氨酸酶溶液。
L-多巴溶液:精密称取L-多巴25.41 mg,置25 mL棕色容量瓶中,用pH 6.8的PBS缓冲溶液定容至刻度,制备得1.02 mg·mL-1的L-多巴溶液。
2.1.4.2 供试样品溶液制备维生素C阳性对照溶液:精密称取2.546 mg的维生素C置25 mL棕色容量瓶中,加蒸馏水定容至刻度,制备成0.102 mg·mL-1的维生素C储备液,并稀释成0.005、0.01、0.02、0.04、0.06、0.08 mg·mL-1不同浓度的维生素C阳性对照溶液,避光保存,备用。
甘草总皂苷溶液:称取甘草总皂苷20 mg左右,用pH 6.8的PBS缓冲溶液定容至10 mL容量瓶中,混匀,即得。
酶解液样品溶液:精密量取“2.1.2”节下酶解液20 mL,置85℃水浴保温10 min,杀酶后进行冷冻干燥,再用pH 6.8的PBS缓冲溶液定容至10 mL容量瓶中,再取出1.5 mL用PBS缓冲溶液定容至另一10 mL容量瓶中,混匀,即得。
2.1.4.3 抑制酪氨酸酶活性测定方法吸取“2.1.4.2”节下配制的一系列浓度的维生素C阳性对照溶液和供试样品溶液,按表 2方法加入反应试管中,得到C1、C2、T1、T2 4组反应溶液,每组设定3组平行试验,先置30℃水浴保温反应20 min,再将4组反应溶液混匀,每组各自加入0.5 mL L-多巴溶液,混匀后继续置30 ℃水浴保温反应20 min,计时反应结束后立即用分光光度计于475 nm处测定各样品反应溶液的吸光度值,记为AC1、AC2、AT1、AT2。
酪氨酸酶抑制率计算公式:
| $ 酪氨酸酶抑制率\% = \left( {1 - \frac{{{A_{\rm T1}} - {A_{\rm T2}}}}{{{A_{\rm C1}} - {A_{\rm C2}}}}} \right) \times 100\% $ |
式中:AT1-AT2,样品溶液吸光度值改变;
AC1-AC2,空白对照吸光度值改变。
按照以上测定方法吸取供试样品溶液进行测定,得各组样品吸光度值后,计算各供试样品酪氨酸酶抑制率,以酪氨酸酶抑制率均值为纵坐标,样品溶液浓度为横坐标,得维生素C抑制酪氨酸酶活性曲线。
2.2 试验结果 2.2.1 标准曲线结果试验结果得出甘草苷及甘草次酸的回归方程分别为:Y=2926525.09X+1632.2(r=0.99996),Y=659561X+33746(r=0.99998),结果表明甘草苷和甘草酸铵分别在0.4920~9.8400 μg、0.4520~9.0400 μg范围内线性关系良好。
2.2.2 生物转化测定结果将甘草苷、甘草酸铵混合对照溶液注入高效液相仪中,结果如图 3所示。
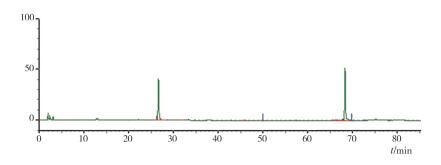
|
图 3 混合对照结果 |
通过计算得出2个对照品分离度大于2.0,塔板数大于5000。
按照“2.1.3.1”液相测定方法对各样品进行测定;结果如图 4、图 5、图 6、表 5所示。
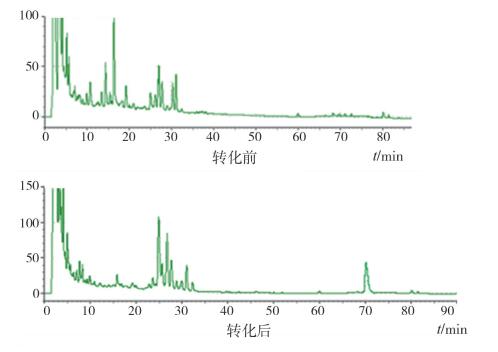
|
图 4 蜗牛酶生物转化结果 |
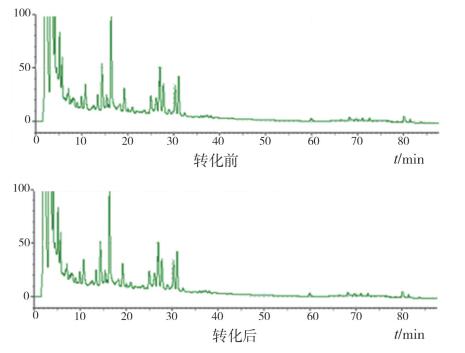
|
图 5 酵母菌生物转化结果 |
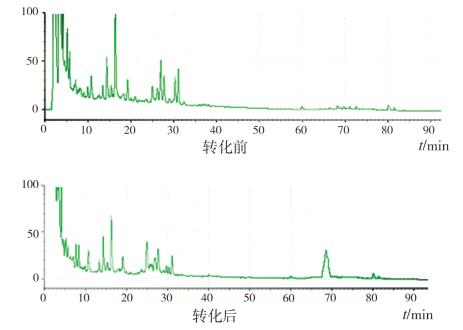
|
图 6 黑曲霉生物转化结果 |
|
|
表 5 各个样品生物转化试验结果 |
观察图 3、图 4、图 5、图 6得出,与甘草混合对照品溶液比较,蜗牛酶、黑曲霉下的样品在68.13~71.48 min之间出现了甘草酸铵峰,结合表 5得出蜗牛酶、黑曲霉作用后的样品甘草苷峰面积下降,计算得出两者的转化率分别为28.14%、36.72%。而经酵母菌发酵转化后测定甘草苷含量没有明显变化,说明酵母菌粉并不能水解甘草苷,甘草苷也没有发生转化反应。
2.2.3 抑制酪氨酸酶活性试验结果 2.2.3.1 维生素C抑制酪氨酸酶活性结果按照“2.1.4.2”节下方法进行试验,得出维生素C抑制酪氨酸酶活性曲线。结果如表 6、图 7所示。
|
|
表 6 维生素C酪氨酸酶抑制率测定结果 |
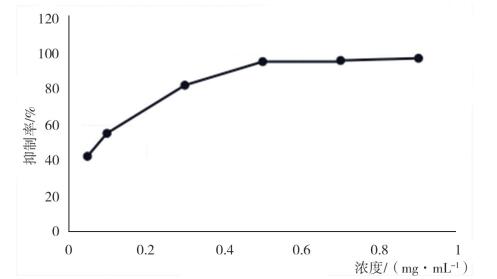
|
图 7 维生素C酪氨酸酶抑制率测定结果 |
结果表明,在试验浓度范围内,维生素C对酪氨酸酶抑制率的趋势为先随维生素C浓度的增大而增大,抑制率达到最高值后则不再随样品浓度的增大而变化,运用SPSS17.0统计软件分析可知,半抑制率IC50为0.073 mg·mL-1。
2.2.3.2 生物转化样品抑制酪氨酸酶活性结果对供试样品1、2、3和甘草总皂苷样品分别进行抑制酪氨酸酶试验,结果如表 7、图 8所示。
|
|
表 7 甘草总皂苷及各酶解液酪氨酸酶抑制率测定结果 |
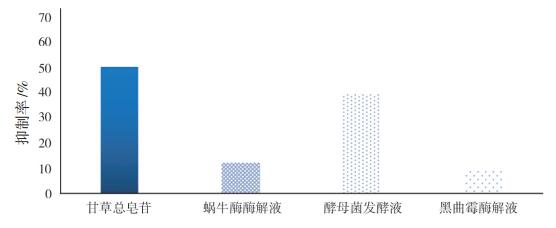
|
图 8 甘草总皂苷及各酶解液酪氨酸酶抑制率测定 |
抑制率测定结果表明:各样品中蜗牛酶解液、酵母菌发酵液、黑曲霉发酵液对酪氨酸酶活性抑制作用基本没有或较弱,而甘草总皂苷抑制率为50.67%,有较好的抑制酪氨酸酶活性的作用,说明不同方法酶解后,甘草总皂苷抑制酪氨酸酶活性的作用受到严重弱化,单从抑制酪氨酸酶活性考虑,不宜采取上述酶解方法进行酶解。
3 讨论试验分别采用蜗牛酶、酵母菌、黑曲霉3种媒介对甘草总皂苷溶液进行体外生物转化,结果发现采用蜗牛酶、黑曲霉可以实现甘草苷的部分转化,但是酵母菌不能使甘草苷转化为甘草酸铵。说明酵母菌作为真菌并不具备转化甘草苷作用。蜗牛酶、黑曲霉作为多糖苷酶来源可以使甘草苷的糖苷键断裂实现转化目的。
结合抑制酪氨酸酶活性试验得出,3种不同处理方法处理后的样品在抑制酪氨酸酶活性上存在一定差异。甘草总皂苷溶液抑制酪氨酸酶活性要强于3种转化溶液,而且酵母菌处理后的溶液活性也优于其他两个样品。
结合本试验结果,后期研究需要进行两方面试验:首先,测定甘草苷纯品与甘草总皂苷之间对于酪氨酸酶活性抑制的差异;其次,研究不同浓度的甘草总皂苷溶液对于酪氨酸酶活性抑制的差异,充分研究其作用机理,为后期甘草类化妆品开发奠定理论基础。
| [1] |
刘洋洋, 刘春生, 范冰舵, 等. 甘草种质资源研究进展[J]. 中草药, 2013, 44(24): 3593-3598. |
| [2] |
张明发, 沈雅琴. 甘草及其活性成分抗炎与抗炎机制的研究进展[J]. 现代药物与临床, 2011, 26(4): 261-268. |
| [3] |
于鲁志. 中药甘草抗炎作用药理和临床研究进展[J]. 医药卫生, 文摘版: 00163-00164. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gmzy201719066&dbname=CJFD&dbcode=CJFQ
|
| [4] |
周彪, 万传星. 甘草地上部分化学成分研究[J]. 中草药, 2016, 47(1): 21-25. |
| [5] |
刘俊峰, 郭雪峰. 甘草皂苷对卡拉库尔羊血液中免疫球蛋白IgA和IgG的影响[J]. 江苏农业科学, 2014, 42(1): 172-174. |
| [6] |
王建华, 雷帆, 崔景荣. 20种中药对酪氨酸酶抑制作用的研究[J]. 中国药学杂志, 2000, 35(4): 232-234. |
| [7] |
陈清西, 宋康康. 酪氨酸酶的研究进展[J]. 厦门大学学报(自然版), 2006, 45(5): 731-737. |
| [8] |
沈钧, 何莉萍, 张瑞斌. 甘草提取物对酪氨酸酶活性的抑制作用[J]. 中国临床药理学与治疗学, 2006, 11(8): 940-942. |
 2018, Vol. 32
2018, Vol. 32 