大规模药品专利到期对仿制药开发和全球制药行业格局影响深远。数据[1]显示,在过去的2010至2015年间,有市值750亿美元的药品专利到期;到2016至2019年,将有超过990亿美元的品牌药面临专利到期。近年来,中国制剂出口发展迅速,本土制药企业在面临原料药产能过剩、出口竞争激烈、利润偏低的问题时,纷纷向制剂开发和出口转型升级。制剂出口至亚非拉地区等非规范市场,当地的药品立法或指南均要求制剂生产商提供我国国家药品监督管理局出具的药品出口销售证明(Certificate of Pharmaceutical Product,CPP);新兴市场的某些国家如南非、马来西亚等,已将药品出口销售证明作为药品注册申报资料的一部分。但是,我国现有的药政法规却无法支持出具药品出口销售证明,致使面向非规范市场的制剂出口面临瓶颈[2]。
1 药品出口销售证明概述WHO国际贸易药品认证计划(WHO Certification Scheme on the Quality of Pharmaceutical Products Moving in International Commerce)是一项行政手段,要求参与成员国通过本国企业申请(出口国),向另一国政府(进口国)承诺,进口药品在质量、安全、有效方面已经符合公众认可的相关标准的严格评估,并且该药品经出口国政府主管部门审核后在该国政府管辖范围内上市销售,如未上市则应说明缘由;药品生产场地和操作应符合WHOGMP规范[3]。截至2017年,已有149个国家和地区加入该认证计划。药品出口销售证明是WHO国际贸易药品质量认证范围内最主要的证明文件之一,兼具证明药品质量、安全有效和生产场地符合GMP的效力[4]。
在WHO推荐的格式中,药品出口销售证明应涵盖证书编号、进出口国家、药品名称和剂型(包括单位剂量的药用活性成分和辅料信息)、是否在出口国批准上市、是否已经在进口国上市销售、药品许可编号及批准日期、药品许可持有人信息、申请人信息、出口国监管部门是否安排检查该药品的生产场地及定期检查的频率、该药品是否已经被检查、该生产场地的设施和操作是否符合WHO— GMP、申请人提供的相关信息是否符合出口国监管部门的要求等内容[5]。
2 相关国家和地区药品出口销售证明发放制度简介本文运用文献检索法,选取美国、加拿大、澳大利亚、英国和印度作为研究对象,以“certificate of pharmaceutical product”和“exporting certificate”等为关键词,调研了以上5个药监部门在官方网站公布的药品出口销售证明的法规和指南。美国药监局、加拿大卫生部、澳大利亚医疗用品管理局、英国药品和健康产品管理局、印度中央药物控制组织对药品出口销售证明的发放制度,从药品出口销售证明的认证范围、申请资料、申请流程3个方面进行了分析。
2.1 美国药品出口销售证明发放制度 2.1.1 美国药品出口销售证明的认证范围美国药品出口销售证明的认证范围主要为已获得批准的药品、非处方药、未获得批准产品、顺势治疗药品和药用活性成分5类产品[6]。美国药监局通常向生产商发放以下3种药品出口销售证明文件,以支持不同产品因上市批准和产地差异形成的出口需求:①药品在美国合法上市销售(证明文件附着红色丝带);②药品未在美国批准销售,但可在国外合法销售(证明文件附着蓝色丝带);③药品由境外生产商生产(证明文件附着黄色丝带)。除附着丝带颜色不同外,后2种药品出口销售证明文件上还会标注“外国生产商”或“未批准”等信息,以对3类药品出口销售证明文件加以区分[7]。
2.1.2 申请美国药品出口销售证明的资料清单申请美国药品出口销售证明需要提交以下信息:授权付款联系人、认证声明、申请人名称和联系方式、目标进口国、联邦纳税人标识号、产品在美国的上市销售状态、生产场地信息、场地注册号、需要证书的数量、产品的商品名。针对5类不同的认证产品,还需要提交一些额外信息,如对已获批的药品还需要提供产品上市许可持有人信息、药品批准信、药品标签和说明书等。
2.1.3 美国药品出口销售证明申请流程申请药品出口销售证明前,美国药监局会建议申请人先与进口国商定药品出口销售证明应载明的信息。申请人可通过认证产品类型,使用药品审评和研究中心的出口认证和追踪系统(CDER Export Certification and Tracking System,CDEReCATs)、或生物制品评审与研究中心的生物制剂出口证明申请及追踪系统(Biologics Export Certification Application and Tracking System,BECATs)电子化申请药品出口销售证明或填写FDA 3613f表格,与其他申请资料一起邮寄至药品审评和研究中心进行申请。根据《美国食品、药品和化妆品法案》第801(e)(4)(B)条,美国药监局可在收到药品出口销售证明申请的20天内进行认证收费,首次申请费用为175美元、第二次相同国家申请的费用为90美元、第三次及三次以上的收费标准为40美元。美国药监局将在接收申请表后的20天内发放药品出口销售证明。但以下3种情况不予发放:(1)美国药监局要求补充额外信息或申请表信息缺失;(2)生产场地在美国药监局系统内检查状态不合规;(3)不符合法规的药品,如贴错标签的药品等。美国药品出口销售证明的有效期为2年[7]。
2.2 加拿大药品出口销售证明发放制度 2.2.1 加拿大药品出口销售证明的认证范围2015年4月,加拿大卫生局发布《药品证明书申请指南》 [8],明确阐述了药品出口销售证明发放的条件和申请流程。
加拿大药品出口销售证明的认证范围包括人用药品和符合GMP规范的兽用药品。加拿大健康产品与食品检查部(简称“检查部”)将药品出口销售证明发放给以下申请人:①药品识别码(Drug Identification Number,DIN)的持有人或已发放上市通告(Notice of Compliance,NOC)的放射性药品;②加拿大境内并符合GMP规范的药品生产商;③药品识别码持有人书面授权的第三方申请人。检查部根据生产、包装和贴标签的厂地不同(境内或境外),对符合药品出口销售证明的认证范围进行说明,见表 1。
|
|
表 1 加拿大药品出口销售证明的认证范围和发放条件 |
申请加拿大药品出口销售证明的资料清单见表 2。
|
|
表 2 加拿大药品出口销售证明的认证范围和发放条件 |
若申请某个特定的药品出口销售证明,由于药品不同规格的生产批准信息有差异,申请表需要填写每个不同的药品识别码,且一次申请只能填写一个出口国。
2.2.3 加拿大药品出口销售证明申请流程申请人将申请药品出口销售证明所需的申请表、GMP证书申请表、药品出口销售证明费用表等申请资料寄送至检查部,检查部在10个工作日内负责审评申报资料并就申报资料的缺陷和未完成缴费的信息与申请人沟通。每个药品出口销售证明认证费用为82美元(不含税费)。药品出口销售证明的有效期为1年,但值得注意的是,若申报药品出口销售证明时提交的GMP证书的有效期是少于1年的,则GMP证书失效日当天其药品出口销售证明也同样失效。
检查部对以下情况拒绝发放药品出口销售证明:①境外负责药品生产和/或包装、贴标签的厂地不符合GMP规范且未列入药品机构许可(Drug Establishment Licence,DEL);②境外厂地负责药品生产和/或包装、贴标签,药品进口至加拿大仅为了向药品持有人提供包装、贴标签或检验服务;③申请信息不完整;④天然健康产品的国际贸易证明由天然健康药品部予以发放;⑤未缴纳申请费用;⑥产品符合食品药物法(Food and Drug Act)第37章节出口所规定的要求;⑦产品的寄销国与加拿大已建立相互认可协议。
2.3 英国药品出口销售证明发放制度 2.3.1 英国药品出口销售证明的认证范围英国药品和健康产品管理局对人用药品通常向生产商发放以下5种出口证明文件[9]:(1)药品证明书(药品已上市批准);(2)药品证明书(药品未上市批准),此类药品必须在英国生产,且申请人须持有生产许可证;(3)生产场地状态证书,该证书确认某个许可证的生产场地符合GMP规范;(4)生产许可证状态证书,该证书最多包含10个产品;(5)药用组分进口证书,进口的药用活性成分或辅料必须是某个已上市产品内所含的成分,或收载于国家药典或国际药典,且药用组分的生产场地必须持有英国药品和健康产品管理局颁布的有效检查证明。其中第1和第2种为药品出口销售证明。
2.3.2 申请英国药品出口销售证明的资料清单针对已批准上市的产品,需提交申请表和上市许可持有人准许产品出口的信函;针对未批准上市的药品,需提交申请表和一封药品处方且证明产品在该场地生产的文件。申请表中涵盖了申请人信息、药品信息、药品上市持有人信息、场地检查信息等[9]。
2.3.3 英国药品出口销售证明的申请流程针对已批准上市和未批准上市的药品,申请人可填写不同的申请表邮寄或通过英国药品和健康产品管理局门户网站提交。若申请人在10个工作日内获得药品出口销售证明,则认证费用为68欧元;若申请人在2个工作日内获得药品出口销售证明,则认证费用为152欧元[9]。
2.4 澳大利亚药品出口销售证明发放制度澳大利亚药品出口销售证明的认证范围为处方药、非处方药和补充剂(如维生素、矿物质补充剂和草药制剂)[10-11]。澳大利亚医疗用品管理局主要发放3种医药产品的出口证明:(1)WHO推荐格式的药品出口销售证明(CPP),包括已在澳大利亚上市供应的产品和已获授权出口的药品,药品出口销售证明上会加注标准化的声明以区分两类产品;(2)上市药品出口销售证明(Certificate of Listed Products, CLP),CLP是CPP的改良证明,CLP证明仅认证在澳大利亚上市的产品;(3)豁免产品出口证明,豁免产品指的是未列入澳医疗用品登记表但仍受医疗用品立法监管的产品。该证明虽不经WHO国际贸易药品认证计划发放,但豁免产品在GMP许可场地生产,则该出口证明可以WHO推荐的药品出口销售证明格式出具。澳大利亚医疗用品管理局要求申请人通过电子商业服务入口(eBusiness Services)提交申请。
2.5 印度药品出口销售证明发放制度 2.5.1 印度药品出口销售证明的认证范围根据第40届药物委员会决议,自2009年10月1日起,印度中央药物控制组织对出口药品可发放药品出口销售证明和GMP证书[12]。截至2017年5月12日,印度中央药物控制组织已授予印度各州市1314家生产商药品出口销售证明。印度药品出口销售证明的认证范围为有出口需求的人用药品、原料药和兽用药品,且没有强制要求认证出口销售证明的药品必须在印度上市销售。
2.5.2 申请印度药品出口销售证明的资料清单和流程申请人可向印度中央药物控制组织或地方药监局申请药品出口销售证明,需要提交申请表、附信、产品汇总表、符合WHO-GMP要求的场地主文件。申请表中应明确是产品首次认证还是再次认证(二者的审核程度不同)。产品信息汇总表包含产品名称、过去2年生产的批次批量(研发/中试/商业化生产)、工艺验证、分析方法验证、清洁验证、年度产品质量回顾等。印度中央药物控制组织在接收申请资料后进行审阅,并将缺陷信反馈给申请人,若无缺陷问题则进行场地检查。若申请人符合GMP规范,则发放药品出口销售证明;若申请人不符合GMP规范,现场检查缺陷将反馈至申请人,不予发放药品出口销售证明,如果申请人想再次申请药品出口销售证明,则需在上次拒绝发放药品出口销售证明的5个月以后。2014年8月,印度药品管理局发布了药品出口销售证明和GMP证书发放现场检查的统一流程指令,明确依据检查场地的大小、产品工艺复杂性和产品数量来确定场地检查时间,一般为2~5天[13]。目前,印度药品管理局发放药品出口销售证明不收取任何费用。
3 我国药品出口销售证明发放制度 3.1 我国药品出口销售证明的认证范围我国药品出口销售证明的认证范围主要为国家药品监督管理局正式批准生产的中成药、化学原料药及其制剂、生物制品制剂及原液。
3.2 申请药品出口销售证明的资料清单申请药品出口销售证明,申请人需要递交以下资料:药品出口销售证明申请表、《药品生产许可证》正、副本或药品上市许可持有人证明文件、出口药品的批准证明文件或进口国上市许可证明文件、相应剂型的《药品GMP证书》或通过境外监管机构监督检查的证明文件、营业执照、按照批签发管理的生物制品须提交《生物制品批签发合格证》、申请者承诺书。
3.3 药品出口销售证明的申请流程申请人将药品出口销售证明申请表、药品生产许可证、GMP证书等文件递交至各省、自治区、直辖市食品药品监督管理局,具体的办理流程、时限和其他要求各地区略有差异。
我国药品出口销售证明有效期不超过2年,且不超过申请资料中所有证明文件的有效期,这就意味着药品出口销售证明的有效期是与《药品生产许可证》和《药品GMP证书》等证书的有效期相关。目前,国家药品监督管理局发放药品出口销售证明不收取任何费用。
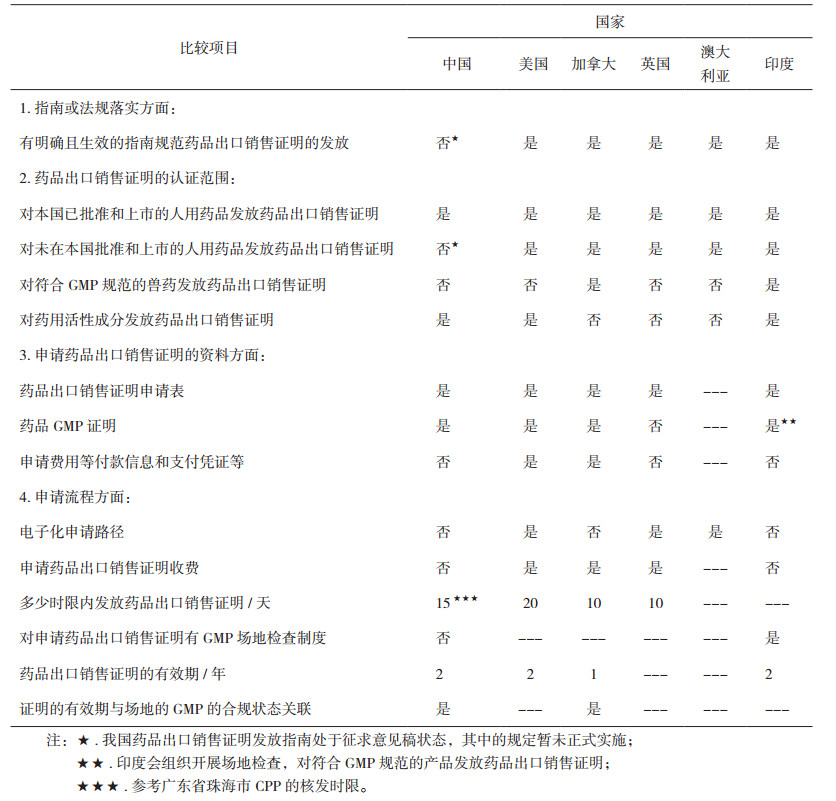
4 我国药品出口销售证明发放制度的不足之处我国与美国、加拿大、澳大利亚、英国、印度药品出口销售证明发放制度的异同点比较,结果见表 3。
|
|
表 3 药品出口销售证明发放制度比较 |
鉴于药品注册要求的差异性间接影响了申请药品出口销售证明资料的差异性,本文主要从指南或法规的落实、药品出口销售证明的认证范围和申请药品出口销售证明的GMP现场核查制度3个方面,说明我国药品出口销售证明发放制度存在的不足之处,并提出相关建议。
4.1 我国尚缺乏正式生效的药品出口销售证明发放指南通过法规指南层面的对比,说明我国目前尚缺乏正式生效的药品出口销售证明发放指南。2016年7月19日,原国家食品药品监督管理总局发布了《药品出口销售证明管理规定》(征求意见稿)[14](以下简称“征求意见稿”),就药品出口销售证明的适用范围、申请资料、证明编号、有效期以及出具的药品出口销售证明的格式进行了说明。目前,该征求意见稿还未正式实施。征求意见稿出台之前,一般由生产企业向其所在地省级食品药品监督管理部门提出药品出口销售证明申请,各省局对药品出口销售证明的资料要求略有差异[15]。目前,对于医疗器械出口,国家药品监督管理局已正式发布《医疗器械产品出口销售证明管理规定》 [16]。
4.2 我国药品出口销售证明的认证范围仅局限于我国已上市的产品征求意见稿出台之前,依据不同的出口需求,将证明性文件分为3类:(1)药品出口的自由销售证明书(Free Sale Certificate,FSC)[15]或药品出口销售证明(CPP)[17];(2)加工出口药品的加工出口批件[18];(3)原料药出口的证明性文件[19]。药品出口销售证明认证范围仅限于国家药品监督管理局正式批准生产的中成药、化学原料药及其制剂、生物制品制剂及原液,导致受限于国内药品审评速度慢而有意转向某些非规范市场进行注册申报的企业面临注册瓶颈,进而一定程度上影响了国内企业制剂国际化的发展之路。征求意见稿第二条:“对于尚未在我国批准上市的药品,药品生产企业按照药品GMP要求生产、且符合进口国法规,也可适用本规定”的提出,有望扩展我国药品销售证明的认证范围。我国药品和原料药出口的证明性文件见表 4。
|
|
表 4 我国药品和原料药出口的证明性文件汇总表 |
通过对比发现,我国药品出口销售证明缺乏对符合GMP规范生产但未在国内上市的产品认证。加拿大卫生部针对在加拿大生产未在加拿大销售,但处于药品审评中的产品也予以发放药品出口销售证明;同样,美国药品出口销售证明对是否在美国上市销售的产品也予以声明。我国征求意见稿第二条、第五条均支持符合GMP规范生产的药品予以发放药品出口销售证明,但由于其尚未正式实施,还不具有法律效力。
4.4 未对申请药品出口销售证明的产品建立GMP场地检查制度针对已获批产品,通常申请资料完整充分即予以发放药品出口销售证明。而对于未在国内上市获批产品,征求意见稿也仅是简单提及根据日常监督检查情况确认其生产过程是否符合药品GMP要求。必要时,可专门开展现场检查,缺乏系统性的GMP场地检查制度。
5 对完善我国药品出口销售证明发放制度的几点建议 5.1 加快落实并生效《药品出口销售证明管理规定》笔者认为,我国应加快落实《药品出口销售证明管理规定》,保留征求意见稿中对药品出口销售证明的认证范围、申请资料、证明有效期等信息,增加申请流程和收费标准等内容,明确开展GMP现场检查的药品品种,如对尚未在我国批准上市的注射剂产品明确要求开展GMP现场检查等。以利于消除药品出口销售证明申请在不同省级管理部门受理的差异化问题,规范药品出口销售证明发放的流程和制度。
5.2 扩大药品出口销售证明的认证范围笔者认为,应依据制剂国际化的趋势和国内企业对药品出口销售证明的需求,落实征求意见稿中对符合GMP规范生产但未在国内上市产品的认证规定,充分借鉴美国或加拿大等管理部门的做法,在药品出口销售证明上加注产品是否在国内上市销售,完善与申请人在出具药品出口证明书格式和内容的沟通机制,协助申请人获得符合进口国药监部门认可的药品出口销售证明。
5.3 建立药品出口销售证明发放的现场检查机制为确保出口药品的质量、安全性和有效性,体现我国药监部门对出口药品监管到位,笔者认为,可以借鉴印度的做法,建立一套药品出口销售证明发放的现场检查机制。可根据产品是否在国内上市销售,确立两套不同的资料审评和现场检查机制。建议对未在国内批准上市药品的证书发放从申请资料阶段就从严审评,资料补充完整后组织现场检查,对符合GMP规范的药品予以发放药品出口销售证明;对已在国内上市销售的药品,其证明发放可实行快速审评,并视产品的工艺复杂性、检查场地的规模、需要出具证明的产品数量以及常规检查和飞行检查的合规程度,决定是否需要开展现场检查。
| [1] |
中国医药保健品进出口商会.中国制剂出口的国际化策略[EB/OL].(2016-12-12)[2017-05-10]. http://www.cccmhpie.org.cn/Pub/1757/152269.shtml.
|
| [2] |
WHO. WHO Certification Scheme on the Quality of Pharmaceutical Products Moving in International Commerce: Questions and Answers (Q & A)[EB/OL]. (2010-05)[2017-05-10]. http://www.who.int/medicines/areas/quality_safety/regulation_legislation/certification/qas_certif_scheme_2012.pdf?ua=1,2010-05.
|
| [3] |
冷鹏, 孙大卫. 部分国家的COPP概述[J]. 中国药事, 2008, 22(6): 522-523. |
| [4] |
WHO. Guidelines on the Implementation of the WHO Certification Scheme on the Quality of Pharmaceutical Products Moving in International Commerce[EB/OL]. (2015-11-24)[2017-05-10].http://www.who.int/medicines/areas/quality_safety/regulation_legislation/certification/guidelines/en/.
|
| [5] |
WHO. Model Certificate of a Pharmaceutical Product[EB/OL].[2017-07-06]. http://www.who.int/medicines/areas/quality_safety/regulation_legislation/certification/en/.
|
| [6] |
Imports Exports Compliance Branch of US Food and Drug Administration. Certificate of a Pharmaceutical Product (CPP) Application[EB/OL].[2017-07-06]. https://www.fda.gov/downloads/drugs/developmentapprovalprocess/smallbusinessassistance/ucm441206.pdf.
|
| [7] |
Imports and Exports Compliance of US Food and Drug Administration. General Certificates of Pharmaceutical Product Information[EB/OL].[2017-07-06]. https://www.fda.gov/drugs/guidancecomplianceregulatoryinformation/importsandexportscompliance/ucm348825.htm.
|
| [8] |
Health Canada. Guidance Document on the Application for a Certificate of a Pharmaceutical Product[EB/OL]. (2015-04-01)[2017-07-06]. http://www.hc-sc.gc.ca/dhp-mps/alt_formats/pdf/compli-conform/licences/directives/gui-0024-eng.pdf.
|
| [9] |
Medicines and Healthcare Products Regulatory Agency. Export Drugs and Medicines: Special Rules[EB/OL].[2016-11-11]. https://www.gov.uk/guidance/export-drugsand-medicines-special-rules.
|
| [10] |
Therapeutic Goods Administration. Policy for the Export of Medicines from Australia[EB/OL].(2014-08-08)[2017-07-06]. https://www.tga.gov.au/sites/default/files/export-medicines-policy.pdf.
|
| [11] |
Therapeutic Goods Administration. Certificate of Listed Product, Certificate of Pharmaceutical Product & Certificate of Exempt Product[EB/OL].(2007-10-19)[2017-07-06]. https://www.tga.gov.au/certificate-listed-productcertificate-pharmaceutical-product-certificate-exemptproduct.
|
| [12] |
New Delhi. DCGI to Issue CoPP & WHO Certificates for Export from October[EB/OL].(2009-09-07)[2017-07-06]. http://www.business-standard.com/article/companies/dcgi-to-issue-copp-who-certificates-for-export-fromoctober-109090700160_1.html.
|
| [13] |
Ramesh Shankar. DCGI Issues Uniform Procedures in Regulatory Inspection for Issuance of CoPP, GMP Certificates[EB/OL].(2014-08-11)[2017-07-06]. http://pharmabiz.com/NewsDetails.aspx?aid=83449&sid=1.
|
| [14] |
国家食品药品监督管理总局, 总局办公厅公开征求药品出口销售证明管理规定(征求意见稿)意见[EB/OL].[2016-07-19]. http://www.sda.gov.cn/WS01/CL0778/159724.html.
|
| [15] |
国家药品监督管理局.关于印发《出具"药品销售证明书"若干管理规定》的通知[EB/OL].(2001-04-26)[2017-07-06]. http://www.sda.gov.cn/WS01/CL0058/9327.html.
|
| [16] |
裘敏杰, 范月萍, 董耿, 等. 医疗器械产品出口销售证明用途及管理建议[J]. 现代商贸工业, 2016, 37(10): 43-44. |
| [17] |
珠海市食品药品监督管理局.药品证明书(CPP)核发[EB/OL].(2014-08-26)[2017-07-06].http://www.gdda.gov.cn/sofpro/cms/previewjspfile/fdazh/cms_0000000000000000434_tpl.jsp?requestCode=284612&CategoryID=1834.
|
| [18] |
国家食品药品监督管理局.关于印发药品加工出口管理规定(试行)的通知[EB/OL].(2003-07-29)[2017-07-06]. http://www.sda.gov.cn/WS01/CL0058/9342.html.
|
| [19] |
国家食品药品监督管理总局.关于出口欧盟原料药证明文件有关事项的通知[EB/OL].(2013-05-07)[2017-07-06]. http://www.sda.gov.cn/WS01/CL0844/80444.html.
|
 2018, Vol. 32
2018, Vol. 32