近年来,中成药和中药饮片的使用比例不断增长,据《2013-2017年中国中药行业深度调研与投资战略规划分析报告》数据统计[1],我国有超过80%以上的城市居民自行购买过中成药或中药饮片。巨大的市场需求为国内中药行业提供了充分的发展空间。中药产品具有专业化程度高、产量大和使用面积广的特点,其质量的稳定性和安全性直接关系到公众的身体健康和生命安全。2015年3月,原国家食品药品监督管理总局发布了《关于进一步加强中药饮片生产经营监管的通知》 [2],要求各省、自治区、直辖市食品药品监督管理部门对所管辖的中药饮片生产企业加强监管,严厉查处违法违规行为。飞行检查作为重要的监管手段,指药品监督管理部门对药品生产、经营等环节开展的、不预先告知、具有一定保密性,对被检查单位执行法律法规的真实情况进行突击检查或者暗访调查的现场监督检查形式[3]。其分散抽样、集中检验的监管模式,更有利于促进医药市场的健康发展。
1 2015-2016年中药生产质量飞行检查的基本概况本研究对2015年3月至2017年3月原国家食品药品监督管理总局联合各省、自治区、直辖市,对中药及其饮片企业开展的飞行检查反馈情况做了初步统计。结果发现,2016年较2015年飞行检查总数有所减少,对中药类及中药饮片类企业的检查数也大幅下降;即使如此,中药及中药饮片类企业占飞行检查总数的比例仍然超过50%,说明飞行检查的重点依然是中药类企业,具体情况见表 1。对2015-2016年GMP证书收回情况的统计发现,2016年GMP证书收回总数有所下降,但其数量与中药类企业的检查数量之比却有所增加,说明中药类企业的生产质量管理问题仍然比较严峻。具体情况见图 1。

|
图 1 2015年与2016年收回GMP证书情况 |
|
|
表 1 2015-2016年飞行检查情况统计 |
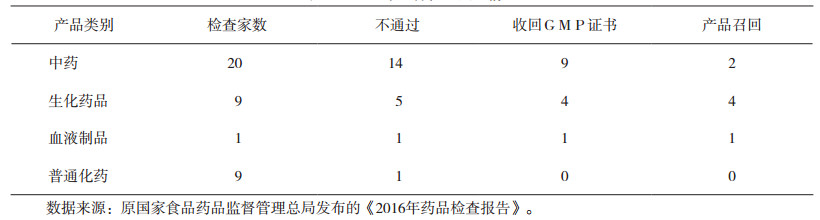
通过对原国家食品药品监督管理总局发布的《2016年药品检查报告》中飞行检查的统计描述,发现中药类企业占飞行检查总数的一半以上,其中不通过率达到60%~70%,且GMP证书的收回率也很高,具体情况见表 2。
|
|
表 2 2016年飞行检查处理情况 |
通过对原国家食品药品监督管理总局发布的2015年和2016年药品飞行检查报告的分析总结,发现两年间均出现了中药生产企业擅自改变生产工艺的现象。为降低成本,中成药口服制剂生产企业擅自改变前处理、提取工艺的问题比较突出。2016年探索性检验发现问题后开展飞行检查的,均是企业将处方中部分应提取的中药材不按工艺规程提取,而是粉碎后直接投料。与2015年相比,尚未发现将醇提工艺变更为水提的问题。虽然擅自改变工艺的做法目前并未发现导致安全性问题,但相关品种的有效性却无法得到保证。因此,对该类问题必须加大检查力度,实行严厉打击[4]。
2.1.2 中药材、中药饮片物料管理比较混乱在2016年的飞行检查中发现,个别中成药生产企业为了应对监督检查,编造仓库物料台账和出入库记录,甚至根据中成药的生产量倒推出中药材的使用量,并据此编造物料台账。类似情况在各年的飞行检查中均有发现,药监部门应给予高度重视[4]。
2.1.3 对购入的中药材、中药饮片不能严格全检,且数据可靠性存在问题传统中成药企业生产的品种多,涉及的中药材、中药饮片品种也多,企业配置的精密分析仪器和QC人员与生产规模不相适应,不能保证购入的中药材和中药饮片按照《中国药典》标准进行全检,甚至个别企业采用一图多用的做法应对检查[4]。
2.2 中药饮片生产存在的主要问题中药饮片企业一直是药监部门飞行检查的重点。2016年飞行检查发现的生产质量问题包括(1)为了应付监督检查编造物料台账和批生产记录、批检验记录。(2)涉嫌外购饮片进行分装、销售。一些企业违反规定,直接由周边中药材市场或药贩子手中购入中药饮片,在企业进行分装、贴牌,然后销售;这个问题2015年也曾经发生过[5]。
2.3 特殊品种存在的主要问题2016年,由于人工牛黄生产企业信访举报案例较多,药监部门特设检查组对相关的几家人工牛黄生产企业进行了检查。发现部分企业不能按照GMP要求组织生产,尤其缺乏对人工牛黄上游产业链供应商的审计和管理,供应商的加工场所卫生环境恶劣,原材料来源无法溯源,加工过程不可控,微生物限度检查结果的真实性存疑等[5]。
3 改进建议 3.1 推进中药材生产标准化、产业化、规模化中药饮片及中成药都是由中药材加工、炮制后的制成品,中药材质量决定着相关产品的质量优劣。国家倡导GAP基地规范化种植道地药材[6],各省应根据本辖区道地药材品种、中药材基地品种和中药饮片生产企业的实际情况来选择重点品种,实行就近加工。规范中药材种植基地建设,统一种植标准,使中药材种植专业化、标准化、规模化,有利于解决生产品种繁多但批量小而带来的全检工作量大、检验方法复杂不一的难题;同时,有利于中药生产企业的长远发展[7]。
3.2 加强生产企业管理制度建设中药类生产企业要转变重生产轻管理的思想,转变管理理念和模式,制定适合本企业长远发展的管理制度和战略规划[8]。包括定期对员工开展知识技能培训,讲授药学专业知识、相关法律规范和生产安全注意事项;各级领导应加强自身的责任意识,督促员工诚信生产经营,禁绝生产记录造假等一系列违规问题;加大资金投入,引进先进的仪器设备与技术,实现药品生产和检验现代化[9-11]。
3.3 企业必须坚守道德底线,承担社会责任企业必须讲求信誉,加强诚信体系建设,严格按照国家规定的工艺标准进行生产,针对不同的中药材,根据其药理毒性采取正确的加工处理工艺,不使用劣质、低级原辅材料,不生产假冒伪劣产品,最大限度地保证中药材及中药饮片的质量和疗效[12]。药品生产企业要切实承担起“药品安全质量第一责任人”的职责,始终将公众利益放在首位[13]。另外,监管部门应建立“黑名单”制度,在媒体和网站上对失信企业进行披露和曝光,使失信的药品生产经营企业受到市场性惩戒和社会性惩戒(社会谴责等),使相关主体一处失信、寸步难行[14]。
3.4 加大监管力度国家药品监督管理局应转变监管理念,丰富监管手段,变革监管方式,确保监管到位[15]。坚持问题导向和风险防控,加大对重点企业、薄弱环节、问题线索的飞行检查,深挖风险隐患,重点打击带有“潜规则”性质的问题,提高监督检查的靶向性。着力建设一支高素质的监管队伍,正确理解监管与服务的关系,杜绝各种形式的地方保护;主动适应药品监管的外部环境,进一步提高对药品安全突发事件的处置能力[16]。同时,充分发挥市场机制、社会监督和行业自律的作用,优化监管环境,完善监管体系。通过互联网技术加强对药品加工全产业链的溯源,从原材料到产成品都便于监管人员的监督检查[17]。
| [1] |
2013-2017年中国中药行业深度调研与投资战略规划分析报告[R/OL].[2017-06-10]. http://bg.qianzhan.com/report/detail/276293bf0a4042a8.html.
|
| [2] |
刘宁, 景浩. 中药饮片生产质量管理现状及对策分析[J]. 中国农村卫生事业管理, 2016, 36(11): 1404-1406. |
| [3] |
孙爽, 张军涛, 焦玉秀. 浅谈食药监局GMP飞行检查[J]. 现代制造, 2016(17): 15-17. |
| [4] |
国家食品药品监督管理总局. 2016年药品检查报告[EB/OL].[2017-05-10]. http://www.sda.gov.cn.
|
| [5] |
屈聪玲, 蒋传中. 坚守道德诚信是中药产业确保药品质量的关键[J]. 中国药事, 2015(4): 432-436. |
| [6] |
宋光胜. 浅析中药饮片生产企业存在的问题及监管对策[J]. 中国食品药品监管, 2016(2): 60-62. |
| [7] |
吕云飞, 侯庆山. 浅析中药饮片生产企业质量体系有效运行的举措[J]. 现代制造, 2016(29): 6-8. |
| [8] |
肖永庆, 张村, 李丽. 浅谈中药饮片规范化生产和过程控制[J]. 医学研究杂志, 2010, 39(9): 11-14. DOI:10.3969/j.issn.1673-548X.2010.09.005 |
| [9] |
张志敏.强化科学监管确保中药质量[C]//中国药学会药事管理专业委员会年会暨"国家药物政策与药品管理法修订研究"论坛论文[D]. 2009.
|
| [10] |
陈丽.我国药品监管研究[D].沈阳: 沈阳药科大学, 2007.
|
| [11] |
赵为敏.我国药品市场准入法律制度研究[D].重庆: 西南政法大学, 2008.
|
| [12] |
张瑗惠.基层食品药品监督管理局网站建设现状与对策建议研究[D].济南: 山东大学, 2013.
|
| [13] |
韩慧丽.新形势下我国中药饮片产业的发展战略研究[D].开封: 河南大学, 2011.
|
| [14] |
蒋传中, 张留宏. 中药饮片面临的质量困境及应对措施[J]. 中国药事, 2015(9): 900-903. |
| [15] |
周勇.我国药品监管机制的创新研究[D].南昌: 南昌大学, 2009.
|
| [16] |
国家食品药品监督管理总局. 国家药品标准(修订)颁布件批件号:ZGB2014-15[J]. 中国药品标准, 2015, 16(5): 394-396. |
| [17] |
崔婕.论我国药品监督体制改革[D].南京: 东南大学, 2010.
|
 2018, Vol. 32
2018, Vol. 32