随着药品监管体制的改革深入,药品生产企业的监管需求与药监部门监管能力之间不相适应的矛盾日益突出。当前,我国药品生产企业监管的法律法规和相关技术标准还不够完善,对药品生产企业的监管资源分配和利用还缺少详尽的指导性意见,没有开展深入的分析和科学的论证,极大地影响了监管部门的监管效能。
为了突破我国药品生产企业监管工作的困境,解决药品生产监管面临的矛盾,有效调整监管资源和监管需求不相适应的情况,促进药品生产监管向科学化和精细化转变,提高监管针对性,最大限度地发挥现有监管资源的效能,努力提升监管效率,本文将开展药品生产企业分级分类监管模型的研究,为建立适合我国药品生产监管实际的分级监管策略提供方法借鉴。
1 分级监管理论基础欧洲社会学家、经济学家帕累托最早提出分级监管理论,这种方法是根据分析对象的特征,比如技术方面的特征和经济方面的特征,对分析对象进行分类、分级,区分重点分析对象和一般分析对象,以便于对不同分析对象实施区别化、差异化管理的分析方法[1]。由于这种方法通常将分析对象用A、B、C标识类别,因此称为ABC分析法。ABC分类管理理论的基本原理是将管理对象分为若干类,如A类、B类、C类等。概括地说,就是将管理对象区分类别,分类管理,关键区别重要的少数对象和一般的多数对象,体现科学、高效、集约的现代化管理思想。
20世纪50年代,有学者将ABC分析法应用于库存管理领域和质量管理领域[2],主要用于质量问题的分析,逐渐使该理论成为企业提高管理效益的普遍方法。后来,有学者将该方法引入到风险管理领域,在食品安全、职业健康、卫生风险管理等领域有了广泛应用[3-5]。
2 药品生产企业分级监管模型的构建 2.1 企业监管等级的划分分级监管模型要求对药品生产企业开展差异化的监督,不同类别、不同分级的企业在监管频次和监管方法以及监管力度方面都应具备针对性。因此,构建企业分级模型,关键要确定监管等级,包括监管时间和空间覆盖率两个参数。监管时间覆盖率,即每一个监管周期内对企业实施监管行为的次数;监管空间覆盖率,即表示同一监管等级中的企业在一个监管周期内实施监管的百分比。通过对药品生产企业划分出相应的监管等级,实施动态分级监管,避免不同企业釆取相同监管频次,可以有效提高监管针对性,满足监管时间覆盖率和空间覆盖率的要求。
根据国内外行业分类管理的实践经验和当前我国药品生产领域监管资源与监管企业的实际情况[6],本文认为将药品生产企业分为三个监管等级是较为合理的选择,并给出监管参考值,如:三级监管等级,每季度实施一次现场检查,监管覆盖率100%;二级监管等级,每半年实施一次现场检查,监管覆盖率50%;一级监管等级,每年实施一次现场检查,监管覆盖率5%。针对药品生产企业中发生的各种生产质量情况,如委托生产或委托检验情况,人员或生产设施、生产工艺变动情况,发生质量事故或严重不良反应的情况,药品质量抽验不合格等情况将实时进行现场检查。
2.2 企业监管等级的评估影响企业监管等级的因素很多,本文主要通过企业风险水平、企业监管记录和企业监管频率等因素对企业监管等级开展分析研究,重点考察药品生产企业在实际运营和生产管理中存在的风险来确定企业监管等级。
2.2.1 企业风险水平药品生产企业的企业风险水平主要通过企业自身属性方面,包括企业诚信、拥有的药品品种类别等因素;企业经济运行方面,包括利润情况、资本和股份构成变化、企业重要岗位人员变更等因素;企业生产质量管理方面,包括药品生产设备设施、使用的物料、工艺方法、生产环境与作业条件、质量管理水平等因素多方面综合反映。
从企业自身属性来说,注射剂药品的质量风险高于口服剂型药品、外用药品;血液制品、生物制品、疫苗等由于其生物学特性,导致药品生产过程中存在固有的不稳定性和批次之间的重现性不完全等特点,所以这类药品的质量风险是所有药品类别中最高的。因此,可以从药品剂型、品种质量风险的角度,对企业风险进行分类,确定企业风险管理类别,进而明确企业监管类别。例如:将药品类别分为高风险产品,包括注射剂(含生物制品、血液制品)、无菌药品和特殊药品等;一般风险产品,包括口服固、液体制剂,外用无菌制剂(如滴眼剂、栓剂、眼膏剂、创面用药等)、非无菌原料药等;低风险产品,包括外用非无菌制剂(如搽剂、乳膏剂等)、中药饮片、医用气体、药用辅料等。对于企业的生产范围包含多剂型的,以高风险剂型确定管理类别,并纳入企业监管等级考量。
从企业经济运行来说,经济利润向好,人员构成稳定,企业运营正常,能够不断发展壮大,为了进一步的发展,企业偷工减料、掺杂使假的动机减弱,合法经营的动机增强,企业风险降低;反之,企业亏损运营,重要岗位人员流失,为了企业生存,必然会导致企业违法违规风险增大。
从企业生产质量管理来说,管理理念和水平先进的企业,采用先进的设备,稳定的工艺,良好的厂房设施及工作环境,完善的文件制度来指导企业生产管理运行,必然会降低企业的产品生产质量风险。反之,管理意识、厂房设备、工艺方法等落后的企业,产品质量的保障必然会大幅降低,企业风险也随之增大。
一般而言,企业风险水平越高,该企业的监管强度就应当越大,监管资源应适当倾斜。因此,企业风险水平是影响监管级别的重要因素之一。
有文献[7]报道采用层次分析法等理论和方法综合分析企业风险水平,对影响企业风险水平因素的上述指标开展研判,建立企业风险定量模型,即企业风险水平R表示为:
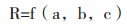
|
a、b、c分别表示企业自身属性、企业经济运行及生产质量管理,R值越大,风险水平越高。
2.2.2 企业监管记录企业监管记录是反映企业遵纪守法意识和自身管理水平的重要依据,是判断药品生产企业对药品生产相关法律、法规和技术规范、标准的遵守与执行情况的重要证明,这也是药品监管部门对药品生产企业实施监督检查情况的信息载体。
从监管部门的角度来看,相对于监管记录良好的药品生产企业,企业监管记录中存在问题多的企业,发生质量事故的风险就增大,而且监管记录体现的违规现象越频繁、越严重,企业发生质量事故的可能性就越高,对社会和公众造成的危害就会越大。因此,本文引入企业监管记录作为影响企业监管级别的重要参数,鉴于企业监管记录的可获得性和规范性,本文采用对企业开展各类GMP检查记录中的缺陷项目进行深入分析。
根据“食品药品监管总局关于印发药品生产现场检查风险评定指导原则的通知” [8]的要求,将监管记录中的GMP缺陷项分为“严重缺陷”“主要缺陷”和“一般缺陷”,其风险等级依次降低,见表 1。
|
|
表 1 监管记录行为分级表 |
因此,可以用GMP缺陷项发生频次、GMP缺陷项严重性两方面指标,来评价最近一次监督检查周期内的企业监管记录,并以此来研判企业监管情况。GMP缺陷项发生频次可以通过计算一个监管周期内出现同样类别缺陷项的次数q来反映;GMP缺陷项严重性可以参考“监管记录行为分级表”中对缺陷项的定义来反映。比如,可用表 1的方式将企业监管情况划分为3个等级,级别越高,企业风险越高,3种等级的缺陷项分别按照一般缺陷项10分、主要缺陷项50分、严重缺陷项100分进行赋值,其严重性评分用加权平均值来表示,则企业监管情况S为:
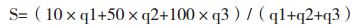
|
根据企业分级分类的理论,不同的药品生产企业具有不同的生产质量管理风险,因此也具有不同的监管需求,要求不同的监管强度和频次。这里就体现了企业监管频率的重要性。本文用H表征企业监管频率,H值越大,表明企业越长时间未接受监管,相应其监管需求也越强。企业监管频率H的计算与不同企业的监管等级有关,依据“2.1”节企业监管等级的划分情况,H可以表示为:

|
H为企业监管频率,m为监管等级,n为监管覆盖率。利用上述公式可以计算出每个企业监管等级的标准监管频率U(或称为计划监管间隔),根据企业实际监管频率与标准监管频率U之间的比较,可以科学、合理地协调企业监管频率的规律性和随机性,达到监管效能的最大化。
2.3 企业分级监管模型的确定综上所述,根据对企业监管等级具体参数的分析,企业监管等级D可以表示为:

|
R为企业风险水平,S为企业监管记录,H为企业监管频率的函数。
由于上述参数的不确定性较大,本文采用德尔菲法来进行权重分析,邀请10名相关领域的专家对三项参数的权重进行判断,具体权重值WR、WS、WH分别为0.45、0.35、0.2,企业分级监管模型X即:

|
经向专家征求意见,结合X值和“2.1”节中企业监管等级划分的要求,确定企业监管等级,具体分级标准见表 2。
|
|
表 2 企业监管级别分级及监管标准 |
由企业分级监管模型可以看到,影响企业分级监管的因素主要是企业风险水平、企业监管记录、企业监管频率三方面。
从企业风险水平来看,对企业的分级是动态的、不断发展的。为了适应企业的不断变化,对企业的分级监管实行有规则的动态调整,对于质量风险控制工作良好的企业进行鼓励,调低风险监管等级,对于严重违反相关规定的企业进行惩罚性降级,从而达到促使企业提高风险控制能力的目的。
从企业监管记录、企业监管频率来看,监管部门除了强调监管要突出重点、企业要分级分类之外,还要讲求理论与实际结合,掌握企业底数、监管需求,以现实的监管能力为依据,强调监管的预见性和计划性,通过不断的优化调整,做到监管需求和监管资源相互匹配、相互协调,达到最优配置,从而提高监管的执行力和效率。
动态调整的基本原则是实现分级监管参数所决定的监管需求与实际的监管资源相互匹配。分级监管的主要参数包括监管空间和时间覆盖率,当企业的监管级别确定后,通过调整上述参数使得监管资源和监管需求实现最佳衔接。根据动态调整的结果,制定监督检查周期监管计划,达到实施药品生产企业分级监管的最优策略。
4 结语本文针对我国药品生产监管面临的实际困难,引入企业分级分类管理理论,构建了药品生产企业分级监管模型,明确了以企业风险水平、企业监管记录、企业监管频率为依据划分企业监管等级,并初步建立了药品生产企业分级监管模型的动态调整机制。为指导我国实施药品生产企业分级监管,实现监管资源的最优配置,突出监管重点,提高监管的靶向性、计划性和科学性,提供了一定的参考和借鉴。
| [1] |
张忠彬, 孙庆云. 我国职业危害分类与分级监管法规标准与研究现状[J]. 中国安全生产科学技术, 2007, 3(6): 104-108. |
| [2] |
孟昭芳. ABC管理法及其在石油企业的应用[M]. 北京: 科学技术出版社, 1992.
|
| [3] |
周建新, 任智刚, 刘铁民. 基于风险优先的分级监察研究[J]. 中国安全生产科学技术, 2006, 2(3): 23-27. |
| [4] |
王鸿雁, 张淑红, 张冬夏. 河北省超市食品卫生监督量化分级管理模式[J]. 职业与健康, 2008, 24(18): 1907-1908. DOI:10.3969/j.issn.1004-1257.2008.18.028 |
| [5] |
庄惠民, 单皓林, 唐杰. 职业卫生监督量化分级评价体系的建立与模式探讨[J]. 环境与职业医学, 2005, 22(6): 535-537. |
| [6] |
陈国华, 张华文. 我国安全生产事故调查分级培训机制研究[J]. 中国安全生产科学技术, 2009, 5(1): 59-64. |
| [7] |
郭妍婷, 武志昂. 基于层次分析法的临床研究协调员胜任特征模型研究[J]. 中国新药杂志, 2016, 25(20): 2287-2293. |
| [8] |
国家食品药品监督管理总局.食药监药化监[2014] 53号关于印发药品生产现场检查风险评定指导原则的通知[EB/OL]. (2014-05-13). http://www.sda.gov.cn/WS01/CL0844/102300.html.
|
 2018, Vol. 32
2018, Vol. 32 

