日常检测透析用水和透析液细菌内毒素检测多参照《中国药典》细菌内毒素检查法(凝胶法)[1],该方法作为仲裁法,可判断细菌内毒素是否超出标准要求限值,操作相对简便,但是不能对透析用水和透析液中细菌内毒素进行定量检查,不能提前预知制备过程潜在的风险,不利于透析用水和透析液的日常监控和质量控制。细菌内毒素检查法(动态浊度法)是检测反应混合物的浊度达到某一预先设定的吸光度或透光率所需要的反应时间的方法[1],可准确得知细菌内毒素的含量[2-3],可让医生更清楚地了解细菌内毒素值的变化趋势,及时提早发现并解决问题,降低患者在血液透析治疗过程中的风险[4]。
本研究采用韶关市9家医院透析用水和透析液进行动态浊度检查法的建立,定量检查和了解韶关地区医院透析用水和透析液细菌内毒素含量水平,为医院细菌内毒素定量检查提供方法参考,为医院建立干预方案提供数据支撑,为医院对透析用水和透析液的日常监管工作提供理论依据。
1 试剂与材料 1.1 仪器与试剂BET-32B型细菌内毒素测定仪(天津大学无线电厂);细菌内毒素工作标准品(湛江安度斯生物有限公司,批号:1609090);动态浊度法鲎试剂(湛江安度斯生物有限公司,批号:1504230);细菌内毒素用水(湛江安度斯生物有限公司,批号:1610310);ZH-2 BLENDER振荡仪(天津药典标准仪器厂);BIOHIT移液枪(100~1000 μL)。
1.2 透析用水透析用水和透析液使用无热原西林瓶采集,于韶关市9家医院(分别编号为A、B、C、D、E、F、G、H、I)血液透析科(室)在线采集,透析用水采集位置为水处理系统的末梢,透析液采集位置为透析器入口,全程无菌操作,避免环境中细菌对结果干扰。
2 方法与结果本文依据《中国药典》2015年版第四部通则1143细菌内毒素检查法[1](方法2:光度测定法)进行标准曲线的可靠性试验和干扰试验,按照建立方法对透析用水和透析液进行定量检查。
2.1 标准曲线的可靠性试验透析用水和透析液细菌内毒素最高限制值为0.5 EU·mL-1[5-7],故将细菌内毒素标准曲线浓度梯度依次设置为1、0.5、0.25、0.125、0.0625、0.03125、0.001563 EU·mL-1,用细菌内毒素用水将细菌内毒素标准品稀释至上述7个浓度,每个浓度取0.1 mL加至3支除热原试管中,同时取细菌内毒素用水0.1 mL加至2支除热原试管中作为阴性对照。从阴性对照开始,终止于最高浓度的细菌内毒素试管,依次加入0.1 mL细菌内毒素用水溶解好的动态浊度法鲎试剂,充分混合放入预热到(37.0±0.1)℃的BET-32B型细菌内毒素测定仪中,反应时间为3600 s。反应结束后以各浓度的平均反应时间对数值(LgT)为纵坐标,相应细菌内毒素浓度对数值(LgC)为横坐标,绘制标准曲线(见表 1)。由表 1可得标准曲线方程:LgT=2.80493-0.27415 LgC(r=-0.9983)(r绝对值>0.980),平行管之间的变异系数均小于10%,阴性对照的反应时间大于标准曲线最低浓度的反应时间,表明标准曲线符合规定。
|
|
表 1 标准曲线的可靠性试验 |
选取标准曲线的中点细菌内毒素浓度0.125EU·mL-1,设其为λm,作为供试品干扰试验中添加的细菌内毒素浓度。分别制备供试品溶液、细菌内毒素标准品浓度为0.125 EU·mL-1的供试品溶液(PPC)、阴性对照溶液(NC),利用上述标准曲线分别计算出供试品溶液和含标准细菌内毒素的供试品溶液的细菌内毒素含量Ct和Cs,按照
《YY0572-2015血液透析和相关治疗用水》中透析用水细菌内毒素限值为0.25 EU·mL-1, 标准曲线的λ=0.015625 EU,故其最大稀释倍数为0.25/0.015625=16倍。透析用水采用16倍稀释时,在标准曲线的范围内,只能判断透析用水细菌内毒素值小于0.25 EU·mL-1,等同于凝胶法检查细菌内毒素,对于日常监测没有任何意义,故本文对透析用水16倍稀释液对细菌内毒素的干扰不进行考察。
将透析用水用细菌内毒素用水稀释成1倍(原液)、2倍、4倍和8倍稀释液,取2.8 EU·mL-1的细菌内毒素标准品溶液0.1 mL加至2 mL1倍稀释(细菌内毒素终浓度约为0.125 EU·mL-1),取0.25 EU·mL-1的细菌内毒素标准品溶液0.3mL分别加至0.3 mL 2倍、4倍、8倍透析用水稀释液,制成终浓度为0.125 EU·mL-1的供试品溶液(PPC)。将0.1 mL供试品溶液(1倍、2倍、4倍、8倍稀释液),0.1 mL PPC溶液(含细菌内毒素浓度为0.125 EU·mL-1的1倍、2倍、4倍、8倍稀释液),0.1 mL阴性对照,0.1 mL阳性对照(浓度为0.125EU·mL-1细菌内毒素标准溶液)分别与0.1 mL细菌内毒素用水溶解好的动态浊度法鲎试剂在除热原试管中充分混合,混合从阴性对照开始,终止于最高浓度的细菌内毒素试管,混合后立即将试管放入BET-32B型细菌内毒素测定仪进行检测。满足阴性对照反应时间>3600 s,阳性对照反应时间与标准曲线λm的反应时间差异小于10%时,利用上述标准曲线计算细菌内毒素回收率,结果见表 2。
|
|
表 2 透析用水干扰试验回收率结果 |
为考察稀释倍数对回收率的影响,将回收率和稀释倍数在SPSS Statistics.21中进行单因素方差分析,结果见图 1和表 3。由图 1可知随着稀释倍数的增大,回收率逐渐减小,趋近于100%。由表 2和表 3可知,在稀释倍数为1、2、4、8的情况下,回收率均在50%~200%之间,且95%置信区间均在50%~200%内,符合药典规定。同时稀释倍数对回收率影响的P值为0.521,大于0.05,说明不同稀释倍数的透析用水对细菌内毒素干扰作用不显著。考虑到试验操作的简化性,避免增加稀释过程中造成污染的风险,透析用水可使用原液检测细菌内毒素含量。
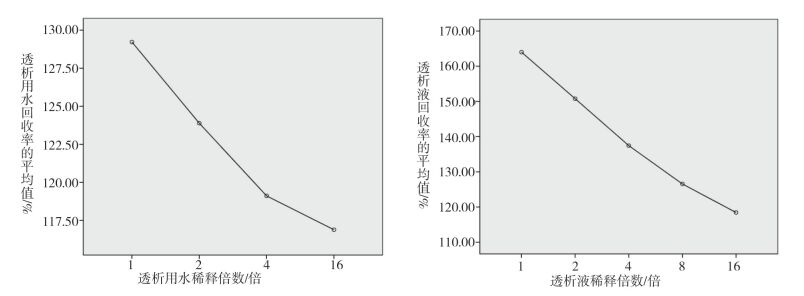
|
图 1 不同稀释倍数透析用水(左图)和透析液(右图)细菌内毒素回收率均值趋势图 |
|
|
表 3 不同稀释倍数透析用水对细菌内毒素回收率显著性分析 |
《卫生部血液净化标准操作规程(2010年版)》要求透析液细菌内毒素检测至少每3个月1次,限值为2 EU·mL-1,而《YZB/国0504-2007血液透析及相关治疗用浓缩物》对透析液细菌内毒素限值为0.5 EU·mL-1,从严要求,按照限值0.5EU·mL-1建立方法。标准曲线的λ=0.015625 EU,故其最大稀释倍数为0.5/0.015625=32倍。与透析用水相同,当采用透析液32倍稀释时,在标准曲线的范围内,只能判断透析液细菌内毒素值小于0.5EU·mL-1,等同于凝胶法检查细菌内毒素,对于日常监测没有任何意义,故本文对透析液32倍稀释液对细菌内毒素的干扰不进行考察。
将透析液用细菌内毒素用水稀释成1倍(原液)、2倍、4倍、8倍和16倍稀释液,取2.8 EU·mL-1的细菌内毒素标准品溶液0.1 mL加至2 mL1倍稀释(细菌内毒素终浓度约为0.125EU·mL -1),取0.25EU·mL -1的细菌内毒素标准品溶液0.3 mL分别加至0.3 mL 2倍、4倍、8倍和16倍稀释液,制成细菌内毒素终浓度为0.125EU·mL-1的供试品溶液(PPC)。将0.1 mL供试品溶液(1倍、2倍、4倍、8倍、16倍稀释液),0.1mL PPC溶液(含细菌内毒素浓度为0.125 EU·mL-1的1倍、2倍、4倍、8倍、16倍稀释液),0.1 mL阴性对照,0.1 mL阳性对照(浓度为0.125 EU·mL-1细菌内毒素标准溶液)分别与0.1 mL用细菌内毒素用水溶解好的动态浊度法鲎试剂在除热原试管中充分混合,混合从阴性对照开始,终止于最高浓度的细菌内毒素试管,混合后立即将试管放入BET-32B型细菌内毒素测定仪进行检测。满足阴性对照反应时间>3600 s,阳性对照反应时间与标准曲线λm的反应时间差异小于10%时,利用上述标准曲线计算细菌内毒素回收率,结果见表 4。
|
|
表 4 透析液干扰试验回收率结果 |
为考察稀释倍数对回收率的影响,将回收率和稀释倍数在SPSS Statistics.21中进行单因素方差分析,结果见图 1,表 5和表 6。由图 1可知随着稀释倍数的增大,回收率逐渐降低,趋近于100%,说明透析液对细菌内毒素有增强作用。由表 5可知,在稀释倍数为1、2、4、8、16的情况下,回收率均在50%~200%之间,且均值的95%置信区间均在50%~200%内,但是稀释倍数对回收率影响的P值为0.000,小于0.01,说明稀释倍数对细菌内毒素回收率影响极其显著。对不同稀释倍数的回收率进行两两对比(LSD法分析)可知1倍稀释、2被稀释、4倍稀释与16倍稀释有显著性差异(P<0.05),而8倍稀释与16倍稀释无显著性差异(P=0.210)。
|
|
表 5 不同稀释倍数透析液对细菌内毒素回收率显著性分析 |
|
|
表 6 不同稀释倍数透析液细菌内毒素回收率LSD法多重比较 |
血液透析治疗肾衰竭患者过程中使用大量的透析用水和透析液,目前大多数医院采用反渗技术制取透析用水,可以除去水中的大分子,虽然可通过消毒杀菌和超滤技术将水中的微生物和热原进行分离,但微生物和细菌内毒素仍是透析用水主要不合格项目[8],细菌内毒素是革兰氏阴性细菌死亡溶解或用人工方法破坏菌细胞后释放的一种物质,主要毒性成分为类脂质A,液体中的细菌产生细菌内毒素极易引起人体的热原反应,所以微生物含量和细菌内毒素含量是相关的[2],为保障患者的血液透析安全,加强对透析用水和透析液细菌内毒素的质量控制,对透析用水和透析液进行内毒素检查尤为重要。《卫生部血液净化标准操作规程(2010年版)》要求对透析用水和透析液细菌内毒素检测至少每3个月1次,限值为2 EU·mL-1,《YZB/国0504-2007血液透析及相关治疗用浓缩物》对透析液细菌内毒素限值为0.5 EU·mL-1。2017年1月1日实施的《YY0572-2015血液透析和相关治疗用水》中,0.25 EU·mL-1被列为透析用水细菌内毒素的限值,相比《YY0572-2005血液透析和相关治疗用水》 [9]对透析用水的要求为2 EU·mL-1,新标准极大提高了对透析用水细菌内毒素的要求。
本文透析用水采集位置均为水处理系统的末梢,以验证水处理系统是否存在问题。透析液采集位置为透析器入口,以验证透析用水在与浓缩液混合过程中是否存在问题。结果表明透析用水和透析液都是随着稀释倍数的增大,对细菌内毒素的干扰作用减弱。通过方差分析发现透析用水的稀释倍数对回收率没有显著影响,而且透析用水对细菌内毒素有一定的增强作用,使用原液检查不会出现假阴性的结果,故建议使用原液进行检测。透析液的稀释倍数对回收率有显著的影响,使用16倍稀释干扰作用最小。但是通过LSD两两比对,8倍稀释和16倍稀释并没有显著差异,为避免超出标准曲线范围,当细菌内毒素含量大于0.25 EU·mL-1应使用16倍稀释,当细菌内毒素含量小于0.25 EU·mL-1时建议使用8倍稀释。韶关地区透析液水平较好,采用8倍稀释得出的数据更准确,且8倍稀释试验操作过程相对简便,检测结果更加准确,建议使用8倍稀释液进行检查。透析用水虽与稀释倍数呈负相关,但是经过层层过滤、除菌,接近于纯水,所以对细菌内毒素干扰作用不明显。透析液是透析用水和浓缩物的混合物,增加了钠、钾、钙、镁四种阳离子及氯、碳酸氢根两种阴离子[5],对细菌内毒素的干扰作用增强,当稀释到8倍时干扰作用不明显。
分析透析液不同稀释倍数对细菌内毒素回收率的影响使用的是LSD法,即最小显著性差异法。LSD法具有检验敏感性高的特点,只要存在微小差异就可能被检验出来,使用LSD法进行分析有利于观察不同水平之间的差异。
在日常的检测过程中,原则上标准曲线每次试验都应制备,但是,当供试品数量较多时会增加大量工作,浪费大量的鲎试剂,故建议当鲎试剂批号、标准品批号、细菌内毒素用水批号、透析用水和透析液生产设备等试验条件没有改变时,可在多次试验中穿插建立多条标准曲线,使用软件中的合并标准曲线功能,将多条标准曲线进行合并,以此降低标准曲线带入的试验误差,保障试验的准确性。针对不合格或边缘结果的供试品,应当重新制作新的标准曲线并立即进行供试品检查。
《YY0572-2015血液透析和相关治疗用水》明确提出透析用水的细菌内毒素值应建立干预水平,通常为最大允许水平的50%,韶关地区医院的透析用水和透析液质量全部符合标准规定,透析用水全部能够达到《YY0572-2015血液透析和相关治疗用水》的要求。E和G医院透析用水细菌内毒素值为0.0202和0.0352 EU·mL-1,E和G两家医院细菌内毒素值相对偏高,可能的原因是E和G为县级医院,在仪器设备维护和管理水平方面相对较弱,应加强人员的培训。建议韶关地区的细菌内毒素干预水平设置为0.1 EU·mL-1,以保证透析用水和透析液的质量。
总之,利用细菌内毒素动态浊度法对透析用水和透析液进行检测具有操作简便、灵敏度高、数据准确等优点,克服了凝胶法无法得到具体数值、不能预警干预水平等缺点,充分保证了血液透析患者的安全。
| [1] |
中国药典: 四部[S]. 2015: 154-157.
|
| [2] |
郭萌, 李冠民, 黄清泉. 细菌内毒素研究进展[J]. 中国实验动物学报, 2009, 17(5): 397-400. |
| [3] |
陈华龙, 王莉蓓, 姜丽君. 参麦注射液细菌内毒素检测方法的研究[J]. 海峡药学, 2010, 22(10): 54-55. DOI:10.3969/j.issn.1006-3765.2010.10.028 |
| [4] |
韦群. 通过细菌内毒素检测控制透析用水及透析液质量的探讨[J]. 中国血液净化, 2012, 11(2): 104-106. |
| [5] |
陈香美. 卫生部血液净化标准操作规程[M]. 北京: 人民军医出版社, 2010: 1-135.
|
| [6] |
YZB/国0504-2007血液透析及相关治疗用浓缩物(医疗器械注册产品标准)[S]. 2007.
|
| [7] |
国家食品药品监督管理总局. YY0572-2015中华人民共和国医药行业标准: 血液透析和相关治疗用水[S]. 2015.
|
| [8] |
左壮, 宋桂敏, 史际华, 等. 血液透析单位透析用水及透析液内毒素含量检测[J]. 中国消毒学杂志, 2012, 29(7): 576-577. |
| [9] |
国家食品药品监督管理局. YY0572-2005中华人民共和国医药行业标准: 血液透析和相关治疗用水[S]. 2005.
|
 2018, Vol. 32
2018, Vol. 32 