2. 山东医疗器械产品质量检验中心, 济南 250101;
3. 浙江省医疗器械检验院, 杭州 310018;
4. 辽宁省医疗器械检验检测院, 沈阳 110179
2. Shandong Quality Inspection Center for Medical Devices, Jinan 250101, China;
3. Zhejiang Institute of Medical Device Testing, Hangzhou 310018, China;
4. Liaoning Medical Device Test Institute, Shenyang 110179, China
随着科技和社会进步,公众对医疗器械产品安全有效的关注度日益增强,对医疗器械科学监管提出更高要求[1-2]。医疗器械分类作为科学监管的重要技术支撑,越来越受到重视[3]。进一步完善医疗器械分类工作机制,提高分类的科学合理性,是推进医疗器械审评审批改革的重要任务[4]。成立医疗器械分类技术委员会是国家食品药品监督管理总局(以下简称“总局”)在“十三五”期间推进医疗器械分类管理改革[5],完善医疗器械分类工作机制的重要举措之一。本文从医疗器械分类技术委员会的架构设置、委员遴选原则和运行机制几个方面进行介绍和分析,对完善医疗器械分类工作机制提出建议,为推进医疗器械分类管理改革工作提供参考。
1 架构设置2015年底,总局开始组织筹建医疗器械分类技术委员会,明确定位该委员会既要研究和跟踪国内外医疗器械发展趋势等宏观问题,也要开展医疗器械分类目录修订、分类调整和具体产品分类的研究论证等相关技术性工作。经过广泛调研和审慎讨论并结合实际工作,分类技术委员会按照执行委员会(以下简称“执委会”)和专业组“两级架构”设置,一方面体现了“行政主导、技术权威”的指导思想;另一方面,因纵向的层级少,沟通协调便利,有利于及时高效准确地将战略层信息传递到业务层面。执委会于2015年11月成立,第一届执委会有36名委员[6]。
2015年7月,总局制定医疗器械分类管理改革工作方案,明确医疗器械分类专家委员会的重要职责之一是审核改革调整后的医疗器械分类目录,动态补充和调整医疗器械分类目录。因此,医疗器械分类技术委员会从最初筹建设置的构想就与医疗器械分类目录建立了密切联系。为保证分类技术委员会与分类整体工作的协调,更好地发挥专家作用,确定分类技术委员会专业组设置与整体性修订医疗器械分类目录工作同步推进,专业组的技术领域与新版的子目录设置基本对应,专业相近或密切相关的子目录分类技术工作可合并由同一专业组来承担,专业组数量可少于子目录的数量。设置原则既体现了专业性,也能够有效控制组织结构的横向规模,有利于专业组的横向沟通和工作标准的协调统一。在执委会第一次会议上,对专业组的设置方案进行研究讨论,审议通过了设置16个专业组的方案,综合考虑专业领域和产品数量,各专业组对应1~3个子目录,详见表 1。
|
|
表 1 专业组与子目录的对应关系 |
在遴选专业组委员时,广泛征集、慎重选择、严格工作程序。通过省(市、自治区)局推荐、标准和审评专家库筛选、联系行业内专家定向推荐等多种方式,在广泛征集的基础上,经总局医疗器械注册管理司组织讨论、审查,征求本人意见等工作程序。除满足政治素质、理论素养、学术影响力、职称要求和年龄要求(特殊情况经讨论放宽)外,还兼顾地区分布,适当考虑行业情况和工作便利性。另外,还确定了以下几项遴选原则:
1)根据风险评价依据的要素,确定人员构成比例。《医疗器械监督管理条例》 [7]规定,国家对医疗器械按照风险程度实行分类管理。评价医疗器械风险程度,应当考虑医疗器械的预期目的、结构特征、使用方法等因素,根据医疗器械生产、经营、使用情况,对产品风险变化的分析、评价动态调整产品类别。为准确把握产品风险,需要临床、科研工程、监管各领域技术专家为分类工作提供技术支撑,提升分类工作的科学性、合理性,促进监管工作提高质量和效率。遴选专家时,根据风险评价依据的要素,确定主要从临床、科研工程、监管领域遴选专业组委员,各占约1/3为宜,综合考虑各子目录的产品特点,专业组内人员比例可适当调整。
2)考虑各子目录的技术领域,尽量提高专业领域的覆盖性。医疗器械产品结构复杂,一类产品甚至一个产品可能会同时涉及光学、电学、机械等不同的技术领域,某些器械可能会有特殊要求。例如:植入物类的产品会对生物相容性等有特殊要求,有源设备会对电磁兼容等有特殊要求。遴选专业组委员时,根据某个专业组的特点,尽量提高专业领域的覆盖性。
3)做好衔接,保证分类工作连续稳定。做好医疗器械分类研究,对调整分类目录提出技术意见,是分类技术委员会的重要工作职责。考虑到医疗器械分类目录整体性修订后,目录框架发生了较大变化,修订工作的子目录牵头人熟悉子目录内的产品情况,同等条件下,优先选择子目录牵头人作为专业组委员。同理,为保证医疗器械日常分类工作的连续稳定,长期参与医疗器械分类工作,也是优先选择的条件之一。
4)保证企业间公平性,选择公益类单位专家。“公平”是行政相对人最重要的权利之一[8]。医疗器械分类工作,同样要考虑到相对人资料的保密要求、资源配置的公平性等重要因素。医疗器械分类是分类技术委员会的最主要职能之一,分类工作中经常会涉及某些具体产品信息,为保证企业间的公平性,遴选委员时未纳入企业人员。
2.2 人员结构2014年新修订的《医疗器械监督管理条例》总体思路和核心内容之一就是完善分类管理,按照风险程度进行类别判定。前文介绍遴选委员基本原则之一是根据风险评价依据的要素,确定主要从临床、科研工程、监管领域遴选专业组委员,各占约1/3为宜,综合考虑各子目录的产品特点,专业组内人员比例可适当调整。
本文统计分析了2017年4月公布的第一届专业组委员中人员结构情况。按照委员所在单位性质统计见图 1。考虑到现在医疗器械检验部门是药监系统直属单位,如果按照单位性质划分,检验人员应计算到监管系统内。若考虑专业特点,检验领域专家更了解产品的结构特点及工程上的风险,因此该领域专家应属于科研工程类;类似的,医院医学工程人员,按照专业领域也属于科研工程类专家。综合以上两种情况,按照专业领域的分布情况见图 2。通过人员结构和专业领域统计分析,从委员数量和比例来看,对应医疗器械生产、经营和使用方面的风险都有相关领域专家进行分析评价,能够保证医疗器械分类的科学性、合理性和公正性。
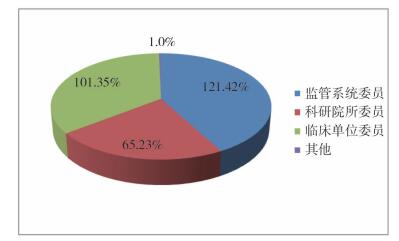
|
图 1 专业组委员按照所在单位性质的分布图 |

|
图 2 专业组委员按照专业领域的分布图 |
医疗器械分类技术委员会由执委会和16个专业组组成。执委会在技术方面就医疗器械分类目录框架内容、分类规则调整等重要事项提出意见,或者协调专业组开展重大事项的研究工作;执委会实行主任委员负责制,执委会主任委员负责每年至少召开一次会议,应当保证2/3以上执委会委员出席。专业组具体承担专业领域内相关医疗器械分类的日常性和专项性工作。专业组实行组长负责制,有关会议或活动由组长负责召集,视工作情况按照规定的程序审查分类技术资料,可根据工作事项不同,确定召开专业组全体委员会议或者部分委员会议;涉及产品类别调整等重大事项的,原则上应当召开专业组全体委员会议,全体委员会议应当2/3以上委员出席。执委会、专业组会议在形成技术意见和建议时,应当经过充分讨论,原则上协商一致;需要表决确定的,应当由出席会议的2/3及以上委员同意方可通过。执委会会议和专业组会议,根据需要可以邀请有关专家、行业组织或企业代表列席会议,列席代表可以发表意见,但不参与表决[9]。
3.2 管理模式分类技术委员会在管理上推行科学管理理念,以制度化管理模式为基础,注重协作互动,综合性、整体性地考虑管理模式的适应性。
制度化的管理,保证工作规范。在遴选专业组委员时,综合考虑医疗器械风险评价依据要素、子目录专业性等因素确定委员的遴选原则,建立合理的组织机构,从源头上保证公正性、合理性、专业性。面向社会公布了分类技术委员会的工作规则,明确委员条件、工作职责和工作程序等规定,逐步建立保密规定、会审程序等各项工作制度,保证工作规范。
协作互动式管理,提高工作效率。在机构和人员设置时规定,执委会的常务副主任委员、副主任委员由相关技术领域的专家、国家食品药品监督管理总局相关管理部门的人员组成;每个专业组中都有总局医疗器械标准管理中心的专业人员作为专业组委员参与工作,在直接参与专业组讨论的同时,也能把总局分类管理的要求及时带到专业组。通过合理配置资源和协调管理,管理人员和专业人员建立良好的协作互动,避免烦琐程序,提高工作效率。
3.3 改进设想高性能医疗器械作为《中国制造2025》 [10]和《国家发展改革委工业和信息化部关于实施制造业升级改造重大工程包的通知》 [11]中重点突破领域之一,得到了蓬勃发展,技术复杂的医疗器械产品不断涌现,更新换代加快,对专家的遴选、专家组的运行、工作中技术资料的科学定密、保密等管理制度的设计和工作运行机制带来新挑战。工作实践中,应不断探索,进一步完善技术委员会的运行机制和管理模式,为科学监管提供新的支撑。
4 结束语医疗器械监督管理本质上是风险管理,医疗器械分类是实施医疗器械风险管理的条件和基础。面对我国高性能医疗器械蓬勃发展、医疗器械产业快速增长的实际情况,需要依靠“懂临床”“懂技术”“懂监管”的专家共同分析把握,进行科学定类,在保障医疗器械安全有效的同时,又要兼顾促进医疗器械新技术的推广和应用。因此,通过建立稳定的专家管理模式,完善医疗器械分类工作机制,进一步提高医疗器械分类的科学性,协助监管部门做好决策,把好分类源头,为促进医疗器械产品健康发展提供重要的技术支撑。
| [1] |
母瑞红, 王越, 郭世富, 等. 浅析医疗器械分类界定工作中应注意的几个问题[J]. 中国医疗器械杂志, 2013, 37(6): 451-453. |
| [2] |
王越, 杨晓芳. 我国医疗器械分类界定工作现状与思考[J]. 医疗装备, 2014, 27(8): 4-6. |
| [3] |
郭世富, 黄颖, 母瑞红, 等. 我国医疗器械分类监管改革的现状及思考[J]. 中国医疗器械杂志, 2016, 40(5): 355-358. |
| [4] |
国务院. 国发[2015] 44号国务院关于改革药品医疗器械审评审批制度的意见[S]. 2015.
|
| [5] |
国务院. 国发[2017] 12号"十三五"国家药品安全规划[S]. 2017.
|
| [6] |
国家食品药品监督管理总局. 食品药品监管总局医疗器械分类技术委员会在京成立[EB/OL]. [2017-12-03]. http://www.sda.gov.cn/WS01/CL0050/136804.html.
|
| [7] |
国务院. 国务院令第650号医疗器械监督管理条例[S]. 2014.
|
| [8] |
中华人民共和国主席令第7号中华人民共和国行政许可法[S]. 2003.
|
| [9] |
国家食品药品监督管理总局. 食药监办械管[2017] 56号医疗器械分类技术委员会工作规则[S]. 2017.
|
| [10] |
国务院. 国发[2015] 28号中国制造2025[S]. 2015.
|
| [11] |
国家发展改革委, 工业和信息化部. 发改产业[2016] 1055号国家发展改革委工业和信息化部关于实施制造业升级改造重大工程包的通知[S]. 2016.
|
 2017, Vol. 31
2017, Vol. 31 
