水痘带状疱疹病毒(varicella-zoster virus,VZV)为双链DNA病毒,是水痘和带状疱疹的病原体。初次感染表现为水痘,主要发生在婴幼儿和学龄前儿童,常表现为自限性,症状较轻,但处理不当,会并发继发性皮肤感染、肺炎、脑炎等严重疾病,甚至死亡[1-3]。成人感染水痘少见,但严重并发症发生率较儿童高[4]。接种水痘疫苗是预防和控制水痘发生的最有效手段。Oka水痘病毒株(V-Oka)是世界卫生组织(WHO)认可的唯一可用于水痘疫苗生产的减毒株,也是我国水痘减毒活疫苗的生产用毒株[5-6]。V-Oka是日本学者Takahashi等将从1名3岁的典型水痘患者水痘疱疹液中分离得到的Oka疫苗株的亲本(p-Oka)在人胚肺成纤维细胞、豚鼠胚胎成纤维细胞、人成纤维细胞株中多次传代后获得的[7]。
水痘减毒活疫苗已被证明有良好的安全性和免疫性,但其保护率不是100%,接种疫苗后,仍有大约5%的儿童和大约10%的成年人再次感染VZV,其中,由疫苗株引起的水痘约占40%[8]。因此,在广泛接种水痘疫苗的同时,有必要检测接种者再次患水痘是由水痘疫苗株还是野毒株引起的,进而确保疫苗的安全性。疫苗株ORF62区是高变区,这些突变是疫苗株所特有的。为此,本文对国内4家企业生产的水痘减毒活疫苗和临床水痘病例的疱疹液进行了ORF62区的序列测定和基因差异比较,并在基因差异分析结果的基础上,进行了PCR-RFLP分析,目的是建立野毒株和疫苗株的区分方法。
1 材料和方法 1.1 疱疹液用1 mL无菌注射器采集临床诊断为水痘患者的疱疹液:水泡小采集困难,则每位患者选择两个不同部位进行采集;水泡大采集容易,则只采集一个部位。每份样品包括3~5个水泡的疱疹液,将采集到的疱疹液保存在3 mL水痘保存液中,液氮运送至实验室,-20℃保存。共有64份疱疹液样本,分别采自49名患者。
1.2 疫苗上海所(SH)、长春祈健(QJ)、长春长生(CS)、长春百克(BK)4家国产企业生产的水痘减毒活疫苗各1批,批号分别为201510031-2、201510036-1、201511073-2和201602007。
1.3 试剂DNeasy® Blood & Tissue kit购自QIAGEN公司,Q5热启动超保真2×Master Mix,SmaⅠ、BssHⅡ、NaeⅠ购自BioLabs公司,DL500、DL1000 DNA分子量标准购自Takara公司。
1.4 引物设计及合成水痘减毒活疫苗和疱疹液ORF62区基因全长扩增用9对引物均是通过NCBI网站的primerBLAST软件自行设计,PCR-RFLP扩增用引物来自发表文献[9-10],具体见表 1。引物均委托英潍捷基公司合成。
|
|
表 1 用于VZV基因分型的引物 |
用DNeasy® Blood & Tissue kit(QIAGEN)分别提取水痘减毒活疫苗和疱疹液中的病毒DNA。提取的DNA经NanoDrop2000确定浓度后置-20℃保存备用。
1.6 ORF62区基因全长扩增及序列分析扩增模板为提取的水痘减毒活疫苗和疱疹液的基因组DNA,50μL反应体系:2μL模板DNA,上下游引物(20μmoL·L-1)各1μL,25μL 2×Master Mix,21μL去离子水。反应条件:95℃ 5 min;95℃ 1 min,55℃ 30 s,72℃ 1 min,共30个循环;72℃延伸10 min。取3μL PCR产物经1.5%琼脂糖凝胶电泳鉴定,电泳条件为电压100 V,电流80 mA,时间30 min。委托天一辉远(北京)生物科技有限公司进行DNA序列测定。
用primer5.0软件将测序结果进行拼接,用clustalX2软件将拼接后序列与V-Oka(AB097932)、P-Oka(AB097933)和野毒株dumas(NC001348)进行比对分析。
1.7 PCR-RFLP扩增反应体系及反应条件同“1.6”节。扩增产物分别用SmaⅠ进行单酶切和BssHⅡ、NaeⅠ双酶切。SmaⅠ酶切体系为1μL内切酶,15μL PCR产物,2μL 10×NEBuffer,2μL去离子水。酶切条件为25℃ 3 h。BssHⅡ、NaeⅠ双酶切体系为1μL NaeⅠ内切酶,7μL PCR产物,2μL 10×NEBuffer,10μL去离子水。先37℃孵育3 h,然后,加入1μL BssHⅡ内切酶,50℃继续孵育3 h。BssHⅡ、NaeⅠ双酶切产物经2.0%琼脂糖凝胶电泳鉴定,SmaⅠ酶切产物经4.0%琼脂糖凝胶电泳鉴定。
2 结果 2.1 ORF62区测序结果分析拼接后的水痘减毒活疫苗和疱疹液的测序结果可完全覆盖ORF62区。序列比对结果显示,4家(SH、QJ、CS、BK)企业生产的水痘减毒活疫苗基因序列与葛兰素史克(GSK)的水痘减毒活疫苗、默沙东(Merck)的水痘减毒活疫苗和V-Oka序列相似,与Dumas序列均存在20个突变位点。3份疱疹液的ORF62区基因序列不完全一致,与Dumas序列各有10个突变位点,与疫苗株序列各有12个突变位点。其中,108836和108456位点的突变是疱疹液特有的,疫苗株在此位点无突变。另外,分别采自3位患者的3份疱疹液均缺乏疫苗株特有的105356、105544、105705、106262、107316、107252、107599、108111等突变位点。
2.2 PCR-RFLP(SmaⅠ)结果本研究对采自49位患者的64份疱疹液标本进行了PCR-RFLP分析。酶切图谱仅列举了采自6位患者的6份疱疹液标本。
64份疱疹液ORF62(SmaⅠ)的PCR产物均为268 bp,经SmaⅠ酶切后,64个疱疹液酶切产物均为153、79和36bp,表示为SmaⅠ-,上海所生产的疫苗酶切产物为112、79、41和36bp,表示为SmaⅠ+。见图 1。

|
图 1 不同来源的水痘毒株ORF62核苷酸序列比较 注: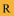 .野毒型和减毒型碱基共存;a.引自文献[11]; .野毒型和减毒型碱基共存;a.引自文献[11]; 野毒型碱基; 野毒型碱基; 减毒型碱基。 减毒型碱基。 |
64份疱疹液ORF62(BssHⅡ和NaeⅠ)的PCR产物为781 bp,经BssHⅡ和NaeⅠ双酶切后,64份疱疹液均不能被酶切,表示为BssHⅡ-和NaeⅠ-。上海所生产的疫苗酶切产物为400、267和114 bp,表示为BssHⅡ+和NaeⅠ+。见图 2。

|
图 2 Sma Ⅰ酶切图谱 (a)酶切前M1:DL1000;1~6:疱疹液;7:上海所疫苗;(b)酶切后M2:DL500;1~6:疱疹液;7:上海所疫苗。 |

|
图 3 BssHⅡ和NaeⅠ双酶切图谱 (a)酶切前M1:DL1000;1~6:疱疹液;7:上海所疫苗;(b)酶切后M1:DL1000;1~6:疱疹液;7:上海所疫苗。 |
水痘疫苗接种后,不能达到100%的保护,因此,水痘疫苗接种的群体中,还会存在一部分人被VZV感染患水痘疾病即突破性水痘病例。突破性水痘病例是水痘疫苗的不良反应之一[12-13],此病例患者接种的水痘疫苗是减毒活疫苗,因此验证突破性水痘病例是由野毒株还是疫苗株引起,在流行病学中具有重要意义,也对正确评价疫苗的有效性和安全性有重要的指导意义。为了验证其是由野毒株还是疫苗株引起,应首先确立区分野毒株和疫苗株的分子生物学标记。水痘疫苗株是通过减毒作用获得的,是未经纯化的混合株,与P-Oka相比,有42个核苷酸发生了突变[14]。分析文献发现,仅有4个SNP位点在所有已研究的水痘疫苗株中以减毒型碱基存在,其余的SNP位点则是以减毒型和野毒型碱基共存[11, 14-16]。SNP位点的碱基存在形式在不同企业,甚至同一企业生产的不同批次疫苗中都会发生变化,这可能和企业生产用的毒种代次、传代用细胞基质等不同有关系[17]。
随着水痘疫苗株、P-Oka、Dumas及临床分离株序列测序工作的完成,人们对野毒株和疫苗株区分方法的研究也随之跟进。前期,欧洲和美洲常用ORF38中PstⅠ(SNP69349)、ORF54中BglⅠ(SNP95241)来进行水痘毒株基因分型及野毒株和疫苗株的区分。PstⅠ酶切位点(PstⅠ+)为大部分野毒株共有,BglⅠ酶切位点(BglⅠ+)为疫苗株特有,但随着PstⅠ-野毒株和BglⅠ+野毒株的出现[18],仅通过这2个酶切位点就不能准确进行疫苗株和野毒株的区分。
随后,ORF6、21、22、62等区的一些疫苗特有的SNP位点也被用来区分疫苗株和野毒株[1, 6, 10, 17-19]。其中,ORF62编码即刻早期蛋白,含疫苗株中1/3以上的突变,与水痘疫苗的减毒相关[11]。目前,ORF62区已成为公认的基因分型和区分野毒株和疫苗株的基因,其中,105356、105544、105705、106262、107316、107252、107599和108111等SNP位点一般被认为是疫苗株特有的突变位点,可用来区分野毒株和疫苗株[14, 17-18]。实际试验中,为了保证野毒株与疫苗株区分的准确性和试验的可操作性,应结合当地疫苗株SNP位点碱基存在形式和野毒株的基因序列进行SNP位点选择,并且应最好选择多个SNP位点。
ORF62区序列测定结果显示,除长春祈健在105356和105544位点以减毒型和野毒型碱基共存,4家国产企业生产的水痘减毒活疫苗基因序列在105310、105451、105512、105705、106262、107316、107252、107599、108111位点均以减毒型碱基存在,不同于3个疱疹液,因此,这些SNP位点可以用来区分野毒株和疫苗株。其中,105705位点T突变为C,106262位点T突变为C,107316位点T突变为C,107252位点T突变为C,108111位点T突变为C,分别导致了SacⅡ、SmaⅠ、BssHⅡ、NaeⅠ、BsrⅠ酶切位点的产生,BsrⅠ是野毒株共有的,SacⅡ、SmaⅠ、BssHⅡ和NaeⅠ是疫苗株特有的。借助这些酶切位点的改变,可用PCR-RFLP法进行野毒株和疫苗株的区分。
PCR-RFLP是目前区分VZV野毒株和疫苗株最为可靠和有效的手段,106262(SmaⅠ)、107136(BssHⅡ)和107252(NaeⅠ)是常用的区分野毒株和疫苗株的酶切位点[17-18, 20]。基于ORF62区测序结果的基础上,本研究对采自49名水痘临床患者的64份疱疹液的含SmaⅠ、BssHⅡ和NaeⅠ酶切位点的DNA片段进行了PCR扩增,并将扩增产物进行了限制性内切酶酶切,疫苗株酶切图谱为SmaⅠ+BssHⅡ+NaeⅠ+,疱疹液酶切图谱为SmaⅠ- BssHⅡ-NaeⅠ-,鉴定其为野毒株引发。说明基于106262(SmaⅠ)、107136(BssHⅡ)、107252(NaeⅠ)的PCR-RFLP可有效区分VZV野毒株和疫苗株。
| [1] |
Quinlivan M, Gershon A A, Steinberg S P, et al. An Evaluation of Single Nucleotide Polymorphisms Used to Differentiate Vaccine and Wild Type Strains of Varicellazoster Virus[J]. J Med Virol, 2005, 75(1): 174-180. DOI:10.1002/(ISSN)1096-9071 |
| [2] |
徐冰, 王树巧, 谢广中. 水痘疫苗及其免疫策略[J]. 中国计划免疫, 2005, 11(3): 238-242. |
| [3] |
许青, 徐爱强. 我国水痘流行病学分析与水痘疫苗免疫预防研究进展[J]. 中国新药杂志, 2012, 21(10): 1093-1098. |
| [4] |
Arvin AM. Varicella-zoster Virus[J]. ClinMicrobiol Rev, 1996, 9(3): 361-381. |
| [5] |
梁慧颖, 邹勇. 冻干水痘减毒活疫苗发展现状及趋势[J]. 中国新药杂志, 2012, 21(10): 1076-1161. |
| [6] |
Sauerbrei A, Zell R, Harder M, et al. Genotyping of Different Varicella Vaccine Strains[J]. J ClinVirol, 2006, 37(2): 109-117. |
| [7] |
Takahashi M, Otsuka T, Okuno Y, et al. Live Vaccine Used to Prevent the Spread of Varicella in Children in Hospital[J]. Lancet, 1974(2): 1288-1290. |
| [8] |
Heininger U, Seward J F. Varicella[J]. Lancet, 2006, 368(9554): 1365-1376. |
| [9] |
Loparev V N, Argaw T, Krause P R, et al. Improved Identification and Differentiation of Varicella-zoster Virus (VZV) Wild-type Strains and an Attenuated Varicella Vaccine Strain Using a VZV Open Reading Frame 62-based PCR[J]. J ClinMicrobiol, 2000, 38(9): 3156-3160. |
| [10] |
Gomi Y, Imagawa T, Takahashi M, et al. Oka Varicella Vaccine is Distinguishable from its Parental Virus in DNA Sequence of Open Reading Frame 62 and its Transactivation Activity[J]. J Med Virol, 2000, 61(4): 497-503. DOI:10.1002/(ISSN)1096-9071 |
| [11] |
Tillieux S L, Halsey W S, Thomas E S, et al. Complete DNA Sequences of Two Oka Strain Varicella-zoster Virus Genomes[J]. J Virol, 2008, 82(22): 11023-11044. DOI:10.1128/JVI.00777-08 |
| [12] |
伊兴旭, 甘霖, 陈敬贤, 等. 水痘-带状疱疹病毒疫苗的评价与研究进展[J]. 微生物与感染, 2014, 9(4): 256-260. |
| [13] |
甘霖, 王明丽, 陈敬贤. 水痘减毒活疫苗的研究进展[J]. 微生物与感染, 2009, 9(1): 40-44. |
| [14] |
Gomi Y, Sunamachi H, Mori Y, et al. Comparison of the Complete DNA Sequences of the Oka Varicella Vaccine and its Parental Virus[J]. J Virol, 2002, 76(22): 11447-11459. DOI:10.1128/JVI.76.22.11447-11459.2002 |
| [15] |
Kanda R K, Quinlivan M L, Gershon A A, et al. Population Diversity in Batches of the Varicella Oka Vaccine[J]. Vaccine, 2011, 29(17): 3293-3298. DOI:10.1016/j.vaccine.2011.02.021 |
| [16] |
Loparev V N, Rubtcova E, Seward J F, et al. DNA Sequence Variability in Isolates Recovered from Patients with Postvaccination Rash or Herpes Zoster Caused by Oka Varicella Vaccine[J]. J Infect Dis, 2007, 195(4): 502-510. DOI:10.1086/522470 |
| [17] |
Quinlivan M L, Jensen N J, Radford K W, et al. Novel Genetic Variation Identified at Fixed Loci in ORF62 of the Oka Varicella Vaccine and in a Case of Vaccine-associated Herpes Zoster[J]. J ClinMicrobiol, 2012, 50(5): 1533-1538. |
| [18] |
Argaw T, Cohen J I, Klutch M, et al. Nucleotide Sequences that Distinguish Oka Vaccine from Parental Oka and other Varicella-zoster Virus Isolates[J]. J Infect Dis, 2000, 181(3): 1153-1157. DOI:10.1086/jid.2000.181.issue-3 |
| [19] |
Takayama M, Takayama N. New Method of Differentiating Wild-type Varicella Virus (VZV) Strains from Oka Varicella Vaccine Strain by VZV ORF 6-based PCR and Restriction Fragment Length Polymorphism Analysis[J]. J ClinVirol, 2004, 29(2): 113-119. |
| [20] |
甘霖, 王明丽, 赵俊, 等. 水痘-带状疱疹病毒临床分离株基因特征分析[J]. 中华流行病学杂志, 2010, 31(2): 189-193. |
 2017, Vol. 31
2017, Vol. 31 
