2. 辽宁康博士制药有限公司, 鞍山 114100
2. Liaoning Kangboshi Pharmaceutical Co. Ltd., Anshan 114100, China
片剂、颗粒剂、散剂、硬胶囊剂等都属于口服固体制剂。由于这类药品储存时质量相对稳定、服用剂量能够准确控制、携带安全方便等诸多优点而被广泛使用,是医药市场最主流的制剂产品[1]。
口服固体制剂在实现规模化生产过程中具有许多其他制剂不具备的优势,其批量生产的产量规模大、制造成本低,可满足不同层次人群需求。由于不同剂型的固体制剂生产工序大部分相同的特点[2],药品生产企业会在建设之初将几个剂型设计在一个共用的综合固体制剂车间内,俗称“一头多尾”,以降低建设成本并提高设备使用效率[3]。
药品固体制剂车间内多品种共线生产,生产秩序必然比单品种复杂,质量风险也随之提高[4]。通过分析固体制剂生产的工艺特点,运用质量风险管理工具和方法对车间可能存在的风险进行分析评估,对风险高的环节提出有效的控制措施,使因多品种共线生产所产生的质量风险降低到可以接受的水平,以保证药品质量[5]。
2 质量风险管理概述质量风险管理,指在药品的整个生命周期中对产品质量进行风险评估、控制、沟通和审核的系统过程[6-7]。启动质量风险管理后,按照风险评估、风险控制、风险评审的顺序周而复始地循环,构成了质量风险管理流程[8],见图 1。
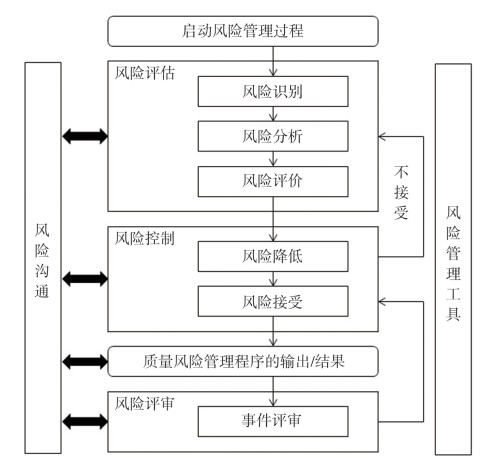
|
图 1 质量风险管理流程 |
药品固体制剂生产的主要操作工序大致相同,具有共同的操作单元,因此多个剂型通常会在同一生产车间内,共用厂房设施和设备、器具[9]。而多剂型共线生产,生产秩序相对复杂、质量风险高[10]。本文以包含片剂、散剂、颗粒剂、胶囊剂等常见剂型的药品固体制剂车间为例,建立质量风险管理模型。
3.1 风险识别及风险分析首先,成立质量风险管理小组,由企业质量负责人或质量负责人指定的人员担任组长,成员应该至少包括企业工程部、设备部、质量保证部、生产部等部门具有丰富经验的工作人员。同时,根据需要可以邀请其他相关部门的专业人员参加。
质量风险管理小组通过对药品固体制剂生产工艺进行分析、现场操作调查、以往经验积累、头脑风暴等方法,对可能由多剂型共用厂房设施引发的混药、交叉污染等影响产品质量的风险因素进行识别、分析[11];采用流程图法,对多剂型共用设备、器具引发的混药、交叉污染等影响产品质量的风险因素进行识别、分析[12]。
3.1.1 多剂型生产共用厂房设施的风险分析 3.1.1.1 共用厂房(1)固体制剂车间洁净区内的每个操作工序,均设有独立的操作间。不同剂型品种生产必然使用不同的物料。如果某一工序生产结束后,清场不彻底,物料遗留在操作间内,就可能发生混淆,有产生交叉污染的风险。
(2)固定制剂车间的外包装工序在非洁净区,同一外包间内会生产不同剂型、不同品种的产品。如果前一品种生产结束后,清场不彻底,包装材料遗留在外包间内,就可能发生混淆,有造成包装错误的风险。
3.1.1.2 共用空调净化系统(1)根据《药品生产质量管理规范》(GMP)规定,固体制剂车间为D级洁净厂房。经过空调净化系统处理后的洁净空气由风管送入各洁净房间,有效地调节洁净房间的温湿度,并保证操作单元的洁净度。如果空调系统某一设备失效或发生故障,导致洁净区房间的温湿度或洁净度不合格,就会造成产品质量不合格的风险[13]。
(2)固体制剂的原料多为粉末状态,生产过程中产生的粉尘正常情况下会被空气净化装置滤除。易于产尘的操作单元如粉碎、过筛、制粒、整粒、总混、压片等工序都安装了捕尘装置,净化区不同功能房间有一定的压差梯度,阻止了粉尘扩散造成的污染。但如果空调系统高效过滤设施功能失效或气流布置失控,产尘量过大将影响空气净化质量,会产生交叉污染的风险。
3.1.2 多剂型生产共用设备、器具的风险分析 3.1.2.1 共用设备固体制剂生产工序大部分相同,具体生产工艺流程见图 2。
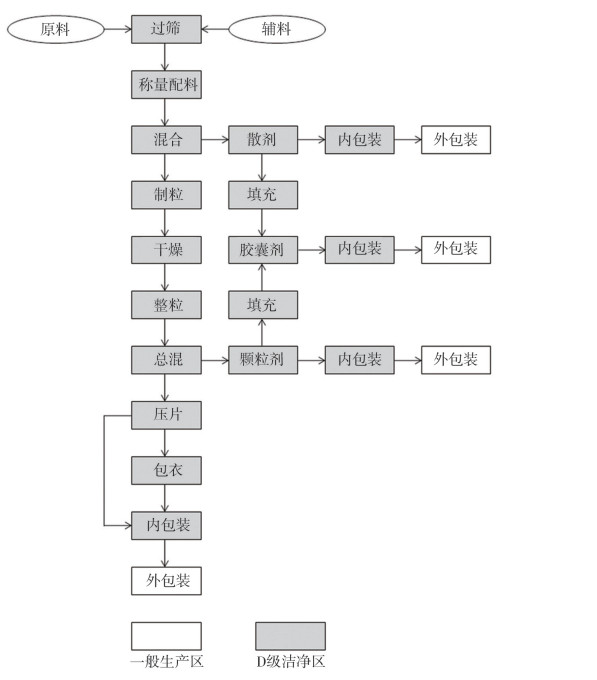
|
图 2 固体制剂生产工艺流程图 |
固体制剂各剂型的生产工序中,过筛、称量配料、混合、制粒、干燥、整粒、总混等环节的设备在生产过程中共用。如果这些设备在某剂型产品生产后未按规定清洗或清洗不彻底,导致上批物料残留,会对下一个生产品种的物料造成污染风险。
3.1.2.2 共用器具不同剂型品种生产过程中,物料称量、转运、投料工序通常使用相同的器具进行操作,例如秤、转运桶、投料漏斗等。如果这些器具在某剂型产品生产结束后,未按规定清洗或清洗不彻底,导致上批物料残留,会对下一个生产品种造成污染风险。
3.2 风险评价及风险控制(1)风险管理小组根据风险因素造成危害的严重程度(S)、发生风险的可能性(P)和风险发生的可预测性(D),对风险产生的S、P、D赋值[14],见表 1。
|
|
表 1 风险评估赋值标准 |
(2)根据人用药注册技术要求国际协调会《质量风险管理指南》(ICH Q9),评定风险的严重程度,采用FMEA(失效模式及影响分析)矩阵法计算出风险的顺序指数(RPN),即RPN= S×P×D。风险管理小组采用头脑风暴法进行充分讨论,并结合企业车间生产实际,对风险承受等级进行具体划分,见表 2。
|
|
表 2 风险等级划分 |
(3)固体制剂车间的FMEA分析,见表 3。
|
|
表 3 固体制剂车间FMEA分析 |
在实际应用中,企业结合自己固体制剂车间的实际情况,对所列风险因素进行主观评价,通过对S、P、D赋值,计算出RPN值。如果属于RPN≥8的中、高度风险,则必须采取有效的控制措施来降低P、D值。采取风险控制措施后,需对风险进行再评估,以确认RPN≤7,使风险降至可接受的水平[15]。
4 质量风险管理在某固体制剂车间的应用实例 4.1 某企业药品固体制剂车间基本情况某企业固体制剂车间包含片剂、颗粒剂和胶囊剂3个剂型的生产线,设有合乎GMP要求的人流、物流、卫生通道和相应的缓冲区。车间内各操作间及设备、器具均标明产品名称、批号、数量、现时状态的标志。设备、器具按规定进行清洗,清洗操作严格执行设备清洁标准操作规程(SOP)。建立了健全的防止物料混淆、交叉污染的控制制度和检查措施。
对于不同剂型品种生产,该车间采用了分阶段生产的办法。一个品种生产结束后,严格执行清场操作规程,并由QA检查员监督检查,合格后发放清场合格证,允许生产下一个产品。生产区域环境、个人、设备工具、物料的卫生要求,均建立了清洁卫生制度及规程,定期检查并详实记录。
4.2 质量风险评估为对该制剂车间进行质量风险管理评估,企业成立了由质量负责人任组长的质量风险管理小组。小组成员还包括生产总监、工程部经理、设备部经理、质量保证部主任、制剂车间QA等人员。质量风险管理小组通过对各剂型品种进行生产工艺分析,采用现场操作调查、以往经验积累、回顾历史数据、头脑风暴等方法,结合企业车间生产实际情况,经充分讨论后,对该车间可能存在的风险进行评估赋值,结果见表 4。
|
|
表 4 风险评估情况 |
根据表 4分析,该企业固体制剂车间共用厂房、共用设备、共用器具等4项风险RPN值均小于7,依据设定的RPN评价标准,风险程度可接受。而共用空气净化系统中的4项风险RPN值均大于8,属于中、高程度风险,必须采取有效控制措施,以降低P值和D值,使剩余风险降低至可接受水平。
经过质量风险管理小组讨论,对上述高、中风险采取相应的控制措施后,再评估的结果见表 5。
|
|
表 5 风险再评估情况 |
通过对该固体制剂车间多品种共用厂房、设施、设备生产的风险评估,判定有4项可能导致混药、污染和交叉污染的高、中等级风险因素;在采取相应的风险控制措施后,进行再评估,原来的高、中等级风险均降为低风险。
因此,风险评估小组认为,该固体制剂车间里多剂型多品种共线生产,影响产品质量的风险是可以接受的。
5 结语开展药品质量风险管理,持续改进药品质量,是落实药品生产企业主体责任的重要内容和具体体现。药品生产企业是实施药品质量风险管理并保证药品质量的第一责任人。药品生产企业实施质量风险管理应当根据科学知识对质量风险进行评估,与保护患者相关联。质量风险管理应当是动态的、持续的,不断促进企业质量管理水平的提高,最终实现大众的安全用药。
| [1] |
崔德福. 药剂学[M]. 7版. 北京: 人民卫生出版社, 2011: 163-167.
|
| [2] |
田英娜. 质量风险管理在药物口服固体制剂生产中的应用研究[D]. 开封: 河南大学, 2013: 27-28. http://d.wanfangdata.com.cn/Thesis/D371499
|
| [3] |
刘越川. 固体制剂制药工艺的新研究[J]. 黑龙江科学, 2016, 7(1): 20-22. |
| [4] |
宋敏, 黄泰康. 口服固体制剂生产的风险监管策略研究[J]. 中国药房, 2013, 24(1): 4-6. DOI:10.6039/j.issn.1001-0408.2013.01.02 |
| [5] |
卫生部. 卫生部令第79号药品生产质量管理规范: 2010年修订[S]. 2011.
|
| [6] |
The International Conference on Harmonisation (ICH) Guidance; Q9, Quality Risk Management[Z]. 2006.
|
| [7] |
傅强, 武志昂, 谢敬东. 质量风险管理在无菌原料药生产中的应用[J]. 求医问药, 2012, 10(11): 250-251. |
| [8] |
李均, 李志宁. 药品质量风险管理[M]. 北京: 中国医药科技出版社, 2011: 27-31.
|
| [9] |
梁毅, 黄雪. 基于固体制剂生产工艺的质量风险管理研究[J]. 中国药房, 2016, 27(13): 1733-1736. DOI:10.6039/j.issn.1001-0408.2016.13.02 |
| [10] |
武志昂. 从风险管理的角度看药品全程监管[J]. 中国药物警戒, 2008, 5(6): 321-325. |
| [11] |
张道旭, 武志昂. 质量风险管理在保健食品研发立项调研阶段的应用[J]. 食品安全质量检测学报, 2016, 7(11): 4707-4714. |
| [12] |
田英娜, 赵同双, 孙建勋, 等. 药物口服固体制剂制粒工艺风险的FMEA分析[J]. 中国药事, 2013, 27(1): 27-32. |
| [13] |
王慧萍. 抗肿瘤原料药车间空调系统的风险评估与控制[J]. 机电信息, 2014(11): 22-26. |
| [14] |
杜艳红. 质量风险管理在药品生产企业GMP实施中的应用研究[J]. 医药卫生:文摘版, 2016(10): 206-208. |
| [15] |
吕锐. 在药品GMP实施中运用质量风险管理的探讨[J]. 中国药事, 2013, 27(10): 1097-1099. DOI:10.3969/j.issn.1002-7777.2013.10.024 |
 2017, Vol. 31
2017, Vol. 31 
