警告信(Warning Letter)是美国食品药品管理局(Food and Drug Administration,FDA)的一种监管手段,用以通知企业在美国FDA现场检查中存在严重违规行为,即通知企业FDA认为它的产品、行为、过程或其他活动违反了美国《联邦食品、药品与化妆品法案》(Federal Food,Drug and Cosmetic Act)和其他相关法规[1]。警告信的内容主要包括检查情况、缺陷项目和整改要求等,其中缺陷项目是警告信的主要内容。企业应在收到警告信后的15个工作日内给出书面答复,如果没有根据警告信内容作出充分整改,将会导致产品查封、进口禁令、起诉等严重后果,企业在全球的声誉也将受到影响[2-3]。本文统计分析了2011-2016年FDA对国外企业发出的药品CGMP(current Good Manufacturing Practice,药品生产质量管理规范)警告信,重点对2016年警告信内容进行统计分析,归纳警告信中经常发生的缺陷项目,从而了解FDA检查的关注点,以便企业在实施CGMP过程中借鉴和提高。
1 数据来源FDA官方网站,http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/default.htm。
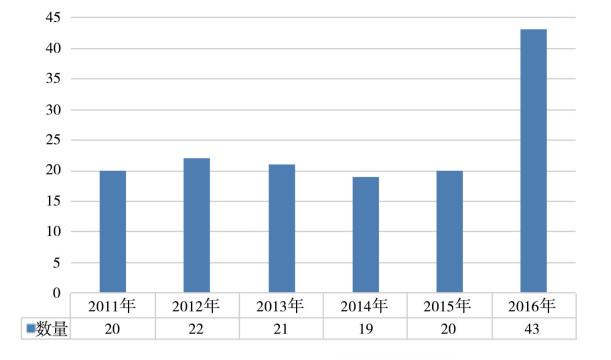
2 分类统计 2.1 年份数量统计CGMP警告信的数量可作为药品质量波动的信号,也可以反映FDA对药品的监管重点和趋势。2011-2016年FDA发布的国外企业药品CGMP相关警告信共145封,范围涉及药物制剂和原料药。2011-2015年药品CGMP警告信的数量每年稳定在19~22封之间。2016年警告信数量为43封,与往年相比显著增加,说明药品生产质量相关问题集中凸显,FDA的检查力度加强(见图 1)。
|
图 1 2011-2016年FDA药品cGMP警告信数量统计 |
要注意的是,从现场检查结束到警告信发布时间间隔一般在6 ~ 1 3个月,甚至更长时间。2016年发布的警告信距现场检查结束时间在97~484天之间,平均间隔时间为307天。在43封警告信中,2家为2014年现场检查,27家为2015年现场检查,14家为2016年现场检查,这说明在2016年警告信所集中反映的数据可靠性等问题从2014年就已经开始逐步出现。
2.2 地区分布统计2011-2016年FDA发出的145封警告信涉及26个国家和地区。2011-2015年警告信分别涉及10、12、9、7、10个国家和地区;2016年警告信涉及14个国家和地区,药品CGMP国际检查覆盖范围更加广泛。
2011-2016年收到警告信数量最多的国家和地区依次是印度(43件)、中国(大陆)(29件)、德国(10件)、西班牙(6件)、墨西哥(6件),其它国家和地区均未超过5件(见表 1)。印度和中国(大陆)占所有警告信的49.7%,警告信数量一方面与对美国药品出口规模有关,另一个方面也反映了国家和地区间药品生产质量管理水平的差异。
|
|
表 1 药品CGMP警告信地区分布统计表 |
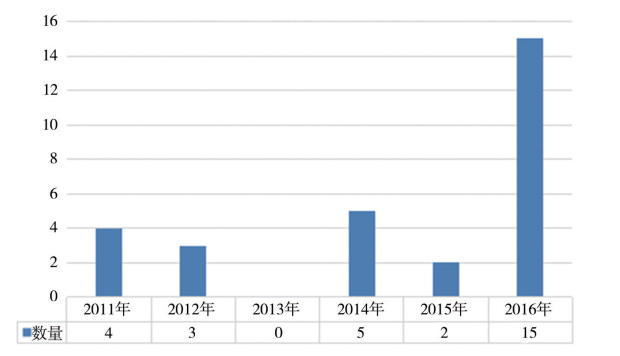
从中国(大陆)收到的警告信情况看,2016年以前每年收到的警告信未超过5件,但2016年警告信高达15封(见图 2)。在15家收到警告信的企业中,11家为2015年现场检查,4家为2016年现场检查,近半数(7家)存在数据可靠性问题。
|
图 2 2011-2016年中国(大陆)收到警告信数量统计 |
2016年FDA对国外药品生产企业共发出43封警告信,其中19家制剂企业,21家原料药企业,3家企业同时涉及药物制剂和原料药。在43家企业中,3家存在拒绝或妨碍现场检查的情况。
FDA的检查是基于质量管理系统、厂房与设施设备系统、物料系统、生产系统、包装和贴签系统以及实验室控制系统等六大系统进行的[4-5]。对2016年发出的43封警告信共154项缺陷进行分类统计,缺陷占比最高的分别是实验室控制系统(31%)、质量管理系统(30%)、厂房和设施设备系统(21%),这三大系统占总缺陷数的82%(见表 2)。
|
|
表 2 2016年药品CGMP警告信缺陷项统计 |
实验室控制系统方面,数据可靠性、分析方法验证、稳定性测试、物料检验和放行等在警告信中均有体现。数据可靠性问题最为突出,21封警告信列有相关缺陷,占警告信总数(43封)的49%。数据可靠性的主要缺陷:公司未能维护测试中产生的完整数据;未能对计算机化系统进行充分的控制;未能防止未经授权的进入或更改数据;未能提供充分控制来防止对数据的篡改和删除等。
质量管理系统方面,书面规程、偏差调查和质量部职责是FDA关注的重点。书面规程是质量管理和具体操作的依据,FDA非常注重程序和记录等文件的完善程度[6],19封警告信列有相关缺陷,占警告信总数的44%;主要缺陷:公司未建立充分的生产和工艺控制的书面程序;未能为生产、加工、包装或存贮药品的设备建立并遵守书面的清洁和维护程序;未能遵守足够的书面程序,制订规程和记录文件,用以保证批间的一致性等。偏差和OOS应经过彻底调查并采取有效的纠正和预防措施,确保药品的质量和体系的有效性,13封警告信列有相关缺陷,占警告信总数的30%;主要缺陷内容:公司未能建立和遵守变更管理系统;质量部门未能充分调查关键偏差和OOS结果;未能确保所有关键偏差都被解决,并实施纠正和预防措施。质量部职责缺失或职责不明都会被看作严重问题,8封警告信列有相关缺陷,占警告信总数的19%;主要缺陷内容:公司未建立独立的或足够的质量控制部门;质量控制部门不能充分履行拒收或放行物料和产品的职责。
厂房、设施与设备系统方面,清洁问题最为集中,12封警告信列有相关缺陷,占警告信总数的28%;主要缺陷:公司未能维护药品生产、加工、包装和存贮所用的建筑物的清洁卫生,保持其不受啮齿动物、鸟儿、昆虫和其它害虫的侵入;未能适当维护用于药品生产设备,使其处于清洁状态;未能根据药品的特性要求按适当的时间间隔清洁、维护、消毒或灭菌设备和工器具,以防止发生故障或污染等。
3.2 制剂与原料药企业警告信对比分析 3.2.1 制剂企业警告信统计对2016年22封涉及药物制剂企业的警告信缺陷项目,根据21 CFR 211章节进行分类统计[7],实验室控制、生产和加工控制、设备、记录和报告四个章节缺陷比例最高,占总缺陷的70%(见表 3)。从21 CFR 211具体条款看,涉及数量最多的条款依次是书面规程和偏差(211.100),质量控制部门的职责(211.22),销售前的检验与放行(211.165),设备清洁与维护(211.67),成分、药品容器和封口物品的试验、批准或拒收(211.84),这5项条款占总缺陷条款的48%,说明CGMP检查缺陷相对集中,企业间的问题具有普遍性。
|
|
表 3 2016年药物制剂企业CGMP警告信缺陷项统计 |
对2016年24封涉及原料药企业的警告信缺陷项目根据ICH Q7A章节进行分类统计[8],实验室控制、质量管理、文件和记录、工艺设备四个章节缺陷比例最高,占总缺陷的87%(见表 4)。
|
|
表 4 2016年原料药企业CGMP警告信缺陷项统计 |
在厂房和设施、设备、记录等方面,制剂与原料药企业缺陷比例相近,问题具有普遍性。但在生产控制、实验室控制、质量管理等方面,制剂与原料药企业的缺陷存在差异。
在生产控制方面,制剂企业缺陷占19%,原料药企业仅占1%,这可能与药物制剂特别是无菌药品对生产环境要求较高、工艺控制过程较为复杂有关。在实验室控制方面,制剂企业缺陷占22%,原料药企业高达41%,说明原料药企业实验室管理环节更为薄弱。在质量管理方面,在21 CFR 211中组织与人员章节与ICH Q7A中质量管理、人员章节相对应,制剂企业相关缺陷占10%,原料药企业占22%,说明原料药企业在质量部门职责、人员培训等方面问题更为突出。
4 讨论药品CGMP警告信具有严肃性、权威性,通过警告信可以反映FDA对药品的监管重点、意图和现场检查思路, 发现国际制药工业质量控制的趋势和普遍存在的问题,找到企业在质量管理方面的改进途径和方法[9]。通过对警告信的分析,笔者建议企业从以下几个方面提升CGMP符合性。
1)构建质量文化,强化质量意识。良好的质量文化和质量意识是质量管理体系运行的可靠保证,警告信中涉及的拒绝和妨碍现场检查、篡改和删除检测数据、未遵守书面规程等缺陷的存在,反映了部分企业质量文化有瑕疵、CGMP意识不深入。企业在实施CGMP过程中,应自上而下构建良好的质量文化,强化CGMP意识,严格实施,全员参与,提高CGMP的执行力,保证整个体系的有效性[10-11]。
2)关注检查重点,把握检查趋势[12]。实验室控制系统、质量管理系统、厂房与设施设备系统是FDA现场检查重点关注的方面,质量部职责、偏差调查、书面规程和清洁是检查缺陷集中的内容,数据可靠性是近几年检查的热点和问题的突出点,这些方面需要企业给予重点关注,确保CGMP的符合性。
3)熟悉检查流程,合理应对缺陷。企业应在检查前充分准备,建立外部审计程序,在现场检查时沉着应对、诚信以待,确保整个审计过程有序进行[13-14]。面对现场检查发现的问题,应认真分析原因,做好纠正预防措施,而不是想方设法去开脱问题。此外,及时和顺畅的语言沟通对于现场检查的顺利开展是非常必要的。
在FDA药品CGMP现场检查力度加强、发布警告信数量增加的背景下,企业只有建立完善的质量管理体系、构建良好的质量文化、切实提高CGMP的符合性,才能为我国药品走向国际市场打好基础。
| [1] |
段然. 浅谈美国FDA警告信的作用[J]. 中国药事, 2013(3): 332-333. |
| [2] |
Wang L, Zheng H, Ren X, et al. Trend Analysis of FDA Warning Letters Issued to Medical Products About Violations to Current Good Manufacturing Practices(CGMP) Between 2007 and 2014[J]. Therapeutic Innovation & Regulatory Science, 2016, 50(3): 312-318. |
| [3] |
韩文涛, 张铁军, 王艳稳. FDA国外CGMP检查对中国制药企业的影响分析[J]. 中国药事, 2011, 25(11): 1140-1142. |
| [4] |
Patel D S. FDA Warning Wetter Wnalysis:A Tool for GMP Compliance[J]. International Journal of Pharmaceutical Sciences and Research, 2012, 3(12): 4592-4603. |
| [5] |
韩亮, 郑强. 美国FDA药品生产质量监管体系[J]. 中国新药杂志, 2012, 21(18): 2128-2136. |
| [6] |
梁毅, 王慧敏. FDA医药产品cGMP相关警告信分析[J]. 中国药房, 2008, 19(25): 1924-1926. |
| [7] |
US Food and Drug Administration. CFR-code of Federal Regulations Title 21:Current Good Manufacturing Practice for Finished Pharmaceuticals Part 211[S]. 2014.
|
| [8] |
ICH Q. Guideline:Good Manufacturing Practice Guide for Active Pharmaceutical Ingrededients[S]. 2015.
|
| [9] |
Kamal K M, Desselle S P, Rane P, et al. Content Analysis of FDA Warning Letters to Manufacturers of Pharmaceuticals and Therapeutic Biologicals for Promotional Violations[J]. Drug Information Journal, 2009, 43(4): 385-393. DOI:10.1177/009286150904300401 |
| [10] |
韩莹, 柏建学, 许丹, 等. 2015年山东省药品GMP认证检查情况分析[J]. 药学研究, 2016, 35(7): 427-430. |
| [11] |
韩莹, 胡敬峰. 山东省无菌药品生产企业色谱系统数据可靠性现状分析[J]. 药学研究, 2017, 36(2): 121-124. |
| [12] |
毕军, 陈佩毅, 沈传勇, 等. 通过国际药品GMP认证的药品生产企业调研情况分析[J]. 中国药事, 2014(9): 954-958. |
| [13] |
叶有春, 贾伟. FDA警告信的统计与启示[J]. 医药工程设计, 2009, 30(3): 21-23. |
| [14] |
李成平, 张媚, 孙国君, 等. 中美两国GMP认证体制比较研究[J]. 中国药房, 2014, 25(9): 772-774. DOI:10.6039/j.issn.1001-0408.2014.09.02 |
 2017, Vol. 31
2017, Vol. 31 