2. 国家药典委员会, 北京 100061
2. Chinese Pharmacopoeia Commission, Beijing 100061, China
中药注射剂是中药现代化发展的产物,20世纪40年代第一个中药注射剂——柴胡注射液的成功研制标志着中药注射剂的诞生,距今已有70多年的历史。中药注射剂经历了从无到有、逐渐发展,由不被认知到广泛应用于临床的过程。随着中药注射剂在临床应用愈来愈广泛,出现了诸如鱼腥草注射液、双黄连注射液、清开灵注射液等不良反应事件,使中药注射剂的安全有效性和全面质量控制引起了社会的广泛关注。本文从全面了解和掌握中药注射剂的基本情况、生产状况、临床应用等方面入手,对中药注射剂的国家药品标准提高工作进行标准比对,结合部分企业的调研对其中药注射剂质量控制进行深入分析,以期为中药注射剂国家药品标准的制修订、促进中药注射剂进一步科学健康发展,以及为相关监管工作提供研究资料和技术支撑。
1 中药注射剂品种的基本信息及质量标准分布通过对国家食品药品监督管理总局(以下简称“总局”)数据库的信息检索,目前我国共有132个中药注射剂品种,其中129个品种为国家药品标准;3个品种为企业注册标准。对129个国家药品标准品种进行生产企业、文号及省份分布统计发现,共有960个批准文号,涉及219家企业,分布在28个省份。
经对129个中药注射剂品种标准及收载情况进行溯源发现,其中收载于2015年版《中国药典》有5个,收载于部颁标准的品种有53个,地标升国标品种有29个,新药标准有20个(包括新药转正标准9个,新药试行标准11个),局颁修订标准有29个。个别中药注射剂既在部颁标准收载,又在地标升国标收载,如板蓝根注射液等;有的既在部颁或地标升国标收载,又在试行标准收载或局颁标准收载,如复方麝香注射液等,意味着同一名称的中药注射剂,不同企业执行不同的标准。
2 生产企业分布、销售及临床使用分析 2.1 中药注射剂的生产销售情况通过查询有关数据库,截至2015年底,中药注射剂近3年产量合计超过1亿支的有7个品种,按产量排名依次是清开灵注射液(4.12281950亿支)、参麦注射液(2.29919112亿支)、舒血宁注射液(2.13582175亿支)、香丹注射液(1.72342218亿支)、柴胡注射液(1.49925308亿支)、丹参注射液(1.19211686亿支)、喜炎平注射液(1.07764303亿支)。产量在1000万到1亿支之间的品种包括生脉注射液、血塞通注射液、注射用血栓通(冻干)等41个品种。据中康CMH数据[1]显示,2015年我国中药注射剂的市场规模为877.06亿元,同比2014年增长了0.85%;据不完全估计,预计2016年市场规模将达到891.10亿元,仍保持一定的增长率。统计数据还显示,2013年至2016年,中药注射剂市场销售额逐年增长,但增长率不高:2013年市场销售总额为736.97亿元,2014年同比2013年增长了18.01%,2015年与2014年相差不大,市场总销售额为877.06亿元,较2016年少14.03亿元。在所有中药注射剂中,市场规模排名前20位的品种:血栓通、血塞通、银杏叶、醒脑静、丹红、参麦、疏血通、喜炎平、康艾、生脉、灯盏花素、丹参多酚酸盐、热毒宁、红花黄色素、参芪扶正、痰热清、艾迪、参附、丹参、血必净注射液。
2.2 中药注射剂的临床使用情况由中药注射剂的生产销售和市场规模来看,自2014开始,出现了低增长率的态势。可能是由于医保控费、医院调整药占比、规范临床路径等一系列医改措施的实施,以及关于中药注射剂不良反应报告,停用、限用以及辅助用药等多方面的政策,对中药注射剂的发展造成了一定的影响[1]。
评价指标为用药频度DDDs。DDDs:药物的经济性参数,为每一种药物的年消耗量除以该药的DDD值。DDDs越大,反映患者对该药的选择倾向性越大;反之说明患者较少使用。这是一种利用用药频度分析评价药物在临床中地位的方式。DDDs(用药频度)=总用药量/DDD,DDD值为每日规定剂量,一般以《中国药典》(2015年版)规定的剂量为准,药典未收载的药品结合其说明书及临床实际而定。评价模式,通过中国药学会数据库对1070家全国医药经济信息网(CMEI)样本医院进行中药注射剂2016年1~3季度采购品种、采购金额和采购数量的检索、统计。CMEI网员医院中,有采购数据的中成药注射剂约90多个品种,其中以注射用丹参多酚酸盐采购金额最大,占比为9.04%;采购数量占比最大的是注射用血栓通(冻干),占药品采购数量的8.85%。综合采购数量占比和采购金额占比,排名前10位的品种见表 1。
|
|
表 1 CMEI网员医院中药注射剂采购数量和采购金额占比情况(前10位) |
表 1中,以祛瘀剂和扶正剂为主,包括5个祛瘀剂、3个扶正剂;另外2个品种,1个是清热解毒剂、1个是醒脑剂。这与中康CMH数据显示的中药注射剂市场规模排名(TOP)前20品种名单的内容基本一致。综合排名前30位的中药注射剂采购总金额占比达到85.96%,采购数量总占比达85.81%,说明中药注射剂的临床应用数量和品种还是相当广泛的,属于临床常用制剂。
依据中国药学会与总局数据库信息,将中药注射剂采购品种、金额和数量综合排名与中药注射剂生产企业作对应性分析发现,排名前8位的中药注射剂品种与生产企业完全对应,即1个品种仅对应1家生产企业,均为独家企业生产品种,分别是上海绿谷制药(注射用丹参多酚酸盐)、长白山制药(康艾注射液)、山东步长制药(丹红注射液)、广西梧州制药[注射用血栓通(冻干)]、江西青峰医药(喜炎平注射液)、浙江康莱特(康莱特注射液)、丽珠医药(参芪扶正注射液)、牡丹江友搏(疏血通注射液)。
由中药注射剂的生产、市场份额、临床使用情况可见,中药注射剂是临床常用的一种制剂,但并非所有品种均为临床常用品种,临床常用品种大概有30种左右。根据企业与品种对接结果发现,独家品种相对而言更受医院青睐,原因是独家生产的中药注射剂品种进货来源相对固定,企业的工艺、设备、原料、质量标准等相对固定,不会出现多个质量标准同时存在的现象。这就为中药注射剂的国家药品标准提高和质量控制提供了很好的基础保障。
2.3 中药注射剂品种及生产企业分布对中药注射剂生产企业进行统计,其中有66个中药注射剂品种为独家企业生产品种;其余中药注射剂品种均为多家企业生产。图 1为生产企业数≥5家的中药注射剂品种。
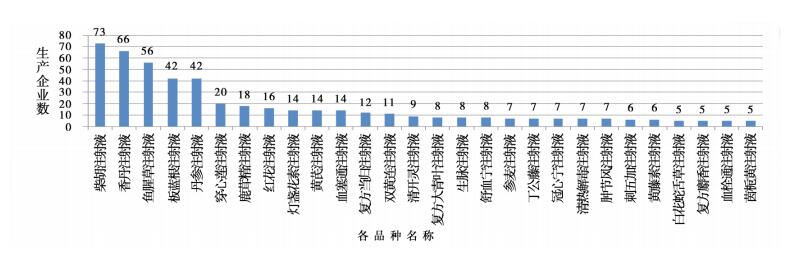
|
图 1 生产企业数2≧5家的中药注射剂品种 |
对中药注射剂生产企业的品种数和生产企业数在各省份的分布进行统计分析,具体情况见图 2。
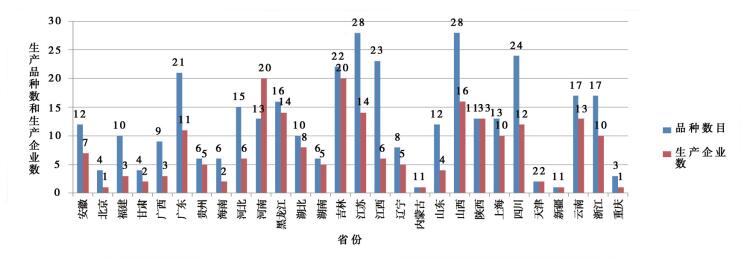
|
图 2 中药注射剂品种数与生产企业数的地区分布 |
由图 2可见,中药注射剂品种及生产企业分布呈如下特点,即以东部的苏浙沪、北部的黑吉、南部的粤蜀滇、中部的晋豫陕为中心呈辐射状分布。提示中药注射剂的标准提高工作可根据独家、多家企业生产的不同情况,按照品种省份分布进行部署安排。
3 中药注射剂质量标准提高情况中药注射剂不同于其他中药制剂,因其来源于中药,故具有中药成分复杂、分离分析困难的特点;又因其属于注射剂,特殊的给药方式决定其质量标准必须更加科学严谨;加之工艺复杂,标准制定就更加困难。修订一个相对完善的中药注射剂质量标准,需要生产企业严格控制作为原料的中药材和中药饮片质量,保证其来源稳定;要与生产过程紧密结合,严格控制生产工艺、生产设备、药材/饮片、中间品及成品质量项目;需要中药注射剂生产企业与质量标准修订研究单位共同合作,才能完成好中药注射剂的质量标准提高工作。
3.1 中药注射剂标准提高的总体要求2007年,国家药典委员会根据原国家食品药品监督管理局的要求,安排了127个中药注射剂的质量标准提高任务,提出了标准提高的总体要求,确定了标准研究起草单位和复核单位。
标准提高的总体要求是:建立中药注射剂的指纹图谱和安全性指标控制;中间体质量标准、指纹图谱;pH值、重金属和有害元素、钾离子、蛋白质、鞣质、草酸盐、树脂等指标。按给药途径不同要求存在一定差异:静脉给药的品种要求增加热原(或细菌内毒素)、过敏反应物质、降压升压物质、异常毒性、溶血与凝聚、渗透压等指标;肌内注射品种安全性要求增加热原(原料和工艺易污染热原、且用量较大者)、过敏反应物质、异常毒性、溶血与凝聚等指标;局部使用品种(包括穴位、患处)要求增加热原(或细菌内毒素)、过敏反应物质、异常毒性、溶血与凝聚等指标;包含肌内注射、静脉给药两种途径的品种要求包含两种途径的全部要求[2]。
3.2 标准提高完成品种原标准与现行标准的比对共完成了约33个中药注射剂品种和1个原料药的标准提高和质量标准修订、颁布工作,其中有10个中药注射剂为国家基本药物目录收载品种。这些质量标准相对完善,无论是从处方原料、制剂工艺、安全性检查项目、成分控制等方面,均提出了相对严苛的规定,为其质量稳定性和安全性提供了基础保障。已完成标准提高品种的原标准与现标准检测项目比对情况见表 2。
|
|
表 2 已完成标准提高品种原标准与现标准检测项目比对分析 |
标准提高以后,在以下方面得到了显著改善:
(1)鉴别:提高后的标准中基本所有品种均删除了专属性较差的理化鉴别,修订为TLC鉴别,且不只以单一对照品进行对照,还增加了对照药材为对照的TLC鉴别,以更全面地控制药材投料。
(2)检查:提高后的标准检查项目明显增多,而且根据给药方式和药材特点,重点针对安全性控制项目如异常毒性、过敏反应、降压物质、重金属等检查进行了研究并列入标准正文。
(3)含量测定:在有效成分选择和限度设置上更趋于科学合理,从指标成分逐渐向有效活性成分过渡,而且在控制技术上普遍应用灵敏、方便、高效的HPLC测定法,利用一测多评方法简便快速地评价、控制药品质量。
(4)指纹图谱:经对表 2品种原标准与提高后标准进行对比发现,有26个品种新增了指纹图谱(有效成分除外)。指纹图谱作为目前控制和评价中药及其复方质量的科学有效方式,已逐步成为中药注射剂质量标准控制必不可少的项目;而且按照相关技术要求,相似度全部在0.80以上,有的甚至达到0.95,相似度非常高。
指纹图谱的相似度评价方法有全谱相似度和特征峰(Mark峰)相似度之分,两种评价方式在质量标准正文的描述不同:前者一般描述为“在a~b min范围内,本品指纹图谱与X注射液对照指纹图谱比较,相似度应不得低于y”;后者则为“在a~b min范围内,应呈现C个与X注射液对照指纹图谱相对应的特征峰,按中药色谱指纹图谱相似度评价系统计算,以特征峰计算相似度,本品指纹图谱与X注射液对照指纹图谱比较,相似度不得低于y” [61]。
经对34个品种的相似度评价分析发现,全谱相似度分析的品种:注射用薏苡仁油、注射用益气复脉(冻干)、注射用血栓通(冻干)、注射用血塞通(冻干)、血栓通注射液、血塞通注射液、血必净注射液、喜炎平注射液、痰热清注射液、双黄连注射液、舒血宁注射液、清开灵注射液、脉络宁注射液、康莱特注射液、康艾注射液、丹参注射液、喘可治注射液、参芪扶正注射液、参附注射液、瓜蒌皮注射液、复方苦参注射液。使用Mark峰相似度分析的品种:生脉注射液、参麦注射液、红花注射液、冠心宁注射液、注射用双黄连(冻干)、注射用丹参(冻干)、消癌平注射液、蟾酥注射液。其中注射用丹参多酚酸盐,以共有峰个数和非共有峰峰面积占比质控;柴胡注射液为采用GC特征峰质控,标准要求“6个特征峰的相对保留时间在规定时间的±8%范围内”。
3.3 部分中药注射剂质量控制情况调研分析根据对129个中药注射剂品种的基本情况、已完成标准提高品种的分析,为进一步了解提高后的标准对产品及企业的影响以及生产企业对中药注射剂质量全过程控制现状,笔者以调查问卷的形式通过浙江省食品药品检验研究院、上海市食品药品检验所、黑龙江省食品药品检验检测所,对部分中药注射剂生产企业的品种进行了调研。调查问卷以品种为单位设计,一份问卷只允许填写一个品种。共发放27份调查问卷给相关药检所,收回来自10个企业的17份调查问卷。
本次调研依据标准提高任务完成度排名前后选择调研区域。对任务完成度的统计发现,东部(苏浙沪)为36.4%、北部(黑吉)为25%、南部(粤蜀滇)为31.8%、中部(晋豫陕)为10%。其中东部完成度最佳,故为选择调研地区之一;南部和北部比较,根据实际可行性选择了北部为另一个调研地区。鉴于时间和条件限制,仅主要针对浙江、上海、黑龙江3个省市的部分中药注射剂生产企业发放了调查问卷。本次问卷调查共涉及康莱特注射液、丹参注射液、参麦注射液、刺五加注射液(3份)、舒血宁注射液、黄芪注射液(3份)、注射用红花黄色素、双黄连注射液、双黄连滴注液、注射用血塞通(冻干)、注射用丹参多酚酸盐、血栓通注射液、红花注射液、灯盏花素注射液14个中药注射剂品种,其中已完成标准提高有10个品种;其余4个品种的质量标准提高工作均处在研究状态。
3.3.1 生产全过程控制情况① 处方原料控制情况:调查问卷涉及的已经完成标准提高的10个中药注射剂,60%明确了处方原料基源,且有固定的来源和种植基地;剩余品种虽无固定的种植基地,但也明确了药材基源并固定来源。正在进行标准提高研究的4个品种,其中黄芪注射液收到了来自3家不同企业的报告,只有1家企业的原料有自己单独固定的种植基地,其他2家均未建立种植基地;其他3个品种,均已固定处方原料基源,但未建立种植基地。
② 工艺备案:调查的所有品种均已按总局要求进行了工艺备案,说明企业对工艺问题十分重视。
③ 指纹图谱:在调研品种中,50%建立了原料、中间体和成品的指纹图谱;有5个品种还对原料、中间体和成品之间的相关性进行了研究,建立了相关性指纹图谱,为中药注射剂的质量稳定性控制提供了保障。
3.3.2 企业对提高后的标准执行情况从问卷情况看,标准提高对企业的生产和检测成本及产品质量影响明显。多数企业反映,质量标准提高后中药注射剂的质量更加稳定、有效、安全;从生产到工艺到成品全过程控制更加完善科学,有利于全面控制中药注射剂质量和开展企业风险评估工作。但企业普遍反映,标准提高以后大大增加了生产和检测成本,建议进一步对中药注射剂进行基础研究和风险评估,适当减少那些有明确数据支持的不必要检查项目。
4 未完成标准提高品种的标准现状在本课题涉及的129个品种中仍有96个中药注射剂未完成标准提高工作,其中丹红注射液已经完成标准提高研究审核,处于报审批阶段;注射用红花黄色素也已完成标准提高研究工作,处于公示阶段。目前,这96个品种共查询到112个最终标准。这些最终标准分布在部颁、地升国、新药转正、试行、卫生部药典会、77年版药典等标准中。经对未完成标准提高品种的现行国家药品标准收载项目进行梳理分析发现,呈现出以下特点:① 处方制法描述简单或某一项未列入国家药品标准正文。② 除个别新药转正品种外,其他部颁、地升国、卫生部药典会、77年版药典等标准的品种,鉴别、含量测定等项目方法简单且不专属,质控覆盖面较低,基本仅控制其中的一两个药味,特别是对于检查项目而言,多数仅有pH值、注射剂附录项下基本控制项目,对于一些安全性项目如过敏反应、溶血与凝聚、异常毒性等均未设置检查项。③ 吐温80等辅料的使用率较高,52.1%的品种添加了辅料,包括吐温80、亚硫酸氢钠、苯甲醇等,以吐温80使用率最高。具体案例如:黄瑞香注射液(WS3-B-3500-98),苦黄注射液(WS3-264(Z-038)-2001(Z)),刺五加注射液(WS3-B-3425-98),丹红滴注液[WS-11221(ZD-1221)-2002]。
祖师麻注射液为单方制剂,现执行标准收载于部颁20册,为多家企业生产品种,该品种目前的执行标准【鉴别】【检查】【含量测定】项。
热可平注射液以北柴胡和鹅不食草组方,现执行标准为部颁20册,标准号为WS3-B-3964-98,为独家企业生产品种。该品种现执行标准仅有【鉴别】和【检查】项,无【含量测定】项。
未完成标准提高品种目前处于以下几种状态:一是在标准提高研究过程中,还在补充资料上报和审评状态,大概有10个品种左右;二是之前上报审评后需要补充研究的品种,已通知发补但至少近几年无动态变化信息,也未再行上报,有的甚至已经联系不到企业负责人;经查询总局数据库发现,这些品种的文号处于有效状态,但生产销售与否无确切详细的调查统计信息。
5 关于中药注射剂标准提高和质量、安全再评价的分析与建议中药注射剂作为高风险品种,其质量、有效性、安全性和质量标准仍需不断完善和提高。从目前中药注射剂品种情况发现,文号有效的品种有100多个,临床常用的品种却只有30个左右。标准提高目前完成了33个,这些品种的质量标准相对完善,且根据企业的反馈信息可知,提高后的质量标准对保证产品质量、安全、稳定均一以及评估和防控风险均有一定作用。反观未完成标准提高品种数量和标准现状,建议首先进行品种评估,确定这些品种的市场、临床应用价值及标准提高的可行性,然后分批分步进行标准提高工作。从质量标准收载项目及各项目的制定上进行研究思考,可参考已完成标准提高的中药注射剂品种,完善必要的项目,依据现有科学技术和方法,研究建立与现行水平相适应且符合各中药注射剂自身特点的鉴别、检测和含量测定方法;同时,研究制定详细科学的制剂工艺,进行原料、成品与制剂的相关性研究,为中药注射剂的全过程控制和整体控制提供基础数据,并视情况列入标准正文。
5.1 国家相关部门对既成工艺的处理通过中药注射剂标准提高调研工作发现,中药注射剂生产工艺大部分已经发生了变化,这种变化大部分未经过临床有效性研究,部分企业通过安全性再评价的方式对临床安全性进行考察;对生产工艺的改变,企业基本按照原国家食品药品监督管理局2007年的文件要求进行了备案。对这种既成事实的情况,建议予以认可。
5.2 应制定全过程技术要求和指南生产企业是中药注射剂质量的第一责任人。中药注射剂的质量从原料、生产过程直至制剂,要进行全过程控制。建议从中药材的种子种苗、种植过程、采收、饮片加工、中药提取以及注射剂生产全过程进行控制,建立相应的指南或技术要求,促使中药注射剂生产企业逐步规范。
5.3 企业应积极配合并参与标准提高工作中药注射剂质量标准提高工作,需要生产企业与标准提高承担单位密切配合,需要生产企业在固定中药材产地、来源以及在固定生产工艺的基础上进行。从目前完成标准提高的品种数量来看,情况并不理想。究其原因,生产企业如何配合是一个非常现实的问题:企业积极配合,标准提高工作就能较好完成;企业不重视或没能力,标准提高工作就处于停滞状态。建议采取时间倒逼机制,强制注射剂生产企业配合完成标准提高工作。
中药注射剂质量标准提高可以不断完善中药注射剂的质量,但仍不能确保其临床安全性和有效性。中药注射剂质量、临床有效性和安全性不能简单地依靠国家药品标准来评判,需要生产企业通过临床真实性试验研究、临床数据进行综合评判,故必须有国家的正确引导以及企业的积极主动参与才能实现。
| [1] |
吴晓娜. 前途未卜22个被停用的中药注射剂品种分析[J]. XKJ0101, 2016, 11: 18-19. |
| [2] |
中国药典[S]. 2015.
|
| [3] |
中华人民共和国卫生部. WS3-B-3427-98参附注射液[S]. 1998: 166-168.
|
| [4] |
国家食品药品监督管理局. WS3-B-3427-98-2013参附注射液[S]. 2013.
|
| [5] |
中华人民共和国卫生部. WS3-B-3428-98参麦注射液[S]. 1998.
|
| [6] |
国家食品药品监督管理局. WS3-B-3428-98-2010Z参麦注射液[S]. 2010.
|
| [7] |
国家食品药品监督管理局. 国家药品标准新药转正标准第50册WS3-B-387(Z-50)-2003(Z)参茋扶正注射液[S]. 2006.
|
| [8] |
国家食品药品监督管理局. WS3-B-387(Z-50)-2003(Z)-2011参茋扶正注射液[S]. 2011.
|
| [9] |
中华人民共和国卫生部. WS3-B-3297-98柴胡注射液[S]. 1998.
|
| [10] |
国家食品药品监督管理局. WS3-B-3297-98-2011柴胡注射液[S]. 2011.
|
| [11] |
中华人民共和国卫生部. WS3-B-3354-98蟾酥注射液[S]. 1998.
|
| [12] |
国家食品药品监督管理局. WS3-B-3354-98-2013蟾酥注射液[S]. 2013.
|
| [13] |
国家食品药品监督管理局. 国家药品标准新药转正标准第65册WS3-839-(Z-164)-2004(Z)喘可治注射液[S]. 2008.
|
| [14] |
国家食品药品监督管理局. WS3-839-(Z-164)-2004(Z)-2012喘可治注射液[S]. 2012.
|
| [15] |
中华人民共和国卫生部. WS3-B-3766-98丹参注射液[S]. 1998.
|
| [16] |
国家食品药品监督管理局. WS3-B-3766-98-2011丹参注射液[S]. 2011.
|
| [17] |
中国药典: 一部[S]. 2010: 707-708.
|
| [18] |
中华人民共和国卫生部. WS3-B-2752-97复方苦参注射液[S]. 1997.
|
| [19] |
国家食品药品监督管理局. WS3-B-2752-97-2014复方苦参注射液[S]. 2014.
|
| [20] |
国家药品监督管理局. 国家中成药标准汇编中成药地方标准上升国家标准部分内科心系分册WS-11417(ZD-1417)-2002瓜蒌皮注射液[S]. 2002.
|
| [21] |
国家食品药品监督管理局. WS-11417(ZD-1417) -2002-2008瓜蒌皮注射液[S]. 2008.
|
| [22] |
中华人民共和国卫生部. WS3-B-3267-98冠心宁注射液[S]. 1998: 174-175.
|
| [23] |
国家食品药品监督管理局. WS3-B-3267-98-2012冠心宁注射液[S]. 2012.
|
| [24] |
中华人民共和国卫生部. WS3-B-3825-98红花注射液[S]. 1998.
|
| [25] |
国家食品药品监督管理局. WS3-B-3825-98-2012红花注射液[S]. 2012.
|
| [26] |
国家药品监督管理局. 国家中成药标准汇编中成药地方标准上升国家标准部分内科肺系(一)分册WS-11222(ZD-1222)-2002康艾注射液[S]. 2002.
|
| [27] |
国家食品药品监督管理局. WS-11222(ZD-1222) -2002-2012Z康艾注射液[S]. 2012.
|
| [28] |
国家食品药品监督管理局. WS3-301-(Z-038)-2006(Z)康莱特注射液[S]. 2003.
|
| [29] |
国家食品药品监督管理局. WS3-301-(Z-038)-2006(Z)-2013康莱特注射液[S]. 2013.
|
| [30] |
中华人民共和国卫生部. WS3-B-3462-98脉络宁注射液[S]. 1998.
|
| [31] |
国家食品药品监督管理局. WS3-B-3462-98-2011脉络宁注射液[S]. 2011.
|
| [32] |
中华人民共和国卫生部. WS3-B-2865-98生脉注射液[S]. 1997.
|
| [33] |
国家食品药品监督管理局. WS3-B-2865-98-2011生脉注射液[S]. 2011.
|
| [34] |
国家食品药品监督管理局. WS3-B-3707-98-2004舒血宁注射液[S]. 2004.
|
| [35] |
国家食品药品监督管理局. WS3-B-3707-98-2004-2011舒血宁注射液[S]. 2011.
|
| [36] |
中华人民共和国卫生部. WS3-B-2104-96双黄连注射液[S]. 1996.
|
| [37] |
国家食品药品监督管理局. WS3-B-2104-96-2010双黄连注射液[S]. 2010.
|
| [38] |
国家食品药品监督管理局. YBZ00912003-2007Z-2009痰热清注射液[S]. 2009.
|
| [39] |
国家食品药品监督管理局. YBZ00912003-2007Z -2009-2012痰热清注射液[S]. 2012.
|
| [40] |
国家药品监督管理局. 国家中成药标准汇编中成药地方标准上升国家标准部分口腔肿瘤儿科分册WS-10630(ZD-0630)-2002消癌平注射液[S]. 2002.
|
| [41] |
国家食品药品监督管理局. WS-10630(ZD-0630) -2002-2012Z消癌平注射液[S]. 2012.
|
| [42] |
国家药品监督管理局. 国家中成药标准汇编中成药地方标准上升国家标准部分内科肺系(二)分册WS-10863(ZD-0863)-2002喜炎平注射液[S]. 2002.
|
| [43] |
国家食品药品监督管理局. WS-10863(ZD-0863) -2002-2011Z喜炎平注射液[S]. 2011.
|
| [44] |
国家食品药品监督管理局. YBZ01242004血必净注射液[S]. 2004.
|
| [45] |
国家食品药品监督管理局. YBZ01242004-2010Z血必净注射液[S]. 2010.
|
| [46] |
中华人民共和国卫生部. WS3-B-3590-98血塞通注射液[S]. 1998.
|
| [47] |
国家食品药品监督管理局. WS3-B-3590-2001(Z) -2011血塞通注射液[S]. 2010.
|
| [48] |
中华人民共和国卫生部. WS3-B-3829-98血栓通注射液[S]. 1998.
|
| [49] |
国家食品药品监督管理局. WS3-B-3829-98-2011血栓通注射液[S]. 2011.
|
| [50] |
国家食品药品监督管理局. WS3-320-(Z-40)-2003(Z)注射用丹参(冻干)[S]. 2004.
|
| [51] |
国家食品药品监督管理局. WS3-320-(Z-40)-2003(Z) -2014注射用丹参(冻干)[S]. 2014.
|
| [52] |
国家食品药品监督管理局. YBZ09012005注射用丹参多酚酸盐[S]. 2005.
|
| [53] |
国家食品药品监督管理局. YBZ09012005-2010Z注射用丹参多酚酸盐[S]. 2010.
|
| [54] |
国家食品药品监督管理局. WS-10986(ZD-0986) -2002-2011Z注射用血塞通(冻干)[S]. 2011.
|
| [55] |
国家药品监督管理局. 国家中成药标准汇编中成药地方标准上升国家标准部分经络肢体脑系分册WS-10460(ZD-0460)-2002注射用血栓通(冻干)[S]. 2002.
|
| [56] |
国家食品药品监督管理局. WS-10460(ZD-0460) -2002-2011Z注射用血栓通(冻干)[S]. 2011.
|
| [57] |
国家食品药品监督管理局. YBZ07062006-2009Z注射用益气复脉(冻干)[S]. 2009.
|
| [58] |
国家食品药品监督管理局. YBZ07062006-2009Z-2011注射用益气复脉(冻干)[S]. 2011.
|
| [59] |
国家食品药品监督管理局. 国家药品标准新药转正标准第30册WS3-300-(Z-038)-2001(Z)注射用薏苡仁油[S]. 2003.
|
| [60] |
国家食品药品监督管理局. WS3-300-(Z-038)-2001(Z)-2013注射用薏苡仁油[S]. 2013.
|
| [61] |
聂黎行, 石上梅, 戴忠, 等. 指纹图谱技术在中药注射剂标准提高中的应用[J]. 中成药, 2015, 37(3): 607-611. DOI:10.3969/j.issn.1001-1528.2015.03.032 |
 2017, Vol. 31
2017, Vol. 31 
