近年来,药品短缺现象频频发生,由于药品生产中断、销售利润低、流通不畅等原因导致的药品不能及时供应,给患者看诊就医带来很大不便。药品短缺是一个全球性问题,美国、加拿大等发达国家以及中国、印度等发展中国家都报道过相应事件[1],短缺药品的管理和应对逐渐受到各国重视。相比较各个国家的处理方式,美国对短缺药品的处理着手较早,已经形成一套较为完备的体制,成功预防和改善了某些药品短缺[2-3]。
本文根据文献研究结果[4-9],结合美国官方披露的政策文件,梳理归纳了其系统规范的处理流程,并从中发现该处理流程的先进经验和优点所在,为我国短缺药品的管理实践提供思路和参考。
1 美国药品短缺管理机构美国短缺药品管理涉及多个部门参与,每个部门在需要时都积极配合、相互协调,但主要的管理部门有2个:药品短缺专责小组(Drug ShortageTask Force)和药品短缺工作小组(Drug ShortageStaff,DSS)。
1.1 药品短缺专责小组依据《食品、药品安全创新法案》(2012)(Food and Drug Administration Safety and InnovationAct,FDASIA)[10],美国食品药品管理局(FDA)在2012年成立了具有统筹支配作用的药品短缺专责小组,其成员包括来自生物制品审评和研究中心(Center for Biologics Evaluation and Research,CBER)、药品审评和研究中心(Center of DrugEvaluation and Research,CDER)以及监管事务办公室(Office of Regulatory Affairs,ORA)的职员,负责协调处理FDA关于药品短缺一系列政策的制定完善,并就药品短缺相关政策法规,以讨论会形式为FDA处理药品短缺的人员提供交流与沟通的机会,促进区域内和机构间信息的交换。
1.2 药品短缺工作小组1999年,CDER成立了DSS,使其成为处理潜在和实际药品短缺的首要负责小组。它的职责包括从各种来源接收有关药品短缺的报告、验证药品短缺是否属实、制定药品短缺管理计划、监测每个药品缺情况并及时传达等[11]。
2 美国药品短缺应对机制美国药品短缺的处理大致可分为3个步骤:药品短缺信息收集、药品短缺信息判断和药品短缺的处理,见图 1。
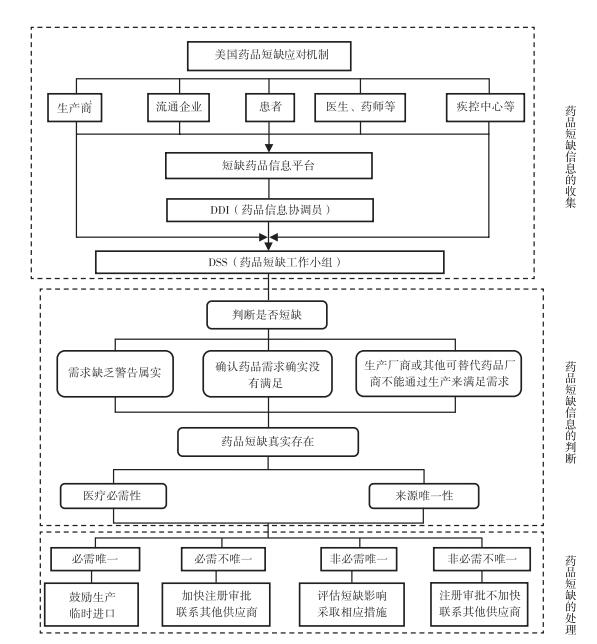
|
图 1 美国药品短缺应对流程 |
美国的药品短缺信息都是通过药品相关利益者上报获得的,上报过程有自愿性上报和强制性上报两种。二者的上报主体、途径等都存在差异。
2.1.1 自愿性短缺信息的上报FDA建立了专门的药品短缺网站来收集可能发生的药品短缺情况,所有与药品生产、经销和使用相关的利益者均可以通过网站自愿进行药品短缺信息的上报。专门的网络平台总共有3个:由CDER设立、DSS进行管理的短缺药品网站;由社会团体药师协会(American Society of Health-SystemPharmacists,ASHP)管理的短缺网站;犹他州大学管理的药品信息服务网站(Drug InformationService at the University of Utah)[12]。上述3个网站的信息公布各有侧重,性质也有官方与非官方之分,他们之间以日常工作的形式进行信息交换,从而共享短缺的信息以及药品供应的状态。
除此之外,有关药品短缺的信息还可以通过药品短缺的手机应用、CDER的邮件和电话收集。涉及其他广泛意义上的药品短缺时,类似于血液生物制品、疫苗、组织器官等可以通过CBER、食品安全和营养中心(Center for Food Safety and AppliedNutrition,CFSAN)、器械和放射性健康管理中心等其他相关部门的邮件电话收集[13]。
2.1.2 强制性短缺信息的上报目前,FDA要求强制性上报短缺信息的对象只涉及药品生产企业,规范强制性上报的相关法律包括:①《食品、药品和化妆品法案》 (FD&C ACT)506C节指出,如果药品生产厂商是某些用来维持生命或预防衰弱性疾病药品的唯一供应厂商,应在中止生产此种药品的6个月前将相关情况通报给监管机构。该条款仅仅将主体定义为唯一厂商,所说的终止也只被理解为永久的停产,其涵盖的药品范围也较为狭窄,不包括未获批的药品和生物制剂;②《行政指令13588》(Executive Order 13588)指出,确定药品短缺的多种不同原因需要多层面的方法,因此,FDA应使用所有适当的管理工具来要求生产企业提前上报全部可能导致短缺的中断停产[14];③《临时最终规则》(Interim Final Rule,IFR)表明,应当修改FDA有关短缺药品早期通知的相关规定,以增加FDA获得潜在药品短缺提前通知的可能性[15];④《食品、药品安全创新法案》扩大了早期上报企业的范围,要求医学上重要处方药(包括获批的和未获批的)所有生产企业提前告知FDA永久的或暂时的生产中断,并且允许FDA提前要求获知生物制剂中断生产的相关信息[16],FDA应当向未按法案规定内容上报的企业发送警告信。
2.2 药品短缺信息的判断在收到不同来源的药品短缺信息后,DSS会从市场需求、厂商情况以及专家意见3个方面对该信息的属实性和正确性进行判断,判断的过程包括:① 确定目前的药品需求是否稳定,利用市场研究数据库根据历史数据确定需求是否有所增长;② 联系药品生产厂商,使其提供精确的存货信息、生产时间表和订购形式;③ 根据厂商的所有销售网络,评估厂商药品分销情况;④ 评估从市场调查、生产厂商和所有经销商处获得的信息,从而决定是否存在实际的药品短缺;⑤ 根据专家意见,建立或完善医疗必需性评价。
在判断过程中,FDA还会寻找可能造成供应中断和药品短缺的因素,以风险分析为基础确定早期可能导致药品短缺的因素,包括药品制造中的生产问题和药品质量问题。为更好地评估这种风险,FDA会与相关利益者合作,在生产场所实地考察[17]。
基于上述判断过程,DSS会根据以下几个条件,来确定药品真实短缺情况:① 现在的和历史的药品需求未被满足;② 公众或者医药行业从业人员发出有关市场药品需求缺乏的警告并属实;③ 药品生产商和其他制造可替代药品的企业不能满足市场需求或增加生产来弥补短缺。
2.3 药品短缺的处理当确认药品短缺真实存在后,FDA和相关机构会先从企业、市场和患者群体3个角度出发来确认该短缺药品是否唯一和医疗必需,其次制定不同举措:① 对于是医疗必需品且来源唯一的短缺情况,FDA会鼓励药品生产企业继续生产,和厂商一起致力于生产中断、停产或药品质量造成缺陷问题的补救,从而尽快恢复短缺药品的正常供应。若短时间内不能恢复至正常保障水平,FDA会选择从其他国家愿意和能够出口药品的公司临时进口相同或具有相同活性成分的药品;② 对于是医疗必需品但来源不唯一的短缺情况,FDA会加快相关的审查审批,包括同种类新药或简明新药的申请审评,同种类生产企业《药品质量管理规范》(GMP)的审查,以及对有助于减轻或防止药品短缺的设施的检查;③ 对于不是医疗必需品但来源唯一的短缺情况,FDA会整体评估该种药品短缺带来的影响程度,根据影响程度的大小再决定采取何种具体的措施;④ 对于不是医疗必需品,来源也不唯一的短缺情况,FDA不会在注册审批方面加快速度,只会联系其他的供应商提供该种药品,尽可能地在短时间内满足该种药品的市场需求。
3 美国药品短缺应对机制对我国的启示 3.1 明确药品短缺的具体概念药品短缺的概念是制定我国药品短缺应对机制的前提。目前,我国还没有对药品短缺做出官方明确的界定,在对现阶段已出现短缺的药品处理时就出现了不统一的现象。部分人认为生产的短缺才是刚性的短缺,也有部分人认为罕见药和孤儿药也应纳入短缺药的范畴一并进行管理。在这种情况下,具体的管理对象范围含糊不清,后续的管理流程也就更难落实到位。
3.2 完善我国药品短缺管理法律法规在我国现有短缺药品管理政策的基础上,进一步将其具体化、明确化,增加政策的可操作性。同时,也增加保障政策的多样性,可以建立适用于我国的、有特色的短缺药品保障程序指南,使得我国的短缺药品处理机制也有一定的法律依据。
3.3 设立我国药品短缺专门管理机构我国现阶段的药品短缺问题没有一个机构进行全面管理,而是分散在各个不同的部门,每个部门根据自己的职责所在,管理属于自己管辖范围内出现的问题,这种处理方式是不连贯、相互之间没有联系的,不能从根本出发,只能解决表面的问题。因此,我国可以借鉴美国的做法,设立一个专门机构,负责药品短缺的各项事务,包括政策法规的制定、短缺信息的收集反馈、各个责任部门的协调以及具体的处理程序等,从而有效彻底地解决我国药品短缺问题。
3.4 建立我国药品短缺信息监测制度美国的药品短缺的应对是以短缺信息的上报为基础的,他们之所以能够提前发现、及时处理,也是因为有短缺信息的告知。因此,我国也可以建立一个药品短缺信息的监测制度,实时动态地监测药品短缺信息变化,同时,做到在各个药品利益相关者之间及时地传递信息,做到透明无误地将信息反馈给社会大众,从而避免信息不对称导致的药品短缺处理滞后。
3.5 加强与药品生产企业的联系药品生产问题是导致药品短缺的重要原因,紧密联系生产企业能够在第一环生产端获取详尽的信息。必要时,我国可以效仿美国,直接深入生产企业,进行实地考察从而摸清药品可能短缺或已经短缺的根本原因。在药品短缺的补救阶段,也可以派遣相关专业人员进入企业,与企业一同致力于生产问题的解决。
3.6 建立我国药品短缺评价体系和预警制度在美国已有的医疗必需性、临床可替代性等指标的基础上,我国可以借鉴并再多选择其他方面的药品短缺评价指标,按照科学的方法进行评价,从而划分药品短缺的不同情况,以及短缺的严重程度,在处理时可以根据轻重缓急区别对待。同时,也结合风险评判,建立药品短缺预警制度,在短缺可能发生时提前做好准备。
| [1] |
Kaakeh R, Sweet BV, Reilly C, et al. Impact of Drug Shortages on U.S. Health-systems[J]. Health-SystPharm, 2011, 68(19): 1811-1819. |
| [2] |
Paul Le, Enrique Seoane-Vazquez. The Prevalence of Pharmaceutical Shortage in the US[J]. Journal of Generic Medicines, 2011, 8(4): 210-218. DOI:10.1177/1741134311428105 |
| [3] |
FDA. Third Annual Report on Drug Shortages[EB/OL].(2015-09-30)[2016-11-01].http://www.fda.gov/downloads/Drugs/DrugSafety/DrugShortages/UCM488353.pdf.
|
| [4] |
杨悦, 黄果, 初智铭, 等. 美国处理药品短缺问题的经验及其对我国的启示[J]. 中国药房, 2008(28): 2173-2176. |
| [5] |
Stino M, McGhan WF. Shortages in the American Medical Drug Market[J]. Value in Health, 2009(12): A239. |
| [6] |
姚立新, GarthBoehm, 郑强. 美国药品短缺及FDA采取的应对策略[J]. 中国新药杂志, 2012(20): 2359-2367. |
| [7] |
宋雅梅. 美国药品短缺相关法规、指南及其对我国的启示[J]. 中国医院药学杂志, 2012(11): 890-893. |
| [8] |
Devi Sharmila. US Drug Shortages Could Continue for Years[J]. The Lancet, 2012, 379(9820): 990-991. DOI:10.1016/S0140-6736(12)60414-0 |
| [9] |
王志刚, 田侃, 喻小勇. 美国FDA药物短缺应对策略及其对我国的启示[J]. 医学争鸣, 2016(3): 50-53. |
| [10] |
House of Representatives of the United States and Senate. Food and Drug Administration Safety and Innovation Act[EB/OL].(2012-07-09)[2016-11-01].https://www.gpo.gov/fdsys/pkg/PLAW-112publ144/pdf/PLAW-112publ144.pdf.
|
| [11] |
FDA. Manual of Policies and Procedures (MAPP)4091.1[EB/OL].(2014-09-03)[2016-11-01].http://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/ManualofPoliciesProcedures/UCM079936.pdf.
|
| [12] |
FDA. Drug Shortages Database[EB/OL].[2016-11-01].http://www.fda.gov/Drugs/DrugSafety/DrugShortages/default.htm.
|
| [13] |
FDA. How to Report a Shortage or Supply Issue[EB/OL].(2016-07)[2016-11-01]. http://www.fda.gov/Drugs/DrugSafety/DrugShortages/ucm142398.htm.
|
| [14] |
The White House. Executive Order 13588——Reducing Prescription Drug Shortages[EB/OL].(2011-10-31)[2016-11-01].https://www.whitehouse.gov/the-pressoffice/2011/10/31/executive-order-13588-reducingprescription-drug-shortages.
|
| [15] |
U.S. Government Publishing Office. The Interim Final Rule[EB/OL].[2016-11-01].https://www.gpo.gov/fdsys/pkg/FR-2015-0708/pdf/2015-16659.pdf.
|
| [16] |
FDA. Permanent Discontinuance or Interruption in Manufacturing of Certain Drug or Biological Products[EB/OL].(2015-09-08)[2016-11-01].https://www.federalregister.gov/documents/2015/07/08/2015-16659/permanent-discontinuance-or-interruption-inmanufacturing-of-certain-drug-or-biological-products.
|
| [17] |
FDA. Strategic Plan for Preventing and Mitigating Drug Shortages[EB/OL].(2013-10)[2016-11-01].http://www.fda.gov/downloads/Drugs/DrugSafety/DrugShortages/UCM372566.pdf
|
 2017, Vol. 31
2017, Vol. 31 
