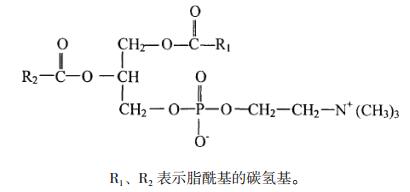
磷脂通常指甘油磷脂,常作为乳化剂用于药物制剂中,根据与3位磷酸侧链相连的X基团不同,可分为磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰丝氨酸等等,其中磷脂酰胆碱(结构通式见图 1)为其主要成分。磷脂酰胆碱根据来源不同,可分为大豆磷脂酰胆碱、蛋黄磷脂酰胆碱等。不同来源磷脂酰胆碱中甘油1, 2位的脂肪酸链组成不同,蛋黄磷脂酰胆碱脂肪酸链(R1,R2)大多为棕榈酸、油酸,其次为硬脂酸、亚油酸等;大豆磷脂酰胆碱中脂肪酸链(R1,R2)大多为亚油酸,约占50%,几乎不含C20以上的脂肪酸[1]。
|
图 1 磷脂酰胆碱通式 |
《中国药典》在2010年版已收载大豆磷脂和蛋黄卵磷脂标准,并先于其他各国对磷脂各成分含量进行控制,同时研制磷脂对照品。本研究建立了大豆磷脂酰胆碱和蛋黄磷脂酰胆碱对照品含量分析方法,并详述了磷脂酰胆碱对照品的研制过程。
1 仪器与试药安捷伦高效液相色谱仪(ELSD检测器);电子天平(Mettler Toledo,型号:XS205);卡氏水分测定仪(Mettler Toledo,型号:DL131);红外光谱仪(PE Spectrum 100红外光谱仪);质谱仪(QTRAPLC/MS/MS system,美国Sciex公司);核磁共振仪(Mereury plus 400NB Varian)。
三氯甲烷(分析纯,北京化工厂);甲醇(分析纯,北京化工厂);无水甲醇(分析纯,北京化工厂);正己烷(色谱纯,Thermo FisherScientific化学试剂公司);异丙醇(色谱纯,Thermo Fisher Scientific化学试剂公司);甲醇(色谱纯,Thermo Fisher Scientific化学试剂公司);大豆磷脂酰胆碱(批号:790622,北京欧亚康桥商贸有限公司);蛋黄磷脂酰胆碱(批号:EL9005,上海艾韦特医药科技有限公司);磷脂酰乙醇胺(批号:RHI-MD051,上海艾韦特医药科技有限公司);磷脂酰肌醇(批号:069K5202,SIGMA);鞘磷脂(批号:0002,上海艾韦特医药科技有限公司);溶血磷脂酰胆碱(批号:190025-201001,上海艾韦特医药科技有限公司);溶血磷脂酰乙醇胺(批号:RJE-SS241,上海艾韦特医药科技有限公司)。
2 方法 2.1 红外光谱取样品适量,溶于乙醇中,涂于溴化钾片上,采用红外光谱仪在4000~450 cm-1波长范围内扫描。
2.2 质谱取样品适量,溶于三氯甲烷-甲醇(2︰1)溶液中,作为供试品溶液。采用电喷雾离子化质谱在10~1000的质量范围内进行扫描。
2.3 核磁共振取样品适量,溶于氘代氯仿中,作为供试品溶液。采用400 MHz核磁共振仪扫描1H谱和13C谱。
2.4 水分测定按照《中国药典》2015年版水分测定法(通则0832第一法1容量滴定法),以三氯甲烷-无水甲醇(2︰1)为溶剂,测定7种对照物质原料的水分含量。
2.5 纯度测定采用Alltima Sillica硅胶柱(250 mm×4.6 mm×5 μm)为色谱柱,以甲醇-水-冰醋酸-三乙胺(85︰15︰0.45︰0.05,v/v)为流动相A,以正己烷-异丙醇-流动相A(20︰48︰32,v/v)为流动相B,按表 1进行梯度洗脱,流速:1 mL·min-1,柱温为40 ℃,采用蒸发光散射检测器(参考条件:漂移管温度为72 ℃;载气流量为每分钟2.0 mL)。
|
|
表 1 梯度洗脱程序 |
精密称取大豆磷脂酰胆碱适量,加三氯甲烷-无水甲醇(2︰1)溶解,并稀释制成每毫升含大豆磷脂酰胆碱50、100、150、200、300、400μg的自身对照溶液,取20μL进样,作标准曲线。另精密称取大豆磷脂酰胆碱适量,置容量瓶中,加三氯甲烷-无水甲醇(2︰1)溶解,并稀释成每毫升含大豆磷脂酰胆碱50 mg的供试品溶液,取20μL进样,测定杂质含量,计算大豆磷脂酰胆碱纯度。
称取磷脂酰乙醇胺、磷脂酰肌醇、溶血磷脂酰乙醇胺、磷脂酰胆碱、鞘磷脂、溶血磷脂酰胆碱对照品适量,加三氯甲烷-无水甲醇(2︰1)溶解稀释至一定浓度,作为系统适应性溶液,取20μL进样,各峰间的分离度均符合要求,磷脂酰胆碱色谱峰理论塔板数大于1500。另精密称取蛋黄磷脂酰胆碱0.15 g,置25 mL容量瓶中,加三氯甲烷-甲醇(2︰1)溶解并稀释至刻度,作为供试品溶液。以保留时间确定杂质成分为胆固醇、鞘磷脂。取胆固醇、鞘磷脂对照品配制成浓度范围均为50~400μg·mL-1的标准曲线溶液。分别取供试品溶液和标准曲线溶液各20μL进样分析。
3 结果 3.1 大豆磷脂酰胆碱 3.1.1 红外光谱测定值(cm-1):2924,2854,1738,1466,1247,1091;文献值[2](cm-1):2925,2854,1739,1466,1230,1070。测定值与文献值基本一致。
3.1.2 质谱测定值(m/z):782.7为[PC-36∶4]峰,784.7为[PC-36∶3]峰,786.7为[PC-36∶2]峰,758.8为[PC-34∶2]峰。由图谱可知,分子类型为[PC-36∶4]和[PC-34∶2]的磷脂酰胆碱含量较大。文献值[3-4](m/z):782.6为[PC-36∶4]峰,784.7为[PC-36∶3]峰,786.7为[PC-36∶2],758.7为[PC-34∶2]峰。测定值与文献值基本一致。
3.1.3 核磁1)氢谱
测定值:5.29,4.39,4.22,4.12,3.94,3.60,3.17 ppm;文献值[5-6]:5.20,4.40,4.31,4.13,3.94,3.83,3.39 ppm。测定值与文献值基本一致。
2)碳谱
测定值:174.80,174.50,71.83,71.74,67.45,64.89,64.84,63.687,60.48,60.44,54.68 ppm;文献值[5-6]:173.55,173.19,70.62,70.55,66.34,63.36,63.32,63.03,59.37,59.32,54.36 ppm。测定值与文献值基本一致。
3.1.4 水分大豆磷脂酰胆碱水分测定结果为2.2%。
3.1.5 金属离子采用ICP-MS测定本品18种金属离子总含量,结果为0.03%。
3.1.6 纯度大豆磷脂酰胆碱标准曲线为lgA=1.446lgC-0.410(r=0.9996),用标准曲线计算供试品中杂质含量,以100%扣除杂质含量,得到大豆磷脂酰胆碱纯度,结果为99.3%,色谱图见图 2。
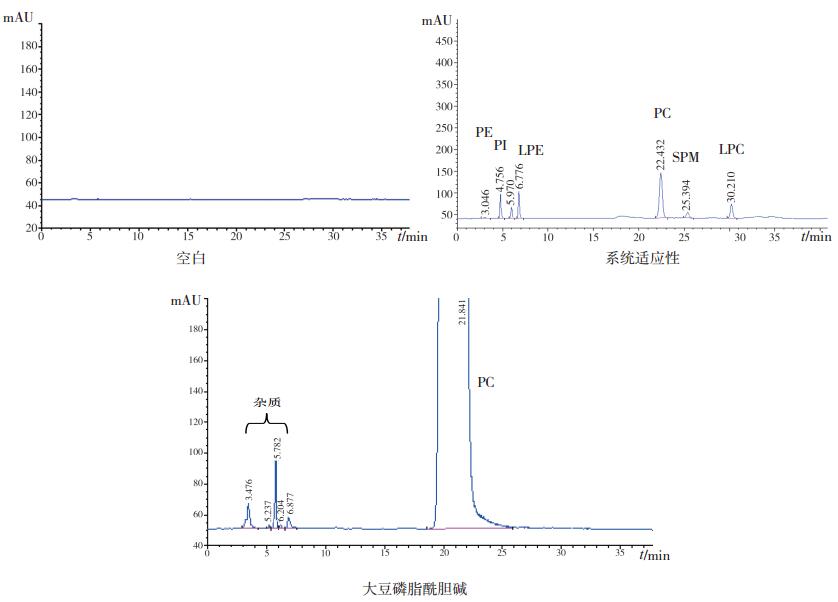
|
图 2 大豆磷脂酰胆碱纯度测定 |
以质量平衡法计算本品含量:
大豆磷脂酰胆碱含量=(100%-水分-金属离子)×HPLC纯度(自身对照法)=(100%-2.2%-0.03%)×99.3%=97.1%
3.2 蛋黄磷脂酰胆碱 3.2.1 红外光谱测定值(cm-1):3010,2923,2853,1736,1467,1378,1247,1171,1091,968;文献值[7](cm -1):3011,2924,2852,1737,1467,1381,1240,1174,1090,970。测定值与文献值基本一致。
3.2.2 质谱测定值(m/z):760.6为[PC-16∶0/18∶1+H]+峰,782.6为[PC-18∶2/18∶2+H]+峰,786.6为[PC-18∶0/18∶2+H]+峰,810.6为[PC-18∶0/20∶4+H]+峰。由图谱可知,分子类型为[PC-16∶0/18∶1]的磷脂酰胆碱含量较大,测定结果与文献报道相符[8-9]。
3.2.3 核磁1)氢谱测定值:5.21,4.37,4.15,4.12,3.99,3.89,3.39 ppm;文献值[5-6]:5.20,4.40,4.31,4.13,3.94,3.83,3.39 ppm。测定值与文献值基本一致。
2)碳谱测定值:173.54,173.15,70.29,66.28,63.69,62.78,59.60,54.50 ppm;文献值[5-6]:173.55,173.19,70.62,66.34,63.36,63.03,59.37,54.36 ppm。测定值与文献值基本一致。
3.2.4 水分蛋黄磷脂酰胆碱水分测定结果为2.1%。
3.2.5 金属离子采用ICP-MS对本品18种金属离子总含量进行测定,结果为0.01%。
3.2.6 纯度胆固醇标准曲线为lgA=1.577lgC-0.271(r=0.9990);鞘磷脂标准曲线为lgA=1.640lgC-0.647(r=0.9985),用标准曲线计算供试品中杂质胆固醇和鞘磷脂的含量,以100%扣除杂质含量,得到蛋黄磷脂酰胆碱纯度,结果为95.6%,色谱图见图 3。

|
图 3 蛋黄磷脂酰胆碱纯度测定 |
以质量平衡法计算本品含量:蛋黄磷脂酰胆碱含量=(100%-水分-金属离子)×HPLC纯度=(100%-2.1%-0.01%)×95.6%=93.6%
4 讨论 4.1 对照品原料的选择大豆磷脂和蛋黄卵磷脂的主要成分磷脂酰胆碱是甘油1, 2位的脂肪酸链组成不同成分的混合物,考察不同来源对其色谱行为(包括保留时间和响应因子)的影响。1)取浓度相当的大豆磷脂酰胆碱、蛋黄磷脂酰胆碱连续进样(n=6)后,对2组保留时间作双侧t-检验(α=0.01),结果无显著性差异。即来源不同的磷脂酰胆碱保留时间无显著性差异。2)分别选用sigma公司已知纯度的大豆磷脂酰胆碱和蛋黄磷脂酰胆碱制作相同浓度范围为63~509μg·mL-1的标准曲线,结果分别为lgA=1.446lgC-0.410(r=0.9996),lgA=1.382lgC-0.257(r=0.9990),采用这2条标准曲线对同一批磷脂进行含量测定,测定结果相差30%。故须分别研制大豆来源和蛋黄来源的磷脂酰胆碱对照品,分别用于大豆磷脂和蛋黄卵磷脂的含量测定。
4.2 结构确证 4.2.1 红外光谱天然大豆磷脂酰胆碱和蛋黄磷脂酰胆碱是由脂肪酸链组成不同的磷脂酰胆碱分子形成的混合物,但其基本结构一致,都是由甘油骨架、脂肪酸链、磷酸基团和胆碱组成,因此在红外图谱解析中,不论脂肪酸链如何变化(碳链长短、不饱和键的数量),一些固定的特征吸收峰不会变。如3013 cm-1为胆碱头基CH3伸缩振动吸收峰[10],3011 cm -1为脂肪酸链中HC=伸缩振动吸收峰,2924 cm-1为脂肪酸链上CH2不对称伸缩振动吸收峰,2852 cm-1为脂肪酸链上CH2对称伸缩振动吸收峰,1738~1740 cm-1为C=O伸缩振动吸收峰,1465~1467 cm-1为脂肪酸链上CH2弯曲振动吸收峰,1378~1381 cm-1为脂肪酸链上CH3弯曲振动吸收峰[11-12],1200~1250 cm-1为P=O伸缩振动吸收峰[13],1174~1197 cm-1为C-O不对称伸缩振动吸收峰,1084~1090 cm-1为PO2-不对称伸缩振动吸收峰。大豆磷脂酰胆碱和蛋黄磷脂酰胆碱均具有上述特征吸收峰,可以确证基本骨架结构。
4.2.2 质谱和核磁对于混合物,核磁只能确证其骨架结构,可作为红外的佐证。磷脂酰胆碱脱去一条脂肪酸链变为溶血磷脂酰胆碱,红外光谱和核磁共振不能对两者进行区分,质谱刚好填补了这个空白。有文献报道,采用电喷雾电离质谱进行磷脂酰胆碱分子类型的分析[14-15],但经电离,磷脂酰胆碱分子中脂肪酸链易断裂,生成游离的脂肪酸碎片,使得磷脂酰胆碱与溶血磷脂酰胆碱难以辨别。因此,本研究采用高分辨电喷雾飞行时间质谱,使整个分子带电荷,对混合物中不同分子类型进行有效确证。
4.3 纯度测定方法的选择大豆磷脂酰胆碱采用自身对照法测定纯度,即以大豆磷脂酰胆碱做标准曲线,测定杂质含量,以100%扣除杂质含量得到纯度。由于大豆磷脂酰胆碱纯度高于99.0%,采用此法引入的误差在可接受的范围内。但蛋黄磷脂酰胆碱纯度低于99.0%,以自身作对照测定杂质,测定纯度为90.1%,由于响应因子的差异,测定纯度误差较大。如先确定杂质成分,再以相应成分的对照品做标准曲线测定杂质含量,继而再以100%扣除杂质得到纯度,结果为95.6%。因此,本研究采用后一种方法作为蛋黄卵磷脂纯度的测定方法。
| [1] |
龚雁, 王巧娥, 杨屹, 等. 高效液相色谱-蒸发光散射检测法测定蛋黄卵磷脂的含量[J]. 色谱, 2006, 24(4): 373-375. |
| [2] |
刘安军. 猪脑中磷脂的提取及鉴定分析[J]. 现代食品科技, 2008, 24(10): 999-1001. |
| [3] |
粘慧青, 周瑢, 杨博, 等. 高分辨率电喷雾电离飞行时间质谱仪测定大豆磷脂中磷脂酰胆碱[J]. 分析仪器, 2007(4): 48-51. |
| [4] |
Schiller J, Süß R, Arnhold J, et al. Matrix-assisted Laser Desorption and Ionization Time-of-flight (MALDI-TOF) Mass Spectrometry in Lipid and Phospholipid Research[J]. Prog Lipid Res, 2004, 43(5): 449-488. DOI:10.1016/j.plipres.2004.08.001 |
| [5] |
National Institute of Advanced Industrial Science and Technology (AIST). Spectral Database for Organic Compounds:SDBS[EB/OL].[2016-12-20] http://sdbs.db.aist.go.jp.
|
| [6] |
FABIAN LE Ä ON, MAURITS VAN BOVEN, PETER DE WITTE, et al. Isolation and Identification of Molecular Species of Phosphatidylcholine and Lysophosphatidylcholine from Jojoba Seed Meal:Simmondsia Chinensis[J]. J Agric Food Chem, 2004, 52(5): 1207-1211. DOI:10.1021/jf035296h |
| [7] |
Sun Y.C, Kwan H.C. Infrared and Time-resolved Fluorescence Spectroscopic Studies of the Polymorphic Phase Behavior of Phophatidlyethanolamine/Diacylglycerol Lipid Mixtures[J]. Chemistry and Physics of Lipids, 1990, 56(2): 149-158. |
| [8] |
李国琛, 王颜红, 吴仁安, 等. HPLC与MALDI-TOF M S联用技术分析蛋黄中的磷脂[J]. 分析试验室, 2009, 28(4): 30-33. |
| [9] |
Fuchs B1, Süss R, Schiller J. An Update of MALDI-TOF Mass Spectrometry in Lipid Research[J]. Prog Lipid Res, 2010, 49(4): 450-75. DOI:10.1016/j.plipres.2010.07.001 |
| [10] |
Jeffrey E.F, Donald F.H.W.. Structural Differences among Phosphatidylcholine, Phosohatidylethanolamine, and Mixed Phosphatidylcholine/Phosohatidylethanolamine Multilayers:An Infrared Absorption Study[J]. Archives of Biochemistry and Biophysics, 1978, 189(1): 195-204. DOI:10.1016/0003-9861(78)90132-7 |
| [11] |
Isabell D, Susanne M, Reiner S, et al. Quantification of Brain Lipids by FTIR Spectroscopy and Partial Least Squares Regression[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2009, 71(5): 2069-2075. DOI:10.1016/j.saa.2008.08.008 |
| [12] |
Grdadolnik J, Hadzi D. FT Infrared and Raman Investigation of Saccharide-phosphatidylcholine Interactions using Novel Structure Probes[J]. Spectrochim Acta A Mol Biomol Spectrosc, 1998, 54(12): 1989-2000. DOI:10.1016/S1386-1425(98)00111-5 |
| [13] |
Y. KIMURA, NAGAI. Infrared Spectra of Brain Phosphatidylserine[J]. Biochem J, 1960, 77(10): 3-4. |
| [14] |
曹栋, 裘爱泳, 王兴国. 大豆磷脂酰胆碱分子类型的研究[J]. 中国油脂, 2003, 28(12): 49-52. DOI:10.3321/j.issn:1003-7969.2003.12.017 |
| [15] |
Beate Fuchs, Rosmarie Süß, Jürgen Schiller. An Update of MALDI-TOF Mass Spectrometry in Lipid Research[J]. Progress in Lipid Research, 2010, 49(4): 450-475. DOI:10.1016/j.plipres.2010.07.001 |
 2017, Vol. 31
2017, Vol. 31 