人血白蛋白是由健康人血浆经过低温乙醇蛋白分离法或其他方法分离纯化得到的血液制品,具有调节胶体渗透压、补充血浆蛋白损失等作用。依据《中国药典》2015年版三部和其他经批准的国家药品标准,人血白蛋白中蛋白质含量作为关键质量指标,其结果必须符合相关要求[1]。同时,人血白蛋白的蛋白质含量应按照《中国药典》2015年版四部通则0731第一法,即凯式定氮法测定[2]。作为产品出厂放行以及批签发检验的必检项目,人血白蛋白的蛋白质含量测定结果直接影响最终报告的准确性和公正性。
为加强人血白蛋白的质量控制,了解和评价相关检测实验室对人血白蛋白采用凯式定氮法测定蛋白含量的技术状况,依照ISO/IEC17043:2010《合格评定能力验证的通用要求》及中国合格评定国家认可委员会的相关要求[3],起草了人血白蛋白的蛋白质含量测定(凯式定氮法)检测能力验证计划方案,并组织实施此次能力验证活动。
1 能力验证样品的制备与标定 1.1 样品来源能力验证样品为注册检验合格的人血白蛋白产品(规格20%,50 mL/瓶),共200瓶,在无菌条件下合并、除菌过滤后,进行分装,分装装量为3.0 mL/支,液体剂型。蛋白质含量能力验证之前已经经过11家实验室的协作标定,返回的12组数据经统计分析(测定总次数N=80)后,确立本次能力验证样品指定值为(193.30±5.08)g·L-1(即Mean±2SD)[4]。实施能力验证时,参加者对样品指定值未知,且样品被重新编盲后发放。
1.2 样品均匀性、稳定性 1.2.1 样品的均匀性该批样品平均装量为3.0 mL/支,液体剂型。均匀性的考察以生产过程中分装误差作为依据,能力验证用样品的分装误差RSD为0.55%。
1.2.2 样品的稳定性监测制备后的样品按规定存放于2~8 ℃,并进行定期及不定期的稳定性监测,数据被归类进行趋势分析,监测结果见图 1。
能力验证用样品分装制备日期为2014年5月,由图 1的趋势图可见,自样品制备后截止到本次能力验证发样前的稳定性监测区间内,该样品的蛋白质含量未出现上升或下降趋势,测定值在(193.30±5.08)g·L-1(即Mean±2SD)范围内波动,未发生趋势性变化。证实该样品稳定性良好,符合相关要求[5],可以作为能力验证用样品进行分发。

|
图 1 人血白蛋白能力验证用样品长期稳定性监测及趋势分析 |
全国共13家实验室报名参加本次能力验证计划。其行业和地域分布见表 1,参加者包含所有的7个血液制品批签发授权药检所、总后勤部药品检验所、5家血液制品企业。
|
|
表 1 参加能力验证计划实验室地域和行业分布 |
中国食品药品检定研究院血液制品室统一制定并发放了《人血白蛋白蛋白质含量测定(凯式定氮法)检测能力验证作业指导书》,各实验室参照执行并按各实验室日常检验程序和方法,对能力验证样品进行测定。方案的实施依据为ISO17043。由血液制品室向每个参加能力验证的实验室分发6支人血白蛋白样品,要求必须依据《中国药典》2015年版三部人血白蛋白各论以及通则0731第一法进行测定,具体操作可按照各自实验室的检测SOP进行。返回3次独立有效测定结果,可以依据各实验室自身的设备情况采用手工法、半自动凯式定氮仪或全自动凯式定氮仪等方式开展该试验。返回的实验结果按照ISO和中国合格评定国家认可委员会的相关规定进行分析[6-7]。每个参加者均有一个实验室代码。参加者的检测结果、能力评价均以代码表示。
4 评价准则与结果统计每个参加的实验室返回3次独立实验数据,所有结果由中国食品药品检定研究院血液制品室整理并选择适合的统计学方法进行分析[8-9]。采用软件计算各实验室内结果平均值、标准差SD、相对标准偏差RSD,并与能力验证样品指定值及其参考范围进行比较。当返回结果超过3个时,随机选取3个检测数据参加评价。
4.1 结果评价的准则各实验室结果室内RSD应在2.0%以内,超过2.0 %直接评价为不满意。实验室结果均值与验证计划用样品指定值(蛋白质含量均值193.30 g·L-1)进行比较,并按以下评价准则判定:
1)当实验室结果均值位于(193.30±2.54)g·L-1(Mean±SD),即|193.30-实验室结果均值|≤2.54,判定为优秀。
2)当实验室结果均值位于(1 9 3.3 0+2.54)g·L-1(Mean+SD)至(193.30+5.08)(Mean+2SD),或实验室结果均值位于(193.30-2.54)g·L-1(Mean-SD)至(193.30-5.08)g·L-1(Mean-2SD),即2.54<|193.30-实验室均值|<5.08,判定为合格。
3)当实验室结果均值位于(193.30±5.08)g·L-1(Mean±2SD)以外,即|193.30-实验室均值|≥5.08,判定为不满意。
优秀和合格归类为满意。
4.2 检测结果统计参加本次能力验证的实验室共计13家,按照“4.1”节的结果评价准则,本次能力验证10家实验室为优秀,1家实验室为合格,2家实验室为不满意。整体满意率为84.6%,优秀率76.9%,不合格率15.4%。具体数据汇总见表 2。
|
|
表 2 人血白蛋白蛋白质含量测定能力验证结果及评价 |
本次参加能力验证的13家实验室中,有11家实验室使用全自动凯氏定氮仪,1家实验室使用半自动定氮仪,1家实验室使用手工法进行凯式定氮。本次能力验证测定结果总体均值为193.51g·L-1(Min 188.58 g·L-1,Max 200.70 g·L-1,N=39),实验室间标准差总体均值为0.39,实验室间相对标准偏差RSD为0.20%。各实验室结果总体均值RSD均小于2.0%。总体均值与前期标定的人血白蛋白国家参考品的参考值193.30 g·L-1(N=80)的差值仅为0.21,也证明了2次标定总体均值一致性良好。本次参加能力验证的13家实验室测定结果汇总分析见图 2。
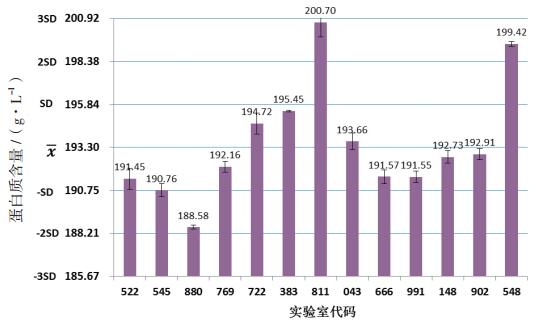
|
图 2 参加能力验证的 13 家实验室结果分析图 |
由图 2可见:共有2家实验室(代码811、548)结果位于2SD~3SD,结论为不满意;有1家实验室(代码880)结果位于-SD~-2SD,结论为合格;其余10家实验室结果位于193.30±SD,结论为优秀。
4.3 问题与讨论从本次能力验证返回的试验报告来看,有部分实验室在同一日期测定样品,没有理解作业指导书中要求返回3次独立实验结果的意义。应至少在不同日期对样品进行测定,或由不同的人员操作,考量不同批次试剂配制等重现性因素,以求涵盖尽可能多的实验误差,并非指在同一天将所有样品平行测完。
凯氏定氮法测定人血白蛋白中蛋白质含量为《中国药典》2015年版三部通则规定的法定检测方法,从本次能力验证统计结果来看,7家血液制品批签发授权药检机构人血白蛋白蛋白质含量测定能力验证结果均为优秀;有2家非批签发单位实验室本次能力验证结果为不满意。在通常情况下,影响能力验证结果的因素为仪器设备、人员操作、标准品、实验试剂等等[10-11],单位自身应按照能力验证要求进行调查并彻底纠正或消除引起偏差的因素。
本次能力验证为在血液制品行业内的首次能力评价,建议血液制品企业、授权批签发药品检验机构及其他相关单位积极参与中国食品药品检定研究院组织实施的能力验证,并通过参加能力验证进一步熟悉检测和校准实验室能力的通用要求[12],对本实验室检验检测结果的准确性和可靠性进行自我评价,及早消除潜在的偏差因素,加强实验室检测质量控制,提高能力验证结果的满意水平[13]。从而更好地推动血液制品的质量控制工作,提高我国血液制品检验检测实验室的技术能力和整体水平。
| [1] |
中国药典:三部[S]. 2015:244-246.
|
| [2] |
中国药典:四部[S]. 2015:96.
|
| [3] |
中国合格评定国家认可委员会. CNAS-RL02:2016能力验证规则[EB/OL].[2016-04-19].https://www.cnas.org.cn/fwzl/nlyzzl/nlyzxgzcyzl/875650.shtml.
|
| [4] |
王敏力, 肖林, 周倩, 等. 首批人血白蛋白国家参考品的研制[J]. 中国药学杂志, 2017, 25(6): 51-59. |
| [5] |
中国合格评定国家认可委员会. CNAS-GL03:2006能力验证样品均匀性和稳定性评价指南[EB/OL].[2015-06-01].https://www.cnas.org.cn/images/rkgf/sysrk/rkzn/2015/06/04/E1A627B34D54D56D0CD50057BAE71B57.pdf.
|
| [6] |
International Organization for Standardization. ISO 13528 Statistical Methods for Use in Proficiency Testing by Interlaboratory Comparisons[S]. 2005.
|
| [7] |
中国合格评定国家认可委员会. CNAS-GL02:2014能力验证结果的统计处理和能力评价指南[EB/OL].[2014-09-29]. https://www.cnas.org.cn/rkgf/sysrk/rkzn/2014/09/821333.shtml.
|
| [8] |
吴婷, 杨文凤, 张慧文. 实验室间比对结果统计方法的探讨[J]. 中国药学杂志, 2016, 51(2): 135-138. |
| [9] |
李晶, 项新华, 张河战. 实验室比对统计分析方法的比较[J]. 中国药学杂志, 2016, 51(2): 139-143. |
| [10] |
毛燕, 陈立群, 陈颖, 等. 常见能力验证结果影响因素分析[J]. 现代测量与实验室管理, 2016(4): 49-50. |
| [11] |
周崇粲, 张雷. 常见能力验证不满意结果原因分析及对策[J]. 现代测量与实验室管理, 2013(3): 38-39. |
| [12] |
ISO/IEC 17025:2005 Accreditation Criteria for the Competence of Testing and Calibration Laboratories[S]. 2005.
|
| [13] |
毛燕, 闫林. 实验室参加能力验证活动的意义分析[J]. 食品安全质量检测学报, 2014(9): 2958-2961. |
 2017, Vol. 31
2017, Vol. 31 
