20世纪80年代,伴随我国医疗器械产业的出现,行政监管体系开始逐步建立。1998年药品监督管理体制开始改革,医疗器械作为改革的一个重要组成部分,开始逐渐形成规范的、全面的管理体系。2000年颁布实施的《医疗器械监督管理条例》 [1],以及2014年修订的《医疗器械监督管理条例》 [2],成为医疗器械监督管理的法律基石,构建了我国医疗器械监督管理的法规体系,形成了行政监管和技术监管相辅相成的管理模式,明确了技术监管职能主要由检验机构承担。我国医疗器械检验机构主要是由各级政府设立的,服务于政府相关监管职能,主要承担医疗器械产品在我国上市前的注册检验、上市后的监督抽验以及医疗器械监管、医疗器械标准化等相关技术支撑工作。
目前,我国处于产业革命和技术创新的历史机遇期,我国的医疗器械体系同样面临发展的黄金时期。本文分析了医疗器械检验体系现状,并对体系发展提出几点思考。
1 医疗器械检验体系发展历程20世纪90年代,国家药品监督管理局(以下简称“国家局”)为了整合技术监管力量,通过行政发文认可了10家医疗器械检验机构的依法检验资质,并加挂了“国家药品监督管理局医疗器械质量监督检验中心”的牌子(以下简称“十大中心”),详见表 1。鉴于医疗器械组成复杂、专业性强、涉及学科门类广的特点,结合当时我国整体的检验检测能力,国家局支持“十大中心”各自发展其优势的医疗器械检验领域,形成专项布局、各具特色的模式[3]。
|
|
表 1 “十大中心”名称和所在地信息表 |
“十大中心”是由政府设立的、服务于政府监管的技术部门,经过政府行政授权,主要承担着三项职能:一是医疗器械产品上市前的注册检验职能。依照我国医疗器械注册管理要求,医疗器械产品上市前需在有资质的检验机构进行注册检验。二是医疗器械产品上市后的监督抽验职能。各级政府监管部门委托检验机构,对生产、流通和使用各环节的医疗器械进行监督抽验,以期及时发现和解决医疗器械产品上市后可能出现的问题。三是医疗器械标准化职能。我国的医疗器械标准化技术委员会全部挂靠在“十大中心”内部,承担着医疗器材产品标准的制修订职责。为了适应我国医疗器械产业规模的扩大,“十大中心”加快发展并取得了长足进步,检验业务量不断提高,通过承担国家医疗器械标准化技术委员会工作使得国际影响力不断提升。
2003年,我国医疗器械产业呈现快速发展的趋势,为了进一步加强医疗器械检验能力,国家局出台了《医疗器械检验机构资格认可办法(试行)》 [4](以下简称《办法》)。依照《办法》,国家局逐渐认可了一批药品检验系统内和系统外的检验机构,使得检验体系得到扩充,检验力量得到加强。特别是全国各省级检验机构的建立,结合先期发展的“十大中心”,成为了日后医疗器械检验机构国家级、省级两级体系的基础。除国家级、省级检验机构外,其他省级或副省级医疗器械检验机构名称和所属省份信息见表 2。
|
|
表 2 其他省级或副省级医疗器械检验机构名称和所在地信息表 |
省级检验机构的建立和发展,是我国医疗器械检验事业发展的必然结果。随着我国医疗器械产业的进一步发展,各省级监管部门成立了省级医疗器械检验机构,主要承担省内医疗器械上市前的注册检验和上市后的监督抽验职责。省级机构的规模和检验能力适应本省的医疗器械产业规模,比如江苏、浙江和广东省的生产企业数量众多、规模较大,省级检验机构建立了分支机构来承担检验职能以满足监管需要。产业规模相对较少的省份,国家也会通过专项扶持,不断提升省级检验机构的检验能力。
2014年,国务院办公厅转发中央编办质检总局《关于整合检验检测认证机构实施意见的通知》 [5],意在深入贯彻落实党的十八大、十八届二中和三中全会精神及《国务院机构改革和职能转变方案》 [6]的要求,推进业务相同或相近的检验、检测、认证机构的整合。由此,医疗器械检验检测体系正在经历新时期背景下的改革。
2 医疗器械检验体系的现状我国医疗器械检验体系为国家级、省级两级检验机构,检验机构的分布呈现平均分布的态势,全国各省均建立了省级检验机构,部分省级检验机构(例如广东、江苏、浙江)根据自身发展特点向下延伸建立了多个分场所。另外,自2003年国家局扩大资格认可范围后,一批药品检验系统外的检验机构获得了医疗器械检验资质,涉及卫计部门、民政部门、化工部门、高等院校等多个系统的检验机构。截至2016年初,医疗器械检验机构的数量为54家(其中53家获得资格认可)[7]。中国食品药品检定研究院(以下简称“中检院”)为国家食品药品监督管理总局直属的事业单位;各省均拥有省级检验机构,其中独立于食品药品检验机构的单位有22家,在食品药品检验机构加挂牌子的有17家;药品检验系统外的医疗器械检验机构有14家[7]。2015年全国食品药品检验检测机构统计数据显示如下。
2.1 检验能力认可数量54家医疗器械检验机构中,“十大中心”在检验能力认可数量上相对较多。其中,中检院医疗器械实验室认可项目2013年达1397项[7],居首位;其他“中心”医疗器械认可项目在400~900项[7]。受各地产业发展不均衡的影响,其他省级检验机构认可数量存在差距,部分检验机构与“十大中心”持平,但仍有部分认可数量较少。
2.2 检验人员结构54家医疗器械检验机构人员总数为4003人[7]。专门或主要从事医疗器械检验的机构为22家,人员总数为3543人:其中具有大学本科学历人员1386名,(占比39%),硕士研究生学历人员907名(占比26%),博士学位人员55人(占比2%);专业从事医疗器械检验的机构中,“十大中心”人数为1906人,占比54%。
2.3 检验实验室面积“十大中心”房屋总面积约为19.50万平方米[7],业务用房面积为6.68万平方米;其他12家专门或主要从事医疗器械检验的省级机构的房屋总面积约为8.74万平方米,业务用房面积约为2.70万平方米。“十大中心”的房屋面积是其他省级检验机构的2.2倍。
2.4 检验仪器设备条件“十大中心”拥有实验用仪器设备15070台套[7],总价值达13.6324亿元;其他12家专门或主要从事医疗器械检验的省级机构拥有实验用仪器设备6133台套,总价值3.4274亿元。“十大中心”的设备数量和价值是其他省级检验机构的2.5倍和4倍。
2.5 检验业务量医疗器械检验机构全年共发出医疗器械注册检验、计划抽验、进口检验和委托检验等各类检验报告73227份[7]:“十大中心”发出各类检验报告39344份,占比54%;12家专业或主要从事医疗器械检验的省级检验机构发出各类检验报告23769份,占比32%;17家药检系统内非主要从事医疗器械检验的机构共发出报告7045份,占比10%;系统外的14家检验机构共发出报告3069份,占比4%,且均为委托检验。
3 医疗器械检验体系呈快速发展趋势在国家政策层面,一是鼓励创新,二是明确了检验体系发展的方针和要务。《国务院关于加快科技服务业发展的若干意见》 [8]中指出,包含检验体系在内的科技服务业发展基本原则是“坚持深化改革,坚持创新驱动,坚持市场导向,坚持开放合作。”而坚持深化改革就要在制度上进行创新,坚持创新驱动要着眼于技术创新,坚持市场导向和开放合作就要在观念上打破成规,融入发展的理念。随着政策的出台,检验体系呈现了新的发展趋势。
3.1 硬件设施得到加强根据2015年的统计[7],医疗器械检验机构的房屋总面积为28.2256万平方米,相较2013年房屋总面积15.2135万平方米,增加了86%。2015年实验用仪器设备21203台套,总价值17.0598亿元;相较2013年仪器设备9934台套,总价值4.0266亿元,设备数量增加了113%,总价值增加了324%。2015年检验机构人员总数4003人,相较2013年人员总数2999人,增加了33%。由数据可以看出,随着国家加大投入,医疗器械检验机构从用房面积、装备情况和人员数量都有了很大提高。见图 1。
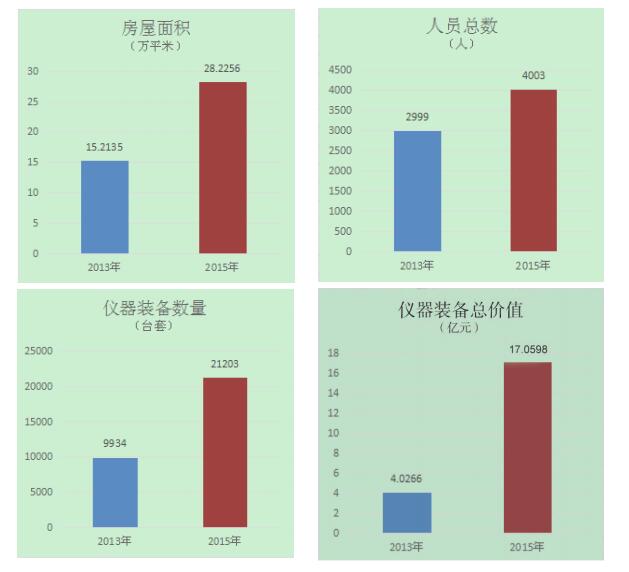
|
图 1 医疗器械检验机构2013年与2015年相关数据对比 |
检验机构规模虽然存在差距,但随着省级机构的快速发展,逐渐呈现平衡发展的趋势。在全部国家级和省级检验机构中,“十大中心”的房屋面积在2013年占比为75%,2015年占比69%;其他省级机构2013年占比25%,2015年占比31%,详见图 2。“十大中心”的人员数量2013年占比69%,2015年占比54%;其他省级机构2013年占比31%,2015年占比46%,详见图 3。“十大中心”占整体业务量:2013年占比为67%,2015年占比54%;其他省级检验机构占整体业务量2013年占比17%,2015年占比32%,详见图 4。从数据中可以看出,“十大中心”与其他省级检验机构相比在硬件设施和业务量上仍占据优势,但近年省级机构呈现强劲的追赶态势,预计在未来几年会继续减小与“十大中心”的差距,检验机构的规模和技术能力逐渐趋向均衡。
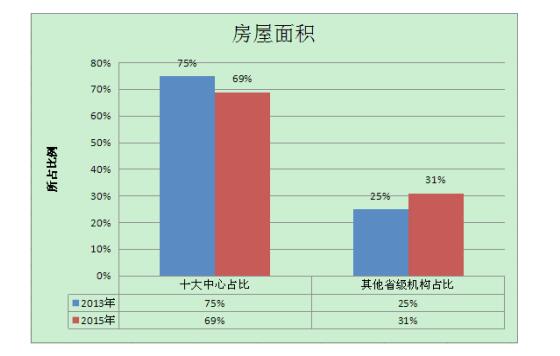
|
图 2 房屋面积2013年数据与2015年数据对比 |
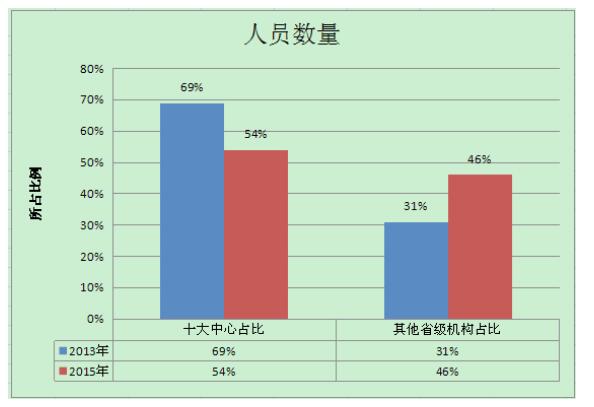
|
图 3 人员数量2013年数据与2015年数据对比 |

|
图 4 业务量2013年数据与2015年数据对比 |
在万众创新的历史时期,国家大力推动创新实现产业转型的背景下,拥有创新技术的医疗器械产品不断涌现,检验检测技术也要不断创新以满足时代的要求。笔者认为,面对新形势应做好三点:一是制度创新,二是技术创新,三是观念创新。
4.1 制度创新2014年国家食品药品监督管理总局发布了《创新医疗器械特别审批程序(试行)》(食药监械管[2014]13号)[9](以下简称《程序》)并于同年3月1日施行。该程序是针对创新医疗器械设置的审批通道。根据《程序》要求,各级相关管理部门及技术机构,按照早期介入、专人负责、科学检验和审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理。该程序是食品药品监管部门为促进医疗器械创新发展而推出的重要措施,积极推动医疗器械新技术的推广和应用,鼓励医疗器械的研究与创新。为落实总局要求,医疗器械检验机构纷纷在制度创新上下大力气。以中检院为例,立即建立了《创新医疗器械检验管理程序》及配套文件《创新医疗器械检品检验进度及审核情况表》,推出了“创新产品绿色通道”制度。新制度的施行确保了创新医疗器械的注册检验在标准不降低的前提下,检验周期平均缩短24%。得益于制度创新,深圳某公司生产的创新医疗器械脱细胞角膜基质在中检院顺利完成注册检验,并于2015年4月22日获得国家食品药品监督管理总局批准,该产品是首批按照《程序》批准注册的产品之一。
4.2 技术创新我国医疗器械检验机构的发展过程均表现出个体单位在某一个或某几个领域发展的较早较快的特点。体现在检验水平中,其个别领域检验经历的积累、人员素质和标准更新等方面的软实力等具备明显优势,从而形成了如今各检验机构发展有先后、术业有专攻的发展格局。这种格局在发展初期有其存在的必要和优势,但随着互联互通时代的到来,专业化的独占模式不利于检验事业的发展。单个检验机构的力量毕竟有限,在整个体系的框架下,通过全行业的力量才能把检验事业做大做强。因此,突破现有格局,实现知识、技术、信息的互联互通,在体系内盘活软实力,使得资源流动运转起来,形成“众人拾柴火焰高”的新局面,通过联通实现互补,通过合作推动技术创新。
4.3 观念创新相比于技术创新,观念创新更加需要智慧,更应得到关注。只有统一思想,才能统一行动,进而把检验检测事业引领到一个新的发展阶段。但是,和检验检测事业发展初期相比,如今的观念创新面临的条件发生了变化,创新已无法通过巨额的投入、不断建设新的场所等新增资源的方式进行,而是要进行资源的科学配置,通过提高效率来解决检验检测事业创新发展的问题。这就要尝试整合资源,不仅是在某一个检验机构进行整合,而是要在全系统范围进行整合。
笔者认为可以在三个方面积极尝试:一是组织新方法的实验室间比对。面对新的医疗器械产品,可以通过实验室间比对的方法,来获得新的检验方法的可靠性,统一各检验机构对方法的理解和检验操作,实现检验技术进步。二是加强标准宣贯。通过有效的、及时的宣贯,实现检验机构间的交流和相互学习。三是增加人员交流。各检验机构的检验人员通过各种方式进行交流,有利于信息和技术的互联互通,实现共同提高。
5 结语技术革新使得新产品、新技术不断涌现,面对新的检验领域和方法,我国的检验机构和国外的检验机构都站在同一个起跑线上,我国检验机构要更加认清形势才能赢取先机。战略机遇期并非仅仅属于我国医疗器械检验机构,放眼全球的检验检测领域,各大跨国检验检测集团纷纷瞄准了中国这个新兴的巨大市场。而我国检验机构要想把自己的检验事业推上新台阶,要靠前期发展的技术积累和制度准备,更要靠当今和未来敏锐的眼光和灵活的策略。
| [1] |
国务院. 国务院令第276号医疗器械监督管理条例[S]. 2000.
|
| [2] |
国务院. 国务院令第650号医疗器械监督管理条例[S]. 2014.
|
| [3] |
李海宁. 我国医疗器械检验机构的现状及发展战略研究[J]. 中国药事, 2015, 29(7): 698-701. |
| [4] |
国家食品药品监督管理局. 国药监械[2003] 125号医疗器械检验机构资格认可办法: 试行[S]. 2003.
|
| [5] |
国务院办公厅. 国办发[2014] 8号国务院办公厅转发中央编办质检总局关于整合检验检测认证机构实施意见的通知[S]. 2014.
|
| [6] |
全国人民代表大会. 十二届全国人大一次会议通过国务院机构改革和职能转变方案[S]. 2013.
|
| [7] |
中国食品药品检定研究院. 全国食品药品检验检测机构数据统计查询系统2015年统计报告[R]. 2015.
|
| [8] |
国务院. 国发[2014] 49号国务院关于加快科技服务业发展的若干意见[S]. 2014.
|
| [9] |
国家食品药品监督管理总局. 食药监械管[2014] 13号创新医疗器械特别审批程序: 试行[S]. 2014.
|
 2017, Vol. 31
2017, Vol. 31 
