药品不良反应(ADR)报告及其监测管理是医疗安全管理的基础性工作,是保障患者用药安全的重要内容。据相关资料[1]显示,我国约有250万人因药物不良反应住院,死亡约19万人,ADR发生率约占住院病人的10% ~ 30%,药源性疾病发生率呈逐渐增高的趋势。因此,加强ADR的监测及上报工作已经成为临床预防药品不良事件发生、保障临床用药安全的重要政策之一[2]。贵州省肿瘤医院在创建三级甲等专科医院的工作中,积极按照《三级肿瘤医院评审标准实施细则》(2011版)[3]的要求,严格执行ADR和用药错误报告制度,运用PDCA循环管理法对ADR监测上报工作进行干预并实施持续改进,效果显著,现将具体情况介绍如下。
1 资料来源收集我院运用PDCA循环管理方法干预前(2011年)和干预后(2012-2015年)上报至全国不良反应监测网上的有效报告,并进行统计、分析。5年上报的有效例数分别为47、171、286、417、442例。
2 研究方法PDCA循环又称“戴明环”[4],PDCA循环是在一切管理活动中,为了提高管理质量和效益所进行计划(plan,P)、实施(do,D)、检查(check,C)和处理(act,A)的循环过程,它是全面质量管理所应遵循的科学程序。
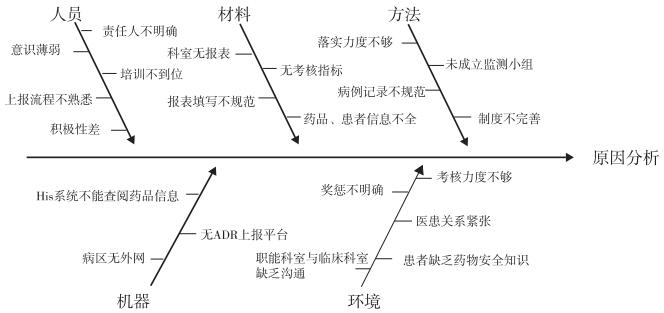
2.1 计划阶段(P) 2.1.1 调查研究对2011年ADR上报情况进行调查,发现存在的问题包括:① 整体上报率低,2011年收到的ADR报表仅57例,均来自住院患者,与国家不良反应监测中心报告的全国住院患者中有10% ~ 30%会发生ADR存在明显差异[5]。② 无效报表多,收到的57例报表中实际有效报表47例,仅占82.46%。③ 报告类型单一,均为一般的ADR,严重的ADR例数为0。④ 上报ADR的药品种类单一。⑤ 医生上报意识薄弱。
2.1.2 原因和影响因素分析① 方法:未建立ADR监测管理体系和相关制度;未将ADR上报指标计划落实到病区。
② 人员:未进行常规院内规范化培训;医护人员缺乏上报意识,对流程不熟悉,积极性差;缺乏对ADR表现的认识,尤其是隐性的ADR,如胸闷、心慌、失眠等。
③ 环境:医护人员、患者对ADR认识不够,医护人员怕引起医疗纠纷;缺乏奖惩体系;科室职责不明确,医护人员认为上报ADR是药剂科职责,与临床无关。
④ 材料:临床科室无纸质ADR报表;信息填写不规范,如缺少患者基本信息、缺少药品信息、对ADR的描述不准确、未在病程记录等。
⑤ 机器:医生工作站不能连接外网;HIS系统缺乏药品信息查询;医院无ADR上报平台等。
ADR上报数量少的原因和影响因素分析见图 1。
|
图 1 ADR上报数量少的原因和影响因素分析鱼骨图 |
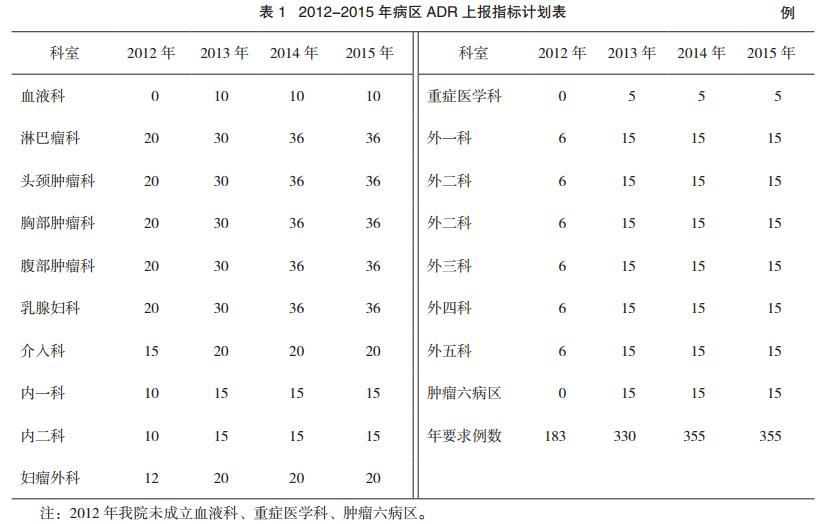
① 建立ADR监测管理体系和ADR监测小组,明确组员职责;制定2012-2015年指标计划并落实到病区,见表 1。
|
|
表 1 2012-2015年病区ADR上报指标计划表 |
|
|
表 1 2012-2015 年病区 ADR 上报指标计划表 |
② 每年2次院内规范化培训;安排临床药师下临床科室进行宣传指导,加强科室之间交流沟通,取消患者对ADR的恐惧心理,提高医护人员的积极性和主动性。
③ 设置药剂科ADR上报专员,确定病区上报联络人,明确临床科室职责,按季度分析并公示上报情况。
④ 制定重点监测药物品种:抗肿瘤药物及其辅助用药、抗感染药物、中药注射剂、血液制品等,加强对新的/严重的ADR上报的管理。
⑤ 完善HIS系统,为临床提供药品信息查询,给临床科室发放ADR报表,建立院内ADR上报平台。
⑥ 制定奖惩办法。
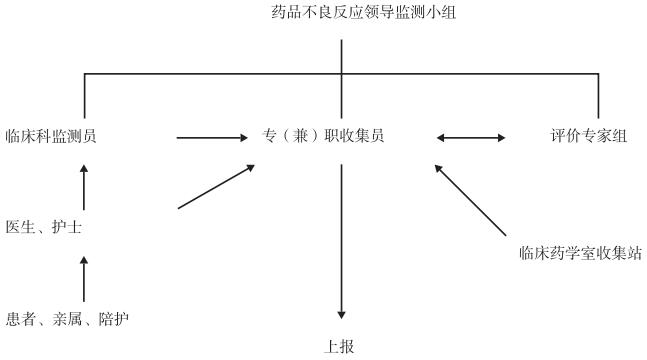
2.2 实施阶段(D) 2.2.1 制定ADR监测报告制度和ADR发生后的退药制度,建立ADR监测小组,明确岗位职责药剂科设置ADR上报专员,确定临床科室相应联络员,并在院内公示联系电话。ADR专员负责监督并收集ADR报表,认真核对病程记录的完整性,规范填写ADR报表,按规定时间统一上报国家不良反应监测中心,确保报告的真实、完整、准确、及时,保证报表质量。ADR上报流程图见图 2。
|
图 2 ADR上报流程图 |
每年进行4次ADR上报规范化培训,重点强调ADR和医疗事故的区分,进行现场考核,考核未通过者进行下一轮考核;责任到人,安排9个临床药师深入病区进行合理用药培训(药物安全风险、药物相互作用、配伍禁忌等),做好患者用药教育,指导患者认识并辨别ADR,消除患者对ADR的恐惧和排斥,将病区上报ADR情况纳入临床药师年末考核;安排ADR专员参加国家、省和市等相关部门举办的药品安全性监测会议,及时向医务人员传达新的用药安全知识,提高医护人员的整体认识;在门诊、住院药房设置用药咨询窗口,提供ADR信息咨询;在门诊大厅及取药窗口设置安全用药宣传栏,制定ADR展板,便于患者了解ADR信息;编辑通俗易懂的ADR小册子,发放至临床科室,方便在院患者查阅;不断培养临床药师队伍,为临床提供专业技术咨询和药学会诊,推行个体化给药方案。
2.2.3 制定重点监测品种编辑《药讯》,积极向医护人员传达国内外药品最新资讯,发布国家食品药品监督管理总局通报的ADR品种和药物警讯信息,重点监测我院此类品种的临床应用和ADR发生情况,并制定相应的处置流程和应急预案。例如,2014年英国警示伏立康唑的肝毒性、光毒性和鳞状细胞癌风险后,我院也监测上报了多例伏立康唑引起肝毒性的病例,因此在临床上多次强调,使用该药前检查肝功能,在第一个月治疗期间继续检查肝功能,至少每周一次,随后每月检查一次,如果发现AST或ALT水平显著升高,即可停用,除非该药对患者的治疗获益大于肝毒性的风险。此外,监测小组还重点监测我院抗肿瘤药物相关ADR信息,以提高临床安全用药意识,及时采取防范措施。
2.2.4 定期汇总,及时反馈药剂科统计分析ADR报表,每季度在药事质控会上通报总体上报情况,提出干预和改进措施,编入当季《药讯》专用版块和上传医院内部网站,供临床参考学习。
2.2.5 建立惩罚、奖励监管制度,提高医护人员上报积极性每年年初与病区签订ADR上报数量目标责任书,并按季度进行考核,未完成的一例扣款200元,对超额完成的,每一例奖励100元,年底结算。例如,淋巴瘤科在2015年度超额完成20例,获得2000元奖励。ADR指标计划完成情况与科室考核挂钩,未完成任务科室的主要负责人不得参加本年度评优评先活动等。
2.2.6 多方面提供药品咨询平台积极配合网络科,将药品信息嵌入HIS系统,编辑我院《药品处方集》和《药品目录》,方便临床查询;在临床科室固定位置摆放ADR报表,定期核查补充;临床药师在病区摆放用药咨询记录本,及时为临床提供全方位咨询。
2.3 检查和处理阶段(C、A)对比实施PDCA循环管理前后的结果可知,持续改进方案获得一定成效:① 建立ADR监测报告制度和ADR监测小组后,ADR上报情况较前得到明显改善。② 规范上报流程、完善奖惩制度,不报、漏报情况明显减少。③ 通过全方位的宣传和培训,医护人员上报ADR的积极性明显提高,多数患者对ADR的发生给予理解。④ 每季度对监测的ADR报告进行统计分析,起到用药安全警示作用,促进合理用药。⑤ 通过PDCA循环管理,使新出现的问题在下一个循环中得到有效解决,提高整体报告质量。⑥ 临床科室和职能科室的沟通与配合更加密切,尤其体现临床药师在临床中的地位和优势[6]。
未解决问题再优化:虽然ADR整体指标已有很大改善,但仍有以下几个问题:① 从药品种类统计中发现,发生ADR以抗肿瘤药物及其辅助药为主,抗感染药物、生物制品等药物上报例数较少。② ADR报表以住院患者为主,门诊、急诊报表很少,可能与未制定指标计划有关。③ 部分科室仍存在不积极上报情况,例如外三科、外四科等。④ 从监测质量管理指标统计来看,上报例数主要为已知的一般/严重的ADR,对于新的一般的/严重的ADR上报比例较少。对于以上未解决的问题,移交下一个循环解决。
3 结果5年来,我院上报ADR数量为1363例,其中:运用PDCA管理方法前(2011年)有效例数仅为47例;实施PDCA循环管理后的2012-2015年ADR有效例数分别为171、286、417、442例,报告总例数逐年升高。严重的ADR例数较管理前也明显增多,2011-2015年严重的ADR报告例数分别为0(0.00%)、58(33.92%)、142(49.65%)、118(28.30%)、172(38.91%)例,平均占比为35.95%,见表 2。通过此次全面质量管理,我院有效报表的比例显著提高,从2011年的82.46%上升到2015年100.00%,见表 3。
|
|
表 2 2011-2015年ADR报告数量 |
|
|
表 3 2011-2015年监测质量管理指标 |
管理前ADR涉及的药物品种和数量均较少,实施管理后确定重点监测品种为抗肿瘤及其辅助用药、抗感染药物、中成药,因此这3类药物上报数量明显升高,尤其是抗肿瘤及辅助用药,构成比为57.45%,其次是抗感染药物(占8.22%)、中成药(占6.60%)。同时增加了心血管系统、镇痛药、呼吸系统用药、代谢及内分泌系统用药不良反应的监测,见表 4。
|
|
表 4 2011-2015年ADR涉及的药物品种例数及构成比统计表 |
2011-2015年抗肿瘤药物引发的严重ADR累计系统以红细胞异常为主(占68.67%),其次是血液系统损害(占22.82%),两者均表现为骨髓抑制,见表 5。
|
|
表 5 2011-2015年抗肿瘤药物引起严重的ADR损害系统分析 |
通过实施全面的质量管理,针对抗肿瘤药物引发常见的严重骨髓抑制,通报临床积极采取相应的防范措施和处理流程,用药前认真评估患者身体素质、规范抗肿瘤药物的化疗疗程、用法用量及溶媒选择,规范辅助用药如升粒细胞、升白细胞药物的使用,减少此类严重ADR的发生[7-9]。
4 结语保障患者用药安全,做好ADR监测是医院医疗安全管理的基础性工作,是医疗药事管理中重要的组成部分,更是全面提升医疗质量的关键环节[10-11]。通过进行全面监测,及时发现问题、分析问题,进一步改进、完善制度,积极采取有效预防措施减少ADR发生,加强不良事件的监测尤为重要[12]。近年来,我院ADR的上报数量和质量位于贵州省前列,多次获得相关部门的表彰。该项成绩的取得在于PDCA循环管理方法的充分运用:ADR监测报告制度的建立、规范ADR上报报告流程;加强ADR上报宣传培训教育;加强重点药品的ADR监测;提供ADR咨询信息;建立并完善奖惩制度等。我们下一步将更加重视此项工作,充分吸取PDCA循环全面质量管理工具的精华[13-14],加强管理工具的运用能力,提高各个科室上报ADR的热情,促进我院临床安全、有效、合理用药,使持续质量改进成为医护技发现、解决、处理问题的良好习惯[15],为PDCA循环在医院各个管理环节全方位应用,尤其是合理用药监测等[16]的应用奠定基础。
| [1] |
楼陆军, 刘银生, 罗洁霞, 等. 再论我国药品不良反应监测的现状与完善对策[J]. 中国药业, 2012, 20(18): 2-3. DOI:10.3969/j.issn.1006-4931.2012.18.002 |
| [2] |
唐莲, 虞燕霞, 周琴, 等. PDCA循环管理方法在我院药品不良反应监测管理中的应用效果分析[J]. 中国药房, 2015(28): 4027-4029. DOI:10.6039/j.issn.1001-0408.2015.28.44 |
| [3] |
卫生部. 卫办医管发[2012]144号关于印发三级肿瘤医院、三级眼科医院评审标准(2011年版)实施细则的通知[S]. 2012.
|
| [4] |
Liu JY, Li YZ. Effective Communication In Performance Management System With PDCA Cycle[J]. Commercial Research, 2006, 49(23): 41-42. |
| [5] |
朱磊, 黄萍, 李颖. 我国药品不良反应监测现状及存在问题[J]. 中国药事, 2016, 30(7): 729-734. |
| [6] |
罗瑞兰, 陈文滨, 朱惠娟, 等. PDCA循环管理在我院药品不良反应监测工作中的应用[J]. 中国药房, 2015(17): 2353-2355. DOI:10.6039/j.issn.1001-0408.2015.17.17 |
| [7] |
边永娜, 张田香, 任小烨, 等. 334例药品不良反应的医院质控负性指标监控分析[J]. 中国管理杂志, 2016, 36(1): 68-69. |
| [8] |
郑冬雁, 翟淑越, 崔冉, 等. 4120例抗肿瘤药品不良反应分析[J]. 中国药物警戒, 2014, 11(5): 291-294. |
| [9] |
龚世菊, 王芳, 谭文明. 我院2011-2015年严重药品不良反应分析[J]. 北方药学, 2016, 13(3): 160-161. |
| [10] |
赵国光, 王欣, 李永忠, 等. PDCA循环管理在药物不良反应监测中的应用[J]. 中华医院管理杂志, 2011, 27(4): 297-300. |
| [11] |
周惠卿. PDCA管理在药物不良反应监测中的应用[J]. 中国现代医药杂志, 2016(4): 73-75. |
| [12] |
黄旗, 王建军, 刘海玲, 等. PDCA循环在规范I类切口手术预防用抗菌药物中的应用[J]. 中国感染控制杂志, 2013, 12(5): 356-359. |
| [13] |
王力红, 赵霞, 张京利, 等. 追踪方法学与PDCA循环管理在医院感染管理质量控制中的应用[J]. 中华医院感染学杂志, 2014, 24(6): 1539-1541. |
| [14] |
黄艳, 王波, 杨洪波. PDCA循环管理法在我院抗菌药物管理中的应用效果分析[J]. 中国药房, 2014, 25(21): 2014-2016. DOI:10.6039/j.issn.1001-0408.2014.21.32 |
| [15] |
张懿, 金瓯. 药品不良反应监测工作中所存在的问题与预防对策[J]. 中医药管理杂志, 2016(9): 64-65. |
| [16] |
魏润新, 朱鹏祥, 吴健. 基于临床用药监管工作平台的不合理用药干预[J]. 中国药房, 2013(34): 3191-3193. DOI:10.6039/j.issn.1001-0408.2013.34.08 |
 2017, Vol. 31
2017, Vol. 31