复方氨基酸注射液(20AA)包装材料改进及其稳定性的研究
张庆明
,
张平
,
陈美惠
,
孙志伟
,
苏华
,
曹燕丽

收稿日期:2016-11-08
基金项目:军队医疗机构制剂标准单品种研究课题计划—复方氨基酸注射液标准研究(编号14TG0529)
作者简介:张庆明, 药学硕士, 医药工程师, 执业药师; Tel:(025)80860165
通信作者:曹燕丽; Tel:(025)84820173
摘要:目的:研究复方氨基酸注射液(20AA)在非PVC五层共挤膜软袋包装基础上,另加外阻隔袋内置抗氧剂并抽真空封口包装条件下的稳定性。方法:根据《药物稳定性研究指导原则》和复方氨基酸注射液(20AA)的质量标准,对样品进行光照试验、加速试验和长期试验。结果与结论:复方氨基酸注射液(20AA)在非PVC五层共挤膜软袋包装基础上,另加外阻隔袋内置抗氧剂并抽真空封口包装条件下,与非PVC五层共挤膜软袋包装比较,其性状、透光率、含量明显改善,但pH值有所下降。
关键词:氨基酸注射液 非PVC药包材 光照试验 加速试验 阻隔袋 药物稳定性
Study on the Improvement and Stability of Packaging Materials for Compound Amino Acid Injection (20AA)
Zhang Qingming,
Zhang Ping,
Chen Meihui,
Sun Zhiwei,
Su Hua,
Cao Yanli
Nanjing General Hospital, Nanjing 210002, China
Abstract: Objective: To study the stability of the compound amino acid injection (20AA) in the non PVC five-layer coextrusion film soft bag packaging, combined with external vacuum sealed barrier bag containing antioxidants.Methods: According to the Drug Stability Research Guidelines and quality standards of the compound amino acid injection (20AA), the samples were subjected to light tests, accelerated tests and long-term tests.Results and Conclusion: The compound amino acid injection (20AA) in the non PVC five-layer coextrusion film soft bag packaging, combined with external vacuum sealed barrier bag containing antioxidants, were obviously improved in its characteristics, light transmittance and content while decreased in its pH value, compared with that only in the non PVC five-layer coextrusion film soft bag packaging.
Key words:
amino acid injection non PVC drug packaging material light test accelerated test barrier bag drug stability
复方氨基酸注射液(20AA)是我院黎介寿院士领衔腹部外科研究所专家在长期临床实践中研发的处方。20AA意指该制剂含有20种氨基酸,是在常见18种氨基酸注射液基础上增加了鸟氨酸和牛磺酸,使其更符合正常人乳蛋白模式,牛磺酸是机体中重要的内源性保护物质,在治疗肠瘘病人时有着独特效果[1]。我院自制复方氨基酸注射液(20AA)[批准文号:总制字(2012)G50102]为玻璃瓶包装,质量稳定可靠。但玻璃瓶较重、运输成本高、体积大、易破碎引起破瓶污染,输液过程因需形成空气回路,易造成二次污染。因此,课题组详细考察复方氨基酸注射液在非PVC五层共挤膜软袋包装基础上,另加外阻隔袋内置抗氧剂并抽真空封口包装条件下的稳定性,拟为改进包装积累基础研究资料[2]。
1 仪器与试药
分析仪:HITACHI L-8800氨基酸分析仪(日本日立公司),色谱柱:钠柱(磺酸性强酸型阳离子交换树脂,日本日立公司),反应温度:流速:0.4 mL·min-1,进样体积:20 μL,试剂压力: 0~70 bar, 缓冲液压力: 0~14.7 MP;pH计:PHSJ-4A(上海精密科学仪器有限公司);不溶性微粒计数仪:GWF-8JA(天河医疗仪器有限公司);紫外可见分光光度计(日本岛津);细菌内毒素检查仪:ET-96(天津市天大天发科技有限公司);霉菌培养箱:MJ-160型(上海跃进医疗器械厂);稳定性试验箱:LRHS-150B(上海博泰实验设备有限公司)。
氨基酸对照品(中国食品药品检定研究院,批号:140624-200805);非PVC五层共挤输液用膜(南京大冢泰邦科技有限公司,批号:130318);阻隔袋(连云港塑料制品包装有限公司,批号:130526);抗氧剂:焦亚硫酸钠(湖南尔康制药有限公司,批号:20110401);复方氨基酸注射液(20AA)(自制,250 mL/袋,批号:131211、131212、131213)。
2 方法和结果
2.1 样品的制备及检测项目
2.1.1 复方氨基酸注射液(20AA)样品的制备
取16种氨基酸,除苯丙氨酸、色氨酸、鸟氨酸、牛磺酸4种氨基酸外,投入预先清洗干净的放有充过氮气的注射用水(80 ℃以上)的密闭浓配制罐中,边搅拌边加热至微沸、溶解。加入活性炭吸附后,滤过置密闭稀配罐中,加入苯丙氨酸、色氨酸、鸟氨酸、牛磺酸4种氨基酸,搅拌至完全溶解后,加注射用水至全量,调pH 5.2~6.0,取样送检。待半成品检验合格后,灌装(全程充氮气)、灭菌、灯检、包装(250 mL/袋)后,即制得样品[3-4]。连续配制3批,批号:131211、131212、131213,其中包装材料为非PVC五层共挤膜软袋(以下简称A组);包装材料为非PVC五层共挤膜,另加外阻隔袋,内置抗氧剂抽真空封口(以下简称B组)。
2.1.2 检测项目
两组样品进行光照试验10天、加速试验6个月、长期试验18个月,对其性状、可见异物、pH、含量、无菌、细菌内毒素、不溶性微粒、渗透压摩尔浓度进行检测[5-6]。
2.2 稳定性试验
2.2.1 强光照射试验
取供试品A、B两组(3个批号均为131211、131212、131213),分别置于照度为(4500±500)Lx的稳定性试验箱中,于第5日和第10日分别取样,按稳定性重点考察项目进行检测,检测结果与0日时比较,见表 1、表 2。结果显示,两组不同包装材料的复方氨基酸注射液(20AA)在强光照射试验条件下,其可见异物、无菌、细菌内毒素、不溶性微粒和渗透压摩尔浓度均无明显变化。但随着时间的延长,A组氨基酸注射液性状由微黄色澄明液体逐渐变为棕色澄明液体;第5、10天时,透光率明显下降,由93.67%降到47.70%,pH值几乎不变。B组氨基酸注射液与0日时比较,其性状、透光率几乎不变,但第5、10天时,pH值下降明显,由6.53降到4.13,利用统计学软件进行分析,发现两组均有显著性差异(P<0.05)。由表 2可知,与0日时比较,A组氨基酸注射液各组分含量绝大多数都在下降,而B组氨基酸注射液各组分含量下降的较少,且下降后也均在合格范围内(80%~120%)。其中因氨基酸分析仪的局限性,暂不能测出乙酰半胱氨酸含量,所以表 2中只有19种氨基酸。两组复方氨基酸注射液各组分含量利用统计学软件进行分析比较,其中酪氨酸、脯氨酸均有显著性差异(P<0.05);牛磺酸、苏氨酸、亮氨酸、鸟氨酸、色氨酸5组均有极显著性差异(P<0.01)。
表 1
Table 1
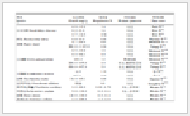
表 1 复方氨基酸注射液光照试验检测结果(x±s)
| 组别 |
检测项目 |
考察时间 |
| 0天 |
5天 |
10天 |
| A组 |
性状(微黄澄明) |
微黄澄明 |
黄色澄明 |
棕色澄明 |
|
pH(5.0~7.0) |
6.53±0.06 |
6.27±0.06 |
6.27±0.06 |
|
透光率(不低于92%) |
93.67±0.57 |
69.80±1.57 |
47.70±1.06 |
| B组 |
性状(微黄澄明) |
微黄澄明 |
黄色澄明 |
棕色澄明 |
|
pH(5.0~7.0) |
6.53±0.06 |
4.90±0.10* |
4.13±0.15* |
|
透光率(不低于92%) |
93.67±0.57 |
93.70±0.61 |
92.87±0.81 |
| 注:*表示有显著性差异(P<0.05)。 |
|
表 1 复方氨基酸注射液光照试验检测结果(x±s)
|
表 2
Table 2

表 2 复方氨基酸注射液光照试验含量检测结果(x±s)
| 氨基酸成分 |
A组 |
|
B组 |
方差分析 |
| 5d |
10d |
|
5d |
10d |
| 牛磺酸 |
83.56±0.86 |
82.0±0.50 |
|
102.1±0.61 |
101.5±0.90 |
P<0.01 |
| 天门冬氨酸 |
89.63±0.63 |
80.94±0.34 |
|
86.16±0.64 |
80.49±1.07 |
P>0.05 |
| 苏氨酸 |
76.9±0.65 |
77.17±0.26 |
|
93.2±0.85 |
92.3±0.41 |
P<0.01 |
| 丝氨酸 |
98.35±0.76 |
68.76±0.56 |
|
92.44±0.94 |
90.2±1.09 |
P>0.05 |
| 谷氨酸 |
95.7±0.88 |
88.2±0.58 |
|
94.15±0.61 |
93.5±0.84 |
P>0.05 |
| 甘氨酸 |
92.19±0.77 |
86.45±0.91 |
|
83.55±1.18 |
82.1±0.65 |
P>0.05 |
| 丙氨酸 |
96.4±1.03 |
93.2±1.04 |
|
103.24±0.60 |
100.6±1.54 |
P>0.05 |
| 缬氨酸 |
79.84±1.34 |
83.94±1.63 |
|
86.45±0.58 |
82.11±1.86 |
P>0.05 |
| 蛋氨酸 |
92.13±0.59 |
92.97±2.01 |
|
93.57±1.11 |
92.16±0.54 |
P>0.05 |
| 异亮氨酸 |
87.42±0.54 |
89.97±1.14 |
|
82.05±0.68 |
87.97±1.38 |
P>0.05 |
| 亮氨酸 |
93.65±0.75 |
94.58±0.73 |
|
84.34±0.90 |
83.98±0.39 |
P<0.01 |
| 酪氨酸 |
88.33±0.82 |
88.0±0.85 |
|
87.0±1.32 |
86.17±1.28 |
P<0.05 |
| 苯丙氨酸 |
110.5±1.15 |
106.69±1.33 |
|
105.85±0.90 |
105.0±0.48 |
P>0.05 |
| 鸟氨酸 |
73.76±2.03 |
68.48±1.22 |
|
96.16±0.37 |
92.24±0.56 |
P<0.01 |
| 赖氨酸 |
81.25±0.26 |
81.19±0.59 |
|
93.53±1.06 |
88.2±0.67 |
P>0.05 |
| 组氨酸 |
107.69±0.87 |
101.77±0.62 |
|
95.55±0.66 |
89.32±0.69 |
P>0.05 |
| 色氨酸 |
45.25±0.62 |
41.08±0.88 |
|
93.17±0.63 |
91.67±1.05 |
P<0.01 |
| 精氨酸 |
107.89±0.57 |
103.57±0.97 |
|
98.82±0.87 |
93.73±0.91 |
P>0.05 |
| 脯氨酸 |
89.8±1.36 |
84.93±0.61 |
|
96.57±0.63 |
95.88±1.22 |
P<0.05 |
|
表 2 复方氨基酸注射液光照试验含量检测结果(x±s)
|
2.2.2 加速试验
取供试品A、B两组(3个批号均为131211、131212、131213),置温度(40±2)℃,相对湿度(25±2)%的稳定性试验箱中,分别于1、2、3、6个月时取样,按稳定性重点考察项目进行检测,检测结果与0月时比较,见表 3、表 4。两组不同包装材料的复方氨基酸注射液(20AA)在加速试验条件下,其可见异物、无菌、细菌内毒素、不溶性微粒和渗透压摩尔浓度均无明显变化,但随着时间的延长,由表 3可知:A组氨基酸注射液与0月时比较,其性状由微黄色澄明液体逐渐变为黄色,最终变为深棕色澄明液体;透光率一直下降,由93.67%降到17.40%;pH值几乎保持不变。B组氨基酸注射液与0月时比较,其性状不变;第1、2、3个月时,透光率下降不明显,但第6个月时透光率下降至66.90%;pH值下降明显,由6.53降到4.33。两组复方氨基酸注射液pH值、透光率利用统计学软件进行分析,均有显著性差异(P<0.05)。由表 4可知,与0时月比较,A组氨基酸注射液各组分含量基本都在下降,而B组氨基酸注射液各组分含量下降的较少,且下降后的含量几乎都在合格范围内(80%~120%,甘氨酸除外,可能是检测误差导致),其中因氨基酸分析仪的局限性,暂不能测出乙酰半胱氨酸含量,所以表 4中只有19种氨基酸。两组复方氨基酸注射液各组分含量利用统计学软件进行分析,其中牛磺酸、丝氨酸、谷氨酸、丙氨酸、蛋氨酸均有显著性差异(P<0.05);缬氨酸、鸟氨酸、赖氨酸、色氨酸均有极显著性差异(P<0.01)。
表 3
Table 3

表 3 复方氨基酸注射液加速试验检测结果(x±s)
| 组别 |
检测项目 |
考察时间 |
| 0月 |
1月 |
2月 |
3月 |
6月 |
| A组 |
性状(微黄澄明) |
微黄澄明 |
黄色澄明 |
黄色 |
棕色 |
深棕 |
|
pH(5.0~7.0) |
6.53±0.06 |
6.23±0.06 |
6.20±0.10 |
6.20±0.10 |
6.20±0.10 |
|
透光率(不低于92%) |
93.67±0.57 |
58.27±1.20 |
48.40±1.15 |
39.57±0.75 |
17.40±0.62 |
| B组 |
性状(微黄澄明) |
微黄澄明 |
微黄澄明 |
微黄澄明 |
微黄澄明 |
微黄澄明 |
|
pH(5.0~7.0) |
6.53±0.06 |
4.30±0.10* |
4.30±0.10* |
4.40±0.10* |
4.33±0.11* |
|
透光率(不低于92%) |
93.67±0.57 |
89.30±0.82* |
89.40±0.62* |
86.67±1.34* |
66.90±1.93* |
| 注:*表示有显著性差异(P<0.05)。 |
|
表 3 复方氨基酸注射液加速试验检测结果(x±s)
|
表 4
Table 4

表 4 复方氨基酸注射液加速试验含量检测结果(x±s)
| 组分 |
A组 |
|
B组 |
方差分析 |
| 1月 |
2月 |
3月 |
6月 |
|
1月 |
2月 |
3月 |
6月 |
| 牛磺酸 |
94±0.85 |
93.1±0.79 |
81.12±0.54 |
84.5±0.66 |
|
96.1±1.03 |
95.4±0.79 |
95.1±0.85 |
92.1±0.91 |
P<0.05 |
| 天门冬氨酸 |
88.12±0.52 |
85.67±0.87 |
85.10±0.74 |
74.9±1.17 |
|
92.69±0.82 |
85.02±0.95 |
86.90±0.71 |
82.12±0.88 |
P>0.05 |
| 苏氨酸 |
101.8±1.35 |
90.8±0.84 |
82.1±0.62 |
73.37±0.79 |
|
96.8±0.46 |
94.4±0.89 |
93.87±0.72 |
90.57±0.83 |
P>0.05 |
| 丝氨酸 |
70.92±0.69 |
67.4±0.78 |
83.56±1.17 |
74.48±0.56 |
|
95.2±0.57 |
88.4±0.83 |
84.76±0.93 |
81.65±0.74 |
P<0.05 |
| 谷氨酸 |
97.65±0.94 |
84.2±0.57 |
85.0±0.61 |
79.45±0.85 |
|
102.7±0.94 |
100.5±0.64 |
96.5±0.89 |
88±0.84 |
P<0.05 |
| 甘氨酸 |
84.06±0.59 |
84.03±0.79 |
78.68±0.82 |
71.55±0.67 |
|
87.63±1.23 |
84.13±1.09 |
77.74±0.75 |
78.25±0.62 |
P>0.05 |
| 丙氨酸 |
89.04±0.78 |
82.44±1.32 |
80.91±0.56 |
69.09±0.87 |
|
94.29±0.45 |
91.20±0.78 |
90.49±0.38 |
89.29±0.79 |
P<0.05 |
| 缬氨酸 |
76.77±0.75 |
64.64±0.44 |
70.24±0.87 |
68.85±0.59 |
|
90.85±0.38 |
88.56±0.68 |
82.66±0.55 |
85.07±0.73 |
P<0.01 |
| 蛋氨酸 |
88.1±0.84 |
65.13±0.51 |
69.67±0.66 |
52.43±0.72 |
|
96.3±0.57 |
89.12±0.80 |
88.67±1.07 |
86.77±0.99 |
P<0.05 |
| 异亮氨酸 |
83.57±1.17 |
84.86±0.58 |
78.11±0.75 |
75.89±0.62 |
|
86.98±0.49 |
84.24±0.73 |
78.42±0.89 |
83.3±0.62 |
P>0.05 |
| 亮氨酸 |
88.57±0.99 |
91.04±0.74 |
84.07±0.68 |
78.38±0.37 |
|
92.33±0.76 |
90.06±1.28 |
83.06±0.94 |
86.1±0.68 |
P>0.05 |
| 酪氨酸 |
97.83±0.75 |
96.2±0.69 |
94.17±0.46 |
79.83±0.83 |
|
102.5±1.23 |
95.83±0.97 |
92.50±0.69 |
90.5±0.71 |
P>0.05 |
| 苯丙氨酸 |
108±0.66 |
105.8±0.89 |
86.5±0.75 |
77.42±0.54 |
|
106.04±0.6 |
104.54±0.88 |
94.62±0.62 |
85.73±0.98 |
P>0.05 |
| 鸟氨酸 |
70.08±1.11 |
61.92±0.86 |
60.56±0.94 |
60.76±0.68 |
|
95.84±0.73 |
94.48±0.59 |
90.96±0.84 |
94.24±0.77 |
P<0.01 |
| 赖氨酸 |
80.74±0.89 |
80.03±0.56 |
77.89±0.85 |
57.86±0.91 |
|
94.44±0.99 |
92.4±0.74 |
92.0±0.77 |
93.41±0.74 |
P<0.01 |
| 组氨酸 |
103.4±0.81 |
100.4±0.98 |
96.48±0.76 |
68.86±0.54 |
|
91.64±0.79 |
89.18±0.82 |
82.7±0.74 |
82.38±0.95 |
P>0.05 |
| 色氨酸 |
43±0.57 |
44.75±0.68 |
48.08±0.63 |
36.58±0.78 |
|
92.25±0.92 |
91.42±0.79 |
91.58±0.64 |
92.33±0.69 |
P<0.01 |
| 精氨酸 |
107.8±0.78 |
107.5±0.83 |
101.47±0.98 |
76.22±0.86 |
|
92.94±0.68 |
87.22±0.73 |
88.08±0.89 |
83.69±0.81 |
P>0.05 |
| 脯氨酸 |
94.01±0.97 |
86.55±0.85 |
81.26±0.71 |
81.45±0.79 |
|
86.55±0.57 |
85.43±0.81 |
83.9±0.94 |
89.19±0.76 |
P>0.05 |
|
表 4 复方氨基酸注射液加速试验含量检测结果(x±s)
|
2.2.3 长期试验
取供试品A、B两组(3个批号均为131211、131212、131213),置温度(25±2)℃,相对湿度(40±5)%的稳定性试验箱中,分别于0、3、6、9、12个月时取样,按稳定性重点考察项目进行检测,检测结果与0月时比较,见表 5、表 6。两组3批不同包装材料的复方氨基酸注射液(20AA)在强光照射试验条件下,其可见异物、无菌、细菌内毒素、不溶性微粒和渗透压摩尔浓度均无明显变化,但随着时间的延长,由表 5可知:A组氨基酸注射液与0月时比较,其性状由微黄色澄明液体逐渐变为黄色,最终变为深棕色澄明液体;pH值几乎保持不变;透光率一直下降,由93.67%降到50.63%。B组氨基酸注射液与0月时比较,其性状不变,透光率有所下降;pH值下降明显,由6.53降到4.16。两组复方氨基酸注射液pH值、透光率利用统计学软件进行分析,均有显著性差异(P<0.05)。由表 6可知:与0月时比较,A组氨基酸注射液各组分含量基本都在下降,但有些组分含量下降较少,在合格范围内;B组氨基酸注射液各组分含量下降较少,且下降后的含量都在合格范围内(80%~120%),其中因氨基酸分析仪的局限性,暂不能测出乙酰半胱氨酸含量,所以表 6中只有19种氨基酸。两组复方氨基酸注射液各组分含量利用统计学软件进行分析,其中缬氨酸、赖氨酸、脯氨酸均有显著性差异(P<0.05);丝氨酸、甘氨酸、丙氨酸、鸟氨酸、色氨酸均有极显著性差异(P<0.01)。
表 5
Table 5

表 5 复方氨基酸注射液长期试验检测结果(x±s)
| 组别 |
检测项目 |
考察时间 |
| 0月 |
3月 |
6月 |
9月 |
12月 |
| A组 |
性状(微黄澄明) |
微黄澄明 |
微黄澄明 |
黄色液体 |
深黄液体 |
深棕液体 |
|
pH(5.0~7.0) |
6.53±0.06 |
6.10±0.10 |
6.16±0.11 |
6.10±0.10 |
6.10±0.17 |
|
透光率(不低于92%) |
93.67±0.57 |
73.93±1.32 |
63.00±0.70 |
56.23±1.01 |
50.63±0.76 |
| B组 |
性状(微黄澄明) |
微黄澄明 |
微黄澄明 |
微黄澄明 |
微黄澄明 |
微黄澄明 |
|
pH(5.0~7.0) |
6.53±0.06 |
4.97±0.06* |
4.50±0.10* |
4.00±0.00* |
4.16±0.06* |
|
透光率(不低于92%) |
93.67±0.57 |
89.90±0.20* |
89.50±0.26* |
88.40±0.70* |
89.90±1.61* |
| 注:*表示有显著性差异(P<0.05)。 |
|
表 5 复方氨基酸注射液长期试验检测结果(x±s)
|
表 6
Table 6

表 6 复方氨基酸注射液长期试验含量检测结果(x±s)
| 组分 |
A组 |
|
B组 |
方差分析 |
| 0月 |
3月 |
6月 |
9月 |
12月 |
|
0月 |
3月 |
6月 |
9月 |
12月 |
| 牛磺酸 |
110.3±1.03 |
98.00±0.85 |
90.50±0.76 |
94.50±0.82 |
93.50±1.14 |
|
110.30±0.93 |
98.50±0.62 |
96.20±0.87 |
96.30±0.71 |
95.10±0.84 |
P>0.05 |
| 天门冬氨酸 |
90.29±0.90 |
82.04±0.75 |
80.45±0.82 |
89.50±1.05 |
90.16±0.77 |
|
90.29±0.82 |
79.71±1.21 |
80.30±0.63 |
88.70±0.78 |
92.45±0.62 |
P>0.05 |
| 苏氨酸 |
97.23±0.77 |
96.15±0.83 |
88.80±0.92 |
81.80±1.15 |
65.10±0.67 |
|
97.23±0.79 |
96.30±0.86 |
95.60±0.59 |
91.20±0.72 |
90.77±0.81 |
P>0.05 |
| 丝氨酸 |
97.90±0.93 |
80.16±0.72 |
79.68±0.87 |
74.00±0.65 |
71.08±1.23 |
|
97.90±0.84 |
96.50±0.78 |
93.20±0.62 |
93.30±0.85 |
93.52±0.79 |
P<0.01 |
| 谷氨酸 |
98.40±0.86 |
91.70±0.75 |
86.10±1.31 |
80.40±0.96 |
87.80±0.78 |
|
98.40±0.71 |
91.05±0.68 |
85.35±0.90 |
88.60±0.89 |
89.55±0.84 |
P>0.05 |
| 甘氨酸 |
91.83±1.21 |
75.92±0.98 |
76.61±0.85 |
77.60±0.89 |
87.82±0.63 |
|
91.83±0.93 |
95.20±0.87 |
94.20±1.08 |
93.50±0.75 |
90.62±0.72 |
P<0.01 |
| 丙氨酸 |
97.18±0.88 |
78.08±0.79 |
73.44±0.73 |
75.60±0.69 |
76.20±0.57 |
|
97.18±1.04 |
96.83±0.99 |
94.20±0.78 |
93.10±0.81 |
92.60±0.85 |
P<0.01 |
| 缬氨酸 |
98.22±0.92 |
68.08±0.87 |
73.66±1.32 |
82.90±0.82 |
82.05±0.65 |
|
98.22±0.97 |
99.98±0.72 |
93.01±0.65 |
91.80±0.79 |
94.56±0.68 |
P<0.05 |
| 蛋氨酸 |
98.70±1.07 |
91.20±0.82 |
97.70±0.93 |
82.50±0.77 |
82.53±0.68 |
|
98.70±0.95 |
96.10±0.84 |
93.37±0.73 |
88.23±0.70 |
89.97±0.53 |
P>0.05 |
| 异亮氨酸 |
97.54±0.85 |
94.75±0.91 |
91.76±0.74 |
93.40±0.69 |
88.91±0.78 |
|
97.54±1.15 |
96.53±0.78 |
91.22±0.85 |
92.30±0.73 |
90.96±0.63 |
P>0.05 |
| 亮氨酸 |
94.45±0.97 |
81.51±0.92 |
84.20±0.61 |
88.60±0.79 |
83.58±0.83 |
|
94.45±0.97 |
82.69±0.62 |
83.73±0.88 |
87.50±0.93 |
86.82±0.71 |
P>0.05 |
| 酪氨酸 |
93.83±0.65 |
92.17±0.79 |
87.17±1.33 |
87.00±0.86 |
85.83±0.74 |
|
93.83±1.02 |
87.50±0.83 |
85.67±0.78 |
85.30±0.85 |
83.50±0.92 |
P>0.05 |
| 苯丙氨酸 |
111.58±0.87 |
83.96±0.76 |
84.08±0.95 |
85.50±0.82 |
84.81±0.61 |
|
111.58±0.37 |
90.92±0.76 |
93.31±0.89 |
95.20±0.62 |
92.08±0.71 |
P>0.05 |
| 鸟氨酸 |
97.52±0.79 |
68.08±0.82 |
72.08±0.96 |
70.12±0.88 |
72.48±1.01 |
|
97.52±0.67 |
98.16±1.28 |
92.08±0.97 |
90.12±0.80 |
88.96±0.75 |
P<0.01 |
| 赖氨酸 |
101.60±1.32 |
75.82±0.97 |
71.98±0.84 |
64.30±0.65 |
63.00±0.91 |
|
101.60±0.85 |
95.31±0.79 |
91.72±0.68 |
93.70±0.76 |
86.08±0.82 |
P<0.05 |
| 组氨酸 |
110.14±0.89 |
99.18±1.16 |
78.90±0.97 |
77.00±0.78 |
71.39±0.66 |
|
110.14±0.53 |
98.36±0.81 |
89.96±0.93 |
88.10±1.07 |
85.13±0.85 |
P>0.05 |
| 色氨酸 |
95.75±0.66 |
48.42±0.99 |
41.58±0.82 |
36.40±1.20 |
48.40±0.95 |
|
95.75±0.87 |
96.58±0.79 |
93.08±0.82 |
92.60±0.75 |
93.92±0.91 |
P<0.01 |
| 精氨酸 |
109.73±0.78 |
98.14±0.46 |
81.97±0.77 |
88.20±0.92 |
79.26±0.81 |
|
109.73±1.34 |
97.53±0.65 |
91.63±0.96 |
90.90±0.78 |
89.94±0.84 |
P>0.05 |
| 脯氨酸 |
91.54±0.99 |
78.03±0.58 |
77.03±0.71 |
70.30±0.83 |
61.68±0.95 |
|
91.54±0.79 |
88.90±0.93 |
88.49±0.87 |
89.30±1.07 |
83.96±0.79 |
P<0.05 |
|
表 6 复方氨基酸注射液长期试验含量检测结果(x±s)
|
3 讨论
药品包装材料对药品质量至关重要,在选择药包材时,应考虑其对药品质量稳定性的影响,以及经济合理性[7]。早期课题组针对我院自制复方氨基酸注射液(20AA)玻璃瓶包装改进成非PVC五层共挤膜软袋包装进行了试验[8],之后持续研究发现,单纯的普通非PVC五层共挤膜软袋更适用于常规输液(如葡萄糖注射液、氯化钠注射液等),而复方氨基酸注射液(20AA)成分复杂,浓度高,且结晶氨基酸间又有相互作用,不适合采用单纯的普通非PVC五层共挤膜软袋包装。
复方氨基酸注射液是临床上不可或缺的一大类营养输液,目前市场上除了玻璃瓶包装外已有少量软袋包装的复方氨基酸注射液,但均为用特殊材料制成的非PVC共挤膜软袋[9-11],制备工艺复杂、成本高。
本课题组尝试在普通的非PVC五层共挤膜软袋包装基础上,外加套阻隔袋内置抗氧剂并抽真空封口的组合式包装。采用普通的非PVC共挤膜软袋具透明度高、耐热、药物相容性及化学稳定性好等优点;而阻隔袋具有无毒、高阻隔、高强度、低迁移、耐高温蒸汽灭菌、符合生物性能要求等技术特点,二者组合可优势互补。课题组对新包装进行了稳定性研究,结果表明:该包装对复方氨基酸注射液性状、含量、透光率的检测结果有明显改善,说明加了阻隔袋和抗氧剂有助于降低光线、高温对其稳定性的影响,但pH值反而在下降,有待于进一步考察研究[12-15]。
参考文献
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] |
中国药典: 二部[S]. 2010: 附录199.
|
| [6] |
中国药典: 二部[S]. 2015: 816.
|
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
 2017, Vol. 31
2017, Vol. 31 