《药品生产质量管理规范(2010年修订)》[1](以下简称“药品GMP”)于2011年3月起实施。辽宁省药品认证中心自2011年6月开始,按照修订后的药品GMP进行认证检查。截至2015年12月31日,共完成225家次的认证工作。以下对检查的总体情况和高频缺陷内容进行分析,提出改进措施和建议。
1 检查的总体情况 1.1 收审企业情况截至2015年12月31日,我中心共收审药品GMP认证申请232家次(有7家企业撤回认证申请),实际为225家次。其中:中药饮片生产企业35家,医用氧生产企业26家,原料药生产企业49家次,省内认证无菌制剂生产企业11家次,口服固体(液体)生产企业为104家次(部分企业存在原料药、制剂同时申报)。
1.2 认证检查情况共计212家次一次性通过药品GMP认证,13家次未能一次性通过,一次性通过率为94%。共发出告诫信15封,内容主要涵盖品种生产工艺、文件管理、稳定性考察等相关内容;另外,经综合评定,有20家次企业现场检查缺陷等级发生变化,其中7家次企业的缺陷升级为严重缺陷未能一次性通过认证;11家次企业的缺陷升级为主要缺陷,经企业整改后符合药品GMP要求。
我中心依据风险评估原则,结合企业整改情况,对企业存在的缺陷风险开展综合评定。按照《药品生产质量管理规范认证管理办法》、ISO-9001及国家食品药品监督管理总局食品药品审核查验中心质量体系评估标准,建立并完善认证现场检查及综合评定工作程序、评估标准,保证了综合评定的客观性、公正性。通过专家综合评定会议,研讨企业存在的问题,有效识别企业的质量风险。采取约谈、缺陷整改、现场核查、缺陷升级等具体措施,及时规避企业存在的质量风险[2]。
1.3 现场检查发现的缺陷概况我省药品GMP认证检查共发现缺陷项目总计2566项。严重缺陷19项,其中现场检查确定严重缺陷12项,经综合评定后升级为严重缺陷的7项;主要缺陷为88项,其中77项为现场检查过程确定,11项为综合评定后由一般缺陷升级为主要缺陷。
2 高频缺陷情况分析 2.1 缺陷分布情况缺陷数量最多的依次为质量控制与质量保证、文件管理、设备管理,分别占总缺陷数量的20.7%、16.1%、12.3%,明显高于其他方面,具体情况见图 1。其次,机构与人员、厂房与设施、确认与验证、物料与产品等方面出现的缺陷数量基本持平。一定程度上反映出目前药品生产企业在实施GMP过程中普遍存在的问题。
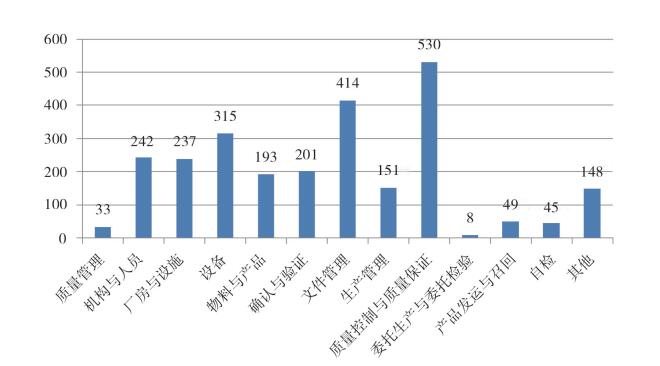
|
图 1 药品GMP认证检查中发现的缺陷数量统计 |
主要体现:检验原始记录缺少信息或填写不规范,检验方法、培养基适用性未确认或确认不全,取样方法不具有代表性,试剂试样管理不合理等方面。还存在检验过程可追溯性差、数据来源追溯性差、检验结果出现异常时实验室可调查的依据不充分等问题。产生上述缺陷的主要原因在于:企业建立的文件、规程不完善,规定内容不全面、不具体,无法指导实际操作;记录格式设置不准确,不便于操作人员记录;对操作人员培训不到位,或培训后未进行效果评估和过程监控,实际操作过程中随意性较大,不能及时对实验所涉及的内容按照操作规程进行记录等。
2.2.2 质量体系运行不顺畅药品GMP提出风险管理理念,强化了质量体系建设。一些企业对于风险管理、质量体系的理解存在偏颇,仅停留在理论上,导致制定的文件与实际不能有效衔接,文件不能有效指导实际生产管理和质量管理。对于偏差、变更、OOS的理解不深入,年度质量回顾、持续工艺确认等内容流于形式,不能与企业的实际情况相结合。
2.2.3 设备维护保养不到位设备的设计和选型应当与生产规模及批生产量相适应,主要设备的能力应当与水、电、气等公用工程系统相配套。对设备进行维护和保养是为了降低设备发生故障的概率, 为持续生产出质量均一的产品提供保证。
设备使用记录与仪器仪表校验和校准都是保证产品质量的基础。设备标识及使用记录缺失,仪器仪表未按使用范围进行校验,不能及时反映设备运行状态,使产品质量存在潜在风险。主要原因在于:设备操作规程未包含生产前设备完好性确认,岗位操作人员培训不到位,设备操作过程中随意性大,未能正确履行岗位职责等。
2.2.4 关键人员职责划分不清,培训流于形式主要问题是企业未针对人员岗位进行有效培训,不能有效评估培训的实际效果,导致培训流于形式,为了完成培训而培训。
2.2.5 制定的验证方案不可行,与实际生产不一致药品生产企业均制定了验证总体计划和年度验证计划,根据验证对象制定了验证方案并组织实施,但验证或确认的深度和广度缺少基于风险的科学方法。未能针对实际生产风险点进行风险分析;验证方案的设定未能涵盖实际工艺参数或与实际操作方式不一致;验证结束后未对验证数据进行汇总分析;虽然起草了验证报告和结论,但验证原始数据归档不全、分析内容不完整。
3 对做好药品GMP工作的建议2014年下半年至今,行业内部对数据可靠性的重视程度日渐提高。英国药监局(MHRA)、世界卫生组织(WHO)相继发布《GMP数据完整性定义和行业指导原则》《良好数据和记录管理实践指南》。我国对于数据可靠性也非常重视,2015年12月,国家食品药品监督管理总局(以下简称“国家总局”)发布了《计算机化系统附录》[3-4],对企业数据的可靠性提出了更高要求。2016年10月,国家总局审核查验中心公开征求《药品数据管理规范》的意见。上述规范、附录的发布,为GMP检查员及药品生产企业统一认识、搭建数据及记录管理体系提供了重要参考,同时也对企业实施药品GMP提出了更高的要求。
为使企业能够完善日常生产管理和质量管理,促进我省医药行业的发展,提出以下几个方面的建议供企业参考[5]:
3.1 进行有针对性的培训,避免形式化企业在GM P培训方面应根据自身的实际情况,科学制定培训计划,有组织、有针对性地开展培训工作,重视培训效果的评估;对药品GMP实施过程中的薄弱环节,如风险管理、偏差、变更等内容应进行系统培训,确保员工在生产和质量管理过程中能熟练运用;培训应以制度化、规范化管理为目的,充分调动员工的主观能动性[6-7]。将理论培训与实践培训相结合,针对员工的薄弱点进行系统性、规范性、针对性培训,切实提高培训效率。
3.2 领悟药品GMP精髓,文件体系系统化文件管理是质量管理系统的基本组成部分,文件和记录是质量保证系统的基本要素,与生产、质量、储存、运输等相关的所有活动都应在文件体系中明确规定[8]。文件应按照操作规程进行管理,内容清晰易懂,并有利于追溯每批产品的历史情况。企业在完善文件架构方面应注意以下问题:(1)切实加强文件的系统性,如不同规程之间是否相互矛盾,是否存在岗位操作规程与工艺规程不一致的情况等。建议企业以产品为主线,以风险管理为切入点,捋顺文件体系,加强文件管理的系统性,有效指导实际生产[9-11]。(2)完善记录的合理性,如合理设计批生产记录,依据产品生产工艺设定关键工序、关键工艺参数记录栏,使原始记录充分发挥作用,在出现偏差时能够为控制产品质量、保证数据可靠性提供重要依据[12]。
3.3 强化验证管理,提升持续工艺确认理念验证一直被认为是药品生产企业实施GMP认证过程中的薄弱环节。近年来,由于药品GMP认证的实施、国外机构如FDA/WHO认证、各类验证指导用书的出版等,极大地提高了生产企业的验证管理水平。但从目前的现场检查情况看,企业还应从以下几个方面强化验证管理:(1)要充分认识验证工作的重要性,根据生产和质量管理的实际情况如生产工艺、原辅料的变更以及产品质量年度回顾审核结果等,科学制定验证计划、编制验证方案,注重验证原始数据的搜集、分析和评价以及验证过程中的偏差处理等,做好验证文件的归档保存工作[13-14]。(2)验证内容除厂房设施、设备、生产工艺、分析方法等日常的验证工作外,还应结合剂型特点,如原料药工艺复杂、合成路线长,培养基模拟灌装最差条件等实际情况,有针对性地开展验证。如存在多个产品共用生产设施、设备的情况,应充分评估其存在的风险,并验证确认现有的清洁方法能有效防止污染和交叉污染;原料药生产中涉及溶剂回收使用的,应根据回收溶剂的用途制定恰当的质量标准、监控回收溶剂中杂质的含量,通过验证确认溶剂的回收方法及回收的溶剂用于原料药生产的可行性[15-16];对于特殊储存条件的产品,应验证其转运环节的保存方式能否满足其贮存条件,并对整个转运过程中的温湿度进行监控和记录。
4 结语药品GM P是不断发展的,企业应按照药品GMP(2010年修订)标准,结合自身的实际情况,规范各项生产质量管理活动,持续完善质量管理体系,把文件系统、验证系统等方面的要求落在实处,确保始终如一地生产出符合预定用途和注册要求的产品。
| [1] |
中华人民共和国卫生部. 卫生部令第79号药品生产质量管理规范(2010年修订)[S]. 2011.
|
| [2] |
国家食品药品监督管理局. 关于贯彻实施《药品生产质量管理规范(2010年修订)》的通知[EB/OL]. (2011-02-25)[2014-03-20]. http:/www.sda.gov.cn/WS01/CL0844/59017.html.
|
| [3] |
国家食品药品监督管理局. 2012年第72号关于发布《药品生产质量管理规范(2010年修订)》放射性药品附录的公告[S]. 2012.
|
| [4] |
国家食品药品监督管理总局. 2015年第54号关于发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告[S]. 2015.
|
| [5] |
国家食品药品监督管理局药品认证管理中心. 药品GMP指南[M]. 北京: 中国医药科技出版社, 2011.
|
| [6] |
罗京京, 胡士高, 陈菡, 等. 2012年安徽省药品生产企业GMP跟踪检查及飞行检查缺陷项目分析[J]. 安徽医药, 2014, 18(3): 585-588. |
| [7] |
邹毅, 饶翠芬, 吴生齐, 等. 制药企业2010版药品GMP培训分析与建议[J]. 药学教育, 2014, 30(3): 53-55. |
| [8] |
毕军, 邹毅. 中美药品GMP检查体系对比分析[J]. 中国药事, 2013, 27(6): 578-583. |
| [9] |
王艳玲. 借鉴国外经验完善我国GMP体系[J]. 黑龙江医药, 2012, 25(5): 711-712. |
| [10] |
李玲, 颜建周, 邵蓉. 我国2010年新修订GMP与国外典型GMP的体系比较[J]. 中国新药杂志, 2014, 23(5): 505-509. |
| [11] |
周艳, 马娟. 浅谈实施新版GMP存在的问题及对策[J]. 中国药事, 2015, 29(4): 350-352. |
| [12] |
欧盟药品生产质量管理规范[S/OL]. (2011-02-11)[2016-09-10]. http://ec.europa.eu/health/documents/eudralex/vol-4/index_en.htm.
|
| [13] |
刘艳春. 药品生产企业在新版GMP检查中存在的问题及改进措施[J]. 机电信息, 2016, 11(11): 17-20. |
| [14] |
李歆. 制药企业设施设备GMP验证方法与实务[M]. 北京: 中国医药科技出版社, 2012.
|
| [15] |
张春蕾, 刘智勇. 辽宁省原料药生产企业新版GMP认证检查缺陷分析与对策[J]. 中国药房, 2015, 25(37): 3460-3463. |
| [16] |
王远志, 王璐, 史博, 等. 确认与验证[M]. 药品生产质量管理规范(2010年修订)检查指南, 沈阳: 辽宁科学技术出版社, 2011: 68-84.
|
 2017, Vol. 31
2017, Vol. 31 