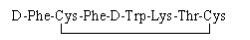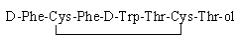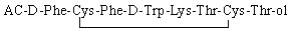奥曲肽(Octreotide)为8个氨基酸组成的环状多肽化合物(见图 1),是生长抑素类似物[1-3],醋酸奥曲肽主要与肿瘤细胞或其他组织细胞膜表面上所表达的生长抑素受体高亲和性、特异性的结合,抑制垂体生长激素以及胃肠胰腺系统分泌多肽类激素,临床使用其醋酸盐[4-6]。其不良反应:循环系统主要为心律失常、血压升高、心绞痛、血压降低等;消化系统主要为胆囊肿大、食欲不振、呕吐及腹泻腹痛等;变态反应主要为过敏反应和过敏性休克;其他不良反应有血小板降低、四肢麻木、血糖降低、注射部位疼痛等[7-10]。
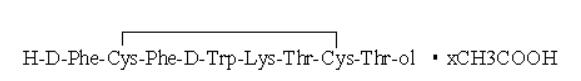
|
图 1 醋酸奥曲肽结构式 |
目前国内批准上市的奥曲肽制剂为醋酸奥曲肽注射液及注射用醋酸奥曲肽。醋酸奥曲肽注射液的生产企业为19家,批准文号23个,有5个规格:(1 mL:0.05 mg)、(1 mL:0.1 mg)、(1 mL:0.15 mg)、(1 mL:0.2 mg)、(1 mL: 0.3 mg);注射用醋酸奥曲肽的生产企业为9家,批准文号9个,有2个规格:0.1 mg及0.3 mg。《中国药典》2010年版二部[11]及《中国药典》2015年版二部[12]均收载其原料、注射液及注射用样品,其余各国药典均未收载。
醋酸奥曲肽于2015年首次被列为国家药品评价性抽验项目,本次评价共完成70批醋酸奥曲肽注射液及21批注射用醋酸奥曲肽的法定方法检验,并在此基础上开展了一系列探索性研究。这对进一步提高国产醋酸奥曲肽的质量,保证用药安全等方面具有重要意义。
1 仪器与试药 1.1 仪器Agilent 1260液相色谱仪,紫外检测器;Waters 2695高效液相色谱仪,Waters 2487紫外检测器,Waters 2996二极管阵列检测器,Empower色谱工作站;Thermo-XSEries2 ICP-MS(Thermo公司);Sartorius BP211D电子天平;Orion Star pH计(Thermo公司);Millipore去离子水发生装置(德国Merck Millipore);MJ-I.180霉菌培养箱(上海跃进医疗器械有限公司);SMC渗透压摩尔浓度测定仪(天津天河医疗仪器有限公司);202-1-BS电热恒温干燥箱(上海跃进医疗器械有限公司);YB-2型澄明度检测仪(天大天发科技有限公司);CEM Mars XP微波消解仪(美国CEM公司)。
1.2 标准物质醋酸奥曲肽标准物质(中国食品药品检定研究院,批号为140730-201303);脱苏氨醇8奥曲肽标准物质(中国食品药品检定研究院,批号为140795-201001);醋酸标准品:Acetic acid(Sigma-alorich,99.7%);L-乳酸标准品:L-(+)-Lactic acid(Sigma-alorich,98%);D-乳酸标准品:D-(-)-Lactic acid(Sigma-alorich,100%);铝、钡、铁、锡、铬、铅、镉、砷、汞、铜各单元素标准溶液(1000μg·mL-1,国家标准物质研究中心)。
1.3 样品3批醋酸奥曲肽原料(A公司,批号为1501001、1501002、1504005);3批醋酸奥曲肽原料(B公司,批号为140503、141201、150101);醋酸奥曲肽注射液(2015年国家评价性抽验样品,来源于11家企业,70批次,规格1 mL:0.05 mg、1 mL:0.1 mg、1 mL:0.15 mg、1 mL:0.2 mg及1 mL:0.3 mg);注射用醋酸奥曲肽(2015年国家评价性抽验样品,来源于6家企业,21批次,规格0.1 mg及0.3 mg);对照用醋酸奥曲肽注射液(C公司,批号为S0369,规格0.1 mg·mL-1)。
1.4 试剂2, 6-叔丁基-4-甲基-苯酚(BHT)(Sigma-Alorich,纯度99.0%);10%四甲基氢氧化铵、磷酸、磷酸氢二铵、硫酸酮、硝酸均为分析纯;甲醇、乙腈、异丙醇均为色谱纯;水为超纯水。
2 试验方法 2.1 法定检验方法醋酸奥曲肽注射液法定标准为《中国药典》2010年版第二增补本/2015年版二部、注册标准YBH01082013、YBH01812010及YBH03682010。
注射用醋酸奥曲肽法定标准为《中国药典》 2010年版第二增补本/2015年版二部、注册标准YBH03642010及YBH06802008。
2.2 探索性研究方法1)标准:有关物质、稳定性中含量及有关物质、相容性中含量及有关物质方法均采用《中国药典》 2010年版第二增补本/2015年版二部中含量及有关物质方法,不同的是对脱苏氨醇8奥曲肽杂质进行单独控制,不列在最大单杂内。
2)醋酸盐测定方法:Agilent ZORBAX SB-Aq C18(4.6 mm×250 mm,5 μm)色谱柱,流动相A为0.01mol/L磷酸氢二铵溶液(用磷酸调节pH值至2.5),流动相B为甲醇,梯度洗脱,流速0.6 mL·min-1,检测波长210 nm,柱温27℃,进样量10 μL。
3)辅料乳酸测定方法:Phenomenex Chirex 3126(D)-penicillami(4.6 mm×250 mm)手性柱,流动相为2 mmol·L-1CuSO4溶液(溶剂为2%异丙醇溶液),流速1.0 mL·min-1,检测波长230 nm,柱温35℃,进样量10 μL。
4)抗氧剂2, 6-叔丁基-4-甲基-苯酚测定方法:AltimaTM C18(L)(4.6 mm×250 mm,5 μm)色谱柱,流动相为乙睛-水(77 : 23),流速1.0 mL·min-1,UV检测波长208 nm,柱温30℃。
3 法定检验结果分析70批醋酸奥曲肽注射液及21批注射用醋酸奥曲肽依据法定标准检验,均符合规定,合格率100.0%。部分检验结果如下。
3.1 有关物质 3.1.1 醋酸奥曲肽注射液70批醋酸奥曲肽注射液单个杂质均不大于1.5%,杂质总量均不大于2.0%,总体有关物质状况良好。不同企业的注射液,其单个杂质间及杂质总量间均有差异,分析原因为企业间生产工艺不同导致有关物质有差异。不同企业的醋酸奥曲肽注射液有关物质结果见表 1。
|
|
表 1 各企业醋酸奥曲肽制剂有关物质及平均含量测定结果 |
21批注射用醋酸奥曲肽单个杂质均不大于1.6%,杂质总量均不大于2.0%。不同企业的注射用样品,其单个杂质间及杂质总量间差异均较大,分析原因为企业间生产工艺不同导致有关物质差异较大;此外对其有关物质的杂质总量与水分结果进行统计学双变量相关分析,结果表明杂质总量与水分呈正相关(P<0.01),不同企业间水分差异较大也导致有关物质差异较大。不同企业的注射用醋酸奥曲肽有关物质结果见表 1。
3.2 含量测定 3.2.1 醋酸奥曲肽注射液70批醋酸奥曲肽注射液含量结果为95.2%~106.4%,均值为101.3%,结果呈正态分布,见表 1。除2家企业外,其余注射液企业的样品含量RSD%均在1.5%以下,表明大部分企业的醋酸奥曲肽注射液含量分布比较集中,生产工艺稳定。
3.2.1 注射用醋酸奥曲肽21批注射用样品含量结果为93.9%~104.4%,均值为99.9%,结果呈正态分布,见表 1。各企业的注射用醋酸奥曲肽含量RSD均在2.5%以下,表明各企业注射用醋酸奥曲肽的含量分布均比较集中,生产工艺稳定。
4 探索性研究结果分析通过文献检索、去原料及制剂生产企业调研、对现行标准检验结果分析,了解了醋酸奥曲肽原料及其制剂的生产工艺及其他与本品质量相关的信息,进一步开展了有关物质、制剂稳定性、醋酸盐、辅料乳酸、渗透压、相容性等探索性研究,以期发现药品在生产工艺、稳定性、包材等各方面存在的问题,使药品质量真正得到提高。
4.1 有关物质 4.1.1 制剂总杂质谱对此次国家药品抽验的91批醋酸奥曲肽制剂有关物质测定结果进行统计分析,见图 2,结果显示其主要杂质为21个,其中杂质1、杂质10及杂质17含量均较高,杂质7为脱苏氨醇8奥曲肽。脱苏氨醇8奥曲肽含量为0.01%~0.4%,其余单杂为0.1%~0.6%,杂质总量为0.2%~1.9%。
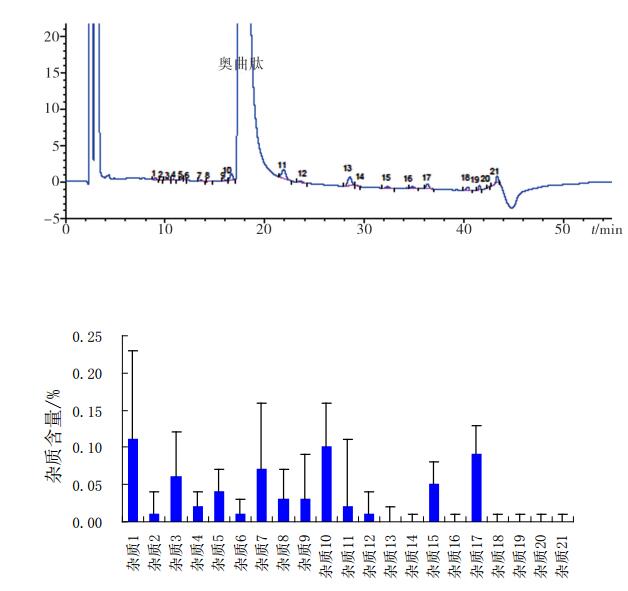
|
图 2 醋酸奥曲肽有关物质的色谱行为与量的关系图 |
分别对70批醋酸奥曲肽注射液及21批注射用醋酸奥曲肽有关物质测定结果进行统计分析。醋酸奥曲肽注射液主要杂质为杂质1~10、杂质15及杂质17,其中杂质1、杂质10及杂质17含量较高;不同企业间的注射液样品杂质含量差异较大。注射用醋酸奥曲肽杂质的个数较醋酸奥曲肽注射液多,含有21个杂质,其中杂质10含量较大;不同企业间的注射用样品杂质含量差异较大。表明不同企业间的醋酸奥曲肽生产工艺有差异,见图 3。

|
图 3 醋酸奥曲肽制剂有关物质含量分布图 |
对照用醋酸奥曲肽注射液有关物质测定结果显示,其杂质的个数比其他企业的注射液多,但比注射用醋酸奥曲肽少;除1批注射液及1批注射用样品外,对照注射液杂质总量比国内企业的样品都高,特别是脱苏氨醇8奥曲肽杂质(杂质7)高于其他企业的所有样品。对照注射液脱苏氨醇8奥曲肽含量为0.8%,其余单个杂质为0.1%,杂质总量为1.5%。表明大部分企业的醋酸奥曲肽制剂的杂质情况优于对照的醋酸奥曲肽注射液。
4.1.4 贮藏过程对杂质的影响对同一企业的2010年及2015年生产的在法定标准规定条件下贮存的醋酸奥曲肽注射液进行有关物质分析。结果2010年生产的注射液其脱苏氨醇8奥曲肽、单杂及杂质总量结果均高于2015年生产的注射液,表明贮藏过程可导致醋酸奥曲肽注射液的杂质增加。
此外,对91批醋酸奥曲肽制剂的杂质总量与剩余效期进行Pearson统计学相关分析,结果醋酸奥曲肽制剂的杂质总量与剩余效期呈负相关(P<0.05),剩余效期越短其杂质总量越高。进一步表明贮藏过程可导致醋酸奥曲肽注射液的杂质增加。
4.1.5 杂质的结构确证依据醋酸奥曲肽的合成路线及可能的降解途径,合成了一系列的杂质单体。将这些杂质单体分别加入到醋酸奥曲肽制剂中进行杂质定位,共确证了6个杂质。再结合影响因素试验结果,推测杂质来源,结果杂质7为脱苏氨醇8奥曲肽,为主要的降解杂质,杂质15为原料代入,其余均为降解产生。
|
|
表 2 醋酸奥曲肽杂质的结构式 |
按照醋酸奥曲肽制剂有效期及处方组成的不同,将不同企业的4批醋酸奥曲肽注射液,2批注射用醋酸奥曲肽及1批对照的醋酸奥曲肽注射液分别在高温60℃、高湿90%±5%及强光4500lx±500lx下放置10天,于第5天和第10天取样,考察其有关物质的变化情况。
高温试验结果显示,各企业样品的杂质7脱苏氨醇8奥曲肽均增加明显,杂质总量均增加。杂质谱分析发现,注射液样品杂质总量的增加主要源于杂质7脱苏氨醇8奥曲肽的增加,而注射用醋酸奥曲肽除杂质7增加外,杂质8、杂质9、杂质11、杂质16均增加。含量方面,各企业样品的含量均降低,但注射用样品含量降低显著且第10天含量均低于90.0%,其中1批含量降幅约为50%。
高湿试验结果显示,注射用醋酸奥曲肽的杂质7及杂质总量均增加。杂质谱分析发现,注射用样品杂质7、杂质11及杂质12增加明显,其余杂质在实验误差范围内基本无变化。各企业样品的含量均降低,但变化均在90.0%~110%限度范围内。
强光照射试验结果显示,各企业样品的杂质总量均增加,但杂质7脱苏氨醇8奥曲肽基本无变化。杂质谱分析发现,各样品的杂质1、杂质3、杂质4、杂质8及杂质9均有明显增加,其中杂质1增加最显著。含量方面,各企业样品的含量均降低,除1批注射液样品第10天含量为87.4%外,其余企业的样品含量变化均在90.0%~110%限度范围内。
综上所述,国内企业的醋酸奥曲肽制剂及对照的醋酸奥曲肽注射液均对高温及强光不稳定,注射用醋酸奥曲肽对高湿不稳定且对高温稳定性特别差。杂质7脱苏氨醇8奥曲肽、杂质11均为高温及高湿降解产物;杂质8及杂质9均为高温及光降解产物;杂质16为高温降解产物,杂质12为高湿降解产物,杂质1、杂质3及杂质4均为光降解产物。国内企业的醋酸奥曲肽注射液与对照的醋酸奥曲肽注射液影响因素试验杂质谱变化行为基本一致,而注射用醋酸奥曲肽产生了更多的杂质。
4.3 醋酸盐奥曲肽与醋酸盐形成醋酸奥曲肽,成盐的不完全会影响其吸收,进而影响其有效性[13-14]。此外醋酸盐是肽类物质较稳定的一种成盐形式。因此控制醋酸奥曲肽中醋酸盐的含量很有意义。
70批醋酸奥曲肽注射液的醋酸盐含量为10.6%~15.4%,均值为11.7%;21批注射用醋酸奥曲肽的醋酸盐含量:未检出至4.2%,均值为1.6%,均远远低于其原料标准下规定的范围5.0%~12.0%;1批对照的醋酸奥曲肽注射液的醋酸盐含量为12.5%。典型色谱图见图 4。
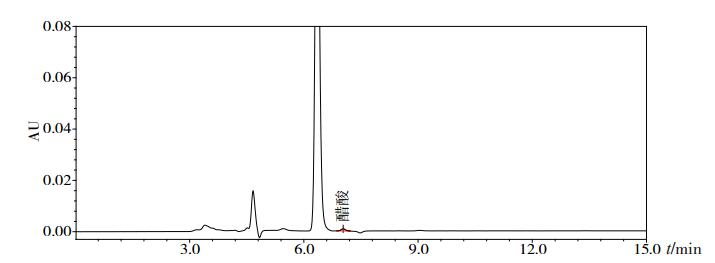
|
图 4 醋酸奥曲肽制剂的醋酸盐HPLC色谱图 |
注射用样品的醋酸盐含量很低,分析原因为注射用样品的冷冻干燥生产工艺所致。冷冻干燥工艺为预冻至-40℃后保温2~4小时,然后抽真空冻干,在20小时内温度由-40℃升华至20~45℃,最后在此温度下保持近10个小时。在从-40℃迅速升华到45℃过程中水分挥发使溶液的pH值降低,当pH值低于醋酸的pKa(pKa为4.75)时,醋酸盐形成易挥发性的醋酸挥发而导致醋酸盐含量降低。这方面已与生产企业沟通,并对样品进行冷冻干燥前及干燥后的醋酸盐测定,结果冷冻干燥后醋酸盐结果比干燥前显著降低。
4.4 辅料乳酸乳酸有L型、D型及LD混合型3种。乳酸的构型不同可导致的不良反应不同,主要表现在耐受性方面。此外,WHO对人体每天摄取D-乳酸的量有限制,原因为人体内只有代谢L-乳酸的酶,过量摄入D-乳酸及LD-乳酸会导致代谢紊乱甚至酸中毒[15]。
对辅料为乳酸的66批醋酸奥曲肽注射液、7批注射用醋酸奥曲肽及1批对照注射液进行乳酸测定,典型色谱图见图 5。结果注射液样品的L-乳酸含量为0.7 mg·mL-1~2.4 mg·mL-1,D-乳酸含量为0.01 mg·mL-1~0.04 mg·mL-1;注射用样品的L-乳酸含量为0.8 mg·mL-1~3.0 mg·mL-1,D-乳酸含量为0.01 mg·mL-1~0.04 mg·mL-1;对照用注射液的L-乳酸含量为2.5 mg·mL-1,未检出D-乳酸。国内企业的注射液及注射用样品L-乳酸含量与对照注射液基本一致,但其他企业的样品均检出D-乳酸,而对照未检出。

|
图 5 醋酸奥曲肽制剂的辅料乳酸HPLC色谱图 |
醋酸奥曲肽均为注射剂,分析国内外不同企业样品渗透压的差异,对评价生产工艺的稳定性及其对产品质量的影响有一定意义。
注射液与注射用样品中,国内同一企业不同批次的样品渗透压基本一致;除个别企业的渗透压偏低外,其余不同企业间的样品渗透压基本一致;国内大部分企业样品与对照注射液渗透压基本一致。结果表明,制剂的渗透压与处方组成及处方中甘露醇的量相关,处方组成为甘露醇与乳酸的样品其渗透压较处方组成为甘露醇与枸橼酸的高,甘露醇的量较多的样品其渗透压也较高。
4.6 相容性分析国内不同企业的醋酸奥曲肽注射剂包材有差异,未覆膜胶塞、覆膜胶塞、低硼硅玻璃及中硼硅玻璃均有采用。因此,对醋酸奥曲肽与包材的相容性进行考察,分析包材是否对其质量有影响。
将西林瓶包装的国内企业的2批醋酸奥曲肽注射液及2批注射用醋酸奥曲肽,在60℃下分别正置与倒置5天,以pH值、溶液的澄清度、颜色、含量、有关物质及抗氧剂2, 6-叔丁基-4-甲基-苯酚(BHT)迁移为指标,考察其与包材的相容性。此外,再分别对所抽的11个企业的注射液样品、6个企业的注射用样品及原研注射液分别测定铝、钡、铁、锡、铬、铅、镉、砷、汞、铜的金属离子迁移量,考察不同包材的金属离子迁移情况。
结果,西林瓶包装的样品中,未覆膜胶塞及覆膜胶塞对醋酸奥曲肽的pH值、澄清度、颜色、含量及有关物质结果均无影响;胶塞中的BHT会迁移至样品中,但2种胶塞的BHT迁移量无差异;国内企业的样品中,使用中硼硅玻璃的样品其铝、钡、铁、锡、铬、铅、镉、铜金属离子迁移量均较使用低硼硅玻璃的样品低,其余金属离子迁移量基本一致;对照注射液为中硼硅玻璃,其铝、钡、铁、铅、镉、砷、铜金属离子迁移量均较低。表明中硼硅玻璃的金属离子迁移量较低硼硅玻璃低。
5 讨论1)本次评价性抽验采取法定检验结合探索性研究的形式,对醋酸奥曲肽制剂多方面进行了分析及评价。法定标准检验结果表明,目前国内企业生产的醋酸奥曲肽制剂均符合现行质量标准的要求。结合探索性研究,国内企业的醋酸奥曲肽制剂有关物质总体较对照的注射液好,但在辅料乳酸、包材等方面均不及原研注射液,特别是注射用醋酸奥曲肽中醋酸含量很低甚至未检出,且对照制剂生产企业无此剂型,注射用醋酸奥曲肽剂型的合理性需要再评价。
2)有关物质方面,国内同一企业相同剂型不同批次的制剂杂质谱基本一致,相同剂型不同企业间的制剂杂质谱有差异,差异主要来源于企业间制剂生产工艺的差异。同一企业生产的注射用醋酸奥曲肽有关物质较醋酸奥曲肽注射液高,原因为注射用剂型的冷冻干燥生产工艺导致。国内醋酸奥曲肽制剂的杂质个数及杂质含量均多于原料,制剂的杂质主要来源于制剂的生产及贮藏过程。国内企业的制剂有关物质总体低于对照的醋酸奥曲肽注射液。
3)国内醋酸奥曲肽注射液的醋酸盐含量与对照企业的注射液样品基本一致,但注射用样品的醋酸盐含量很低,有的甚至未检出。注射用醋酸奥曲肽的冷冻干燥生产工艺可导致醋酸盐含量大大降低,而是以其他盐形式存在,其稳定性也降低。
4)醋酸奥曲肽法定检验标准为《中国药典》2010年版第二增补本、《中国药典》2015年版二部与注册标准,他们在一些项目设置、限度及检测方法上存在一定差异。
| [1] |
刘志峰, 李萍, 刘珂. 奥曲肽的研究和应用进展[J]. 青岛大学医学院学报, 2001, 37(2): 165-167. |
| [2] |
王蕾, 许晶, 宋岩. 奥曲肽的临床应用进展[J]. 华北国防医药, 2009, 21(5): 26-27. |
| [3] |
Bauer W, Briner U, Doepfner W, et al. SMS 201-995:A Very Potent and Selective Octapeptide Analogue of Somatostatin with Prolongact Ion[J]. Life Sciences, 1982, 31: 1133-1140. DOI:10.1016/0024-3205(82)90087-X |
| [4] |
杨宁, 许红波, 李兆申, 等. 生长抑素类似物奥曲肽的临床应用[J]. 新药与临床, 1994, 13(1): 31-33. |
| [5] |
孙晓红, 陈兴田, 杨树国, 等. 奥曲肽的临床应用[J]. 临床荟萃, 1998, 13(23): 1080-1081. |
| [6] |
朱校勇, 裴的善. 奥曲肽的临床应用[J]. 天津药学, 2007, 19(3): 59-62. |
| [7] |
王涌, 彭承宏. 奥曲肽经动脉给药安全性初步临床研究[J]. 药物不良反应杂志, 2002(1): 9-11. |
| [8] |
陈丽芳, 黄淑萍. 53例奥曲肽不良反应文献分析[J]. 中国医院药学杂志, 2008, 28(18): 1626-1628. DOI:10.3321/j.issn:1001-5213.2008.18.041 |
| [9] |
付蔷, 李光学. 奥曲肽所致不良反应的一般规律及特点回顾性分析[J]. 中国医药指南, 2012, 10(35): 273-274. DOI:10.3969/j.issn.1671-8194.2012.35.221 |
| [10] |
尤海生, 任晓东, 张玮. 奥曲肽2例严重不良反应分析[J]. 中国医院药学杂志, 2012, 32(21): 1779-1780. |
| [11] |
中国药典: 二部[S]. 2010: 1133-1134.
|
| [12] |
中国药典: 二部[S]. 2015: 1545-1546.
|
| [13] |
吕海鸿, 廖海明, 李勇, 等. RP-HPLC法测定酪丝亮肽中醋酸的含量[J]. 药物分析杂志, 2004, 24(3): 286-289. |
| [14] |
高春, 高恒莹, 姚瑛, 等. 高效液相色谱法测定醋酸奥曲肽中醋酸含量[J]. 中国生化药物杂志, 2004, 25(4): 237-238. |
| [15] |
王立梅, 齐斌. L-乳酸应用及生产技术研究进展[J]. 食品科学, 2007, 28(10): 608-612. DOI:10.3321/j.issn:1002-6630.2007.10.154 |
 2017, Vol. 31
2017, Vol. 31