2. 吉林省博大伟业制药有限公司, 长春 130000
2. Jilin Province Broad Well Pharmaceutical Co., Ltd., Changchun 130000, China
达比加群酯(dabigatran etexilate)是由德国勃林格殷格翰公司研发的一种直接凝血酶抑制剂,于2008年在德国和英国率先上市,2010年首先获得FDA批准用于非瓣膜房颤患者的卒中和全身栓塞预防,是达比加群的前药,属于非肽类凝血酶抑制剂,口服后在体内转化成有活性的达比加群,与凝血酶的纤维蛋白特异位点结合,阻止纤维蛋白原裂解为纤维蛋白,从而阻断凝血瀑布网络的最后步骤及血栓形成,达比加群酯还可用于成人膝关节和髋关节置换手术后静脉栓塞的预防等[1-2]。在达比加群酯合成中[3-4],涉及甲醇、乙醇、乙酸乙酯、丙酮、二氯甲烷、正己烷、四氢呋喃、异辛烷、吡啶和甲苯10种溶剂,根据药品杂质分析指导原则,残留溶剂作为杂质限量检查是质量控制指标之一[5-9]。本文建立了气相色谱方法对达比加群酯的残留溶剂进行检测,能同时检测10种残留溶剂,方法简便、快速,并且灵敏度高,检测结果准确可靠,可以作为达比加群酯中残留溶剂的控制检测方法。
1 仪器与试剂GC-2010Plus(GC solution液相色谱数据工作站,岛津公司);顶空进样器(DK-300A,北京中兴汇利);毛细管色谱柱Rtx-1(60 m×0.32mm×1.0μm,Restek公司);电子天平(BT-125D,Sartorius)。
达比加群酯原料药(吉林省博大伟业制药有限公司,批号:20150601、20150602、201510603);甲醇(分析级,北京化工厂,批号:20160215);乙醇(分析级,北京化工厂,批号:20150514);乙酸乙酯(分析级,北京化工厂,批号:20150908);丙酮(分析级,北京化工厂,批号:20141218);二氯甲烷(分析级,北京化工厂,批号:20150518);正己烷(分析级,北京化工厂,批号:20150816);四氢呋喃(分析级,北京化工厂,批号:20150516);异辛烷(分析级,北京化工厂,批号:20150712);吡啶(分析级,北京化工厂,批号:20151005);甲苯(分析级,北京化工厂,批号:20150826);丁酮(分析级,北京化工厂,批号:20150712);DMF(分析级,北京化工厂,批号:20151102)。
2 方法和结果 2.1 色谱条件采用Rtx-1(60 m×0.32 mm×1.0 μm)毛细管色谱柱,程序升温:67 ℃保持10 min,以每分钟2 ℃的升温速率升至90 ℃,保持5 min,再以每分钟6 ℃的升温速率升至150 ℃,保持5 min;分流进样,进样口温度200 ℃,分流比:1︰7.5;柱流量:1.5 mL·min-1;顶空进样量:1.0 mL;顶空瓶平衡温度90 ℃,平衡时间为30 min。
2.2 溶液的配制 2.2.1 内标溶液的配制取丁酮适量,精密称定,用DMF定量稀释,制成含丁酮0.5%的DMF溶液,作为内标液。
2.2.2 供试品溶液的配制取本品约0.5 g,精密称定,置顶空瓶中,精密加入内标液5 mL,使溶解,密封,作为供试品溶液。
2.2.3 对照品溶液的配制精密称取甲醇300 mg、乙醇500 mg、丙酮500 mg、二氯甲烷60 mg、乙酸乙酯500 mg、正己烷29 mg、四氢呋喃72 mg、异辛烷500 mg、吡啶20 mg和甲苯89 mg,置50 mL量瓶中,以内标溶液稀释至刻度,摇匀,作为标准储备液;精密量取5.0 mL标准储备液,置100 mL量瓶中,加内标溶液稀释至刻度,摇匀,即得每1 mL中含甲醇0.3 mg、乙醇0.5 mg、丙酮0.5 mg、二氯甲烷0.06mg、乙酸乙酯0.5 mg、正己烷0.029 mg、四氢呋喃0.072 mg、异辛烷0.5 mg、吡啶0.02 mg、甲苯0.089 mg的溶液;精密量取5 mL置顶空瓶中,密封,作为对照品溶液。
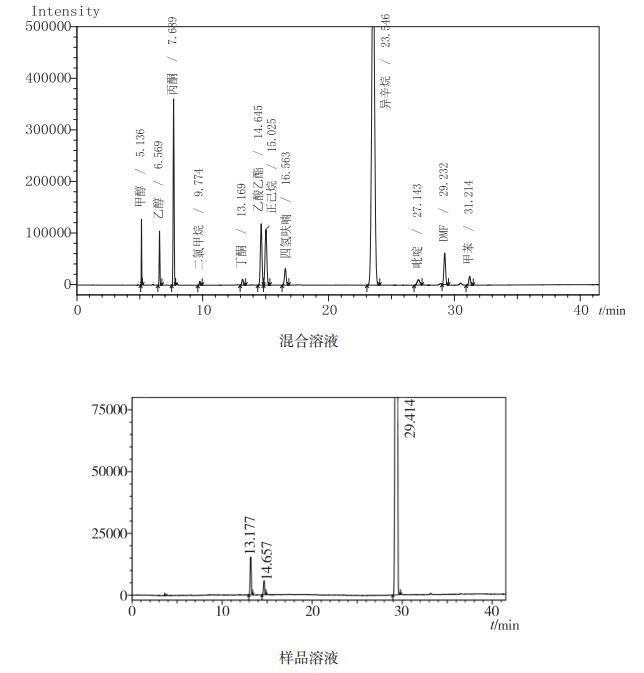
2.3 专属性精密量取DMF 5 mL,置顶空瓶中,密封,作为空白溶剂定位溶液;分别精密称取甲醇、乙醇、丙酮、二氯甲烷、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶、甲苯和丁酮适量,加DMF稀释成适当浓度的溶液,置顶空瓶中,密封,作为定位溶液;另取上述11种有机溶剂各适量,混溶,加DMF至5 mL,作为混合溶液。按“2.1”节色谱条件进行测定,结果见图 1。结果显示,溶剂峰的出峰顺序依次为甲醇、乙醇、丙酮、二氯甲烷、丁酮、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶、DMF、甲苯,样品溶液的出峰顺序为丁酮、乙酸乙酯和DMF,空白溶剂不干扰样品测定,各溶剂峰之间分离度均大于1.5,专属性好。
|
图 1 气相色谱图 |
分别取甲醇、乙醇、丙酮、二氯甲烷、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶和甲苯适量,用DMF稀释至不同浓度。按上述色谱条件进样,主成分信噪比为10︰1及3︰1时的进样浓度分别为定量限及检测限。10种溶剂的定量限依次为6.000、10.020、5.000、40.640、15.135、1.017、1.118、4.620、2.350、15.405 μg·mL-1,检测限依次为2.000、3.006、1.500、12.192、4.541、0.305、0.335、1.940、0.805、4.622 μg·mL-1。
2.5 线性关系考察精密称取丁酮125 mg于250 mL量瓶中,加D M F定容至刻度,作为内标液。精密量取“2.2.3”节标准储备液10.0 mL,置100 mL量瓶中,加内标溶液稀释至刻度,摇匀,作为线性储备液;精密量取线性储备液1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,分别置10 mL量瓶中,以内标溶液稀释至刻度。
按“2.1”节色谱条件进行测定,记录色谱图,以浓度为横坐标,以甲醇、乙醇、丙酮、二氯甲烷、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶、甲苯与丁酮峰面积的比值为纵坐标,进行线性回归。结果表明10种有机溶剂在所测定的浓度范围内线性关系良好,见表 1。
|
|
表 1 线性试验结果 |
分别精密量取上述线性储备液5份,各5 mL,于10 mL量瓶中,加内标溶液稀释至刻度,摇匀。按“2.1”节色谱条件进行测定,记录色谱图。分别计算甲醇、乙醇、丙酮、二氯甲烷、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶、甲苯与丁酮峰面积比值,计算RSD,结果依次为0.88%、1.87%、0.94%、2.19%、2.27%、3.28%、1.38%、1.79%、1.76%、2.34%,表明仪器精密度良好。
2.7 重复性试验分别精密称取供试品(批号:20150601)6份,按“2.2.2”节方法配制供试品溶液;另精密称取甲醇、乙醇、丙酮、二氯甲烷、乙酸乙酯、正己烷、四氢呋喃、异辛烷、吡啶和甲苯适量,按“2.2.3”节方法配制对照品溶液。按“2.1”节色谱条件,分别取供试品溶液与对照品溶液顶空进样,记录色谱图,按内标法计算各溶剂残留量,结果见表 2,表明本法重复性良好。
|
|
表 2 重复性试验结果(n=6) |
称取供试品1.0 g,置10 mL量瓶中,加入“2.5”节的线性储备液4.0、5.0、6.0 mL,各3份,加内标液稀释至刻度,摇匀,作为低、中、高3种浓度的溶液(分别为限量浓度的8 0 %、100%、120%),另按“2.2.3”节方法配制2份对照品溶液;按“2.1”节色谱条件,分别取供试品溶液与对照品溶液顶空进样,记录色谱图,按内标法计算回收率,测定结果如表 3,表明回收率良好。
|
|
表 3 加样回收率试验结果 |
取3批中试样品,按“2.2.2”节方法配制供试品溶液,按“2.1”节色谱条件进行测定,记录峰面积,按内标法以峰面积计算含量,结果见表 4。
|
|
表 4 样品测定结果(n=3) |
本方法中使用DMF为溶剂,该溶剂未在达比加群酯的合成中使用,并且10种溶剂在DMF中均有较好的溶解度,所以选用DMF为溶剂,而不是沸点高的DMSO。
3.2 色谱柱的选择根据待测溶剂的极性差异,分别对R t x -1(60 m×0.32 mm×1.0 μm)色谱柱、ZB-624(30 m×0.32 mm×1.8 μm)色谱柱和ZB-5(30 m×0.25 mm×0.25 μm)色谱柱进行了考察,结果表明采用Rtx-1(60 m×0.32 mm×1.0μm)色谱柱进行检测时,各组分能完全分离。
3.3 结果参照《化学药物残留溶剂研究的技术指导原则》 [10]及《中国药典》2015年版四部[11],二氯甲烷为应限制使用的第一类溶剂,限度为0.06%;甲醇、正己烷、四氢呋喃、吡啶、甲苯为应限制使用的第二类溶剂,限度分别为0.3%、0.029%、0.027%、2%和0.089%;丙酮、乙醇和乙酸乙酯为应限制使用的第三类溶剂,限度分别为0.5%、0.5%和0.5%;异辛烷为尚无足够毒性资料的溶剂,暂按第三类溶剂进行限量,限度为0.5%。达比加群酯的10种残留溶剂在限度范围内线性关系、精密度良好,样品检测中除乙酸乙酯有少量残留外,其他溶剂均无残留。
| [1] |
吕超军, 谭初兵, 周植星, 等. 新型口服抗凝药达比加群酯[J]. 中国新药与临床杂志, 2012, 31(3): 113-116. |
| [2] |
田国祥, 魏万林, 张灵. 后华法林时代口服抗凝新秀:达比加群酯、利伐沙班、阿哌沙班[J]. 中国循证心血管医学杂志, 2011, 3(5): 403-406. |
| [3] |
高航, 宗新杰, 刘长鹰, 等. 达比加群酯的合成工艺研究[J]. 现代药物与临床, 2014, 29(12): 1331-1333. |
| [4] |
朱津津, 樊士勇, 仲伯华. 达比加群酯的合成工艺改进[J]. 中国药物化学杂志, 2012, 22(3): 204-207. |
| [5] |
Hans-JoachimKromidas, 陈小明. 液相与气相色谱定量分析使用指南[M]. 北京: 人民卫生出版社, 2010: 241-250.
|
| [6] |
胡昌勤, 刘颖. 药物残留溶剂的监控及其分析方法[J]. 药学学报, 2007, 42(12): 20-25. |
| [7] |
HUGHES B. First Oral Warfarin Afternative Approved in the US[J]. Nat Rev Drug Discov, 2010, 9(12): 903-906. DOI:10.1038/nrd3322 |
| [8] |
Balaji N, Sivaraman VR, Neeraja P. GC Quantification of Residual Hexylmethanesulfonate in Dabigatran Etexilate Me-sylate[J]. IOSR Journal of Applied Chemistry, 2012, 2(6): 48-51. DOI:10.9790/5736 |
| [9] |
冯光玲, 丁文娟, 冯爱国, 等. 毛细管气相色谱法测定阿莫曲坦原料药中8种有机溶剂残留量[J]. 中国药房, 2014, 25(5): 453-456. DOI:10.6039/j.issn.1001-0408.2014.05.23 |
| [10] |
中国药品生物制品检定所. 中国药品检验标准操作规范[M]. 北京: 中国医药科技出版社, 2010: 229-237.
|
| [11] |
中国药典: 四部[S]. 2015: 105-109. http://www.wenkuxiazai.com/doc/d24738bdbd64783e08122b7c.html
|
 2017, Vol. 31
2017, Vol. 31 
